Ministério da Saúde - MS
Agência Nacional de Vigilância Sanitária - ANVISA
INSTRUÇÃO NORMATIVA Nº 6, DE 22 DE MAIO DE 2009
(Publicada em DOU nº 97, de 25 de maio de 2009)
(Revogada pela Resolução – RDC nº 48, de 6 de outubro de 2009)
Dispõe sobre o tratamento de petições de
alterações pós-registro de medicamentos.
A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso da
atribuição que lhe confere o art. 11, inciso IV, do Regulamento da Anvisa, aprovado
pelo Decreto nº 3.029, de 16 de abril de 1999, e tendo em vista o disposto nos
parágrafos 1° e 3° do art. 54 e no inciso II do art. 55 do Regimento Interno aprovado
nos termos do Anexo I da Portaria n° 354 da ANVISA, de 11 de agosto de 2006,
republicada no DOU de 21 de agosto de 2006, em reunião realizada em 19 de maio de
2009, e
considerando as disposições contidas na Lei n.º 6.360, de 23 de setembro de 1976,
e no Decreto n.º 79.094, de 5 de janeiro de 1977, acerca do sistema de vigilância
sanitária a que ficam sujeitos os medicamentos;
considerando que o registro dos produtos de que trata a Lei n.º 6.360, de 23 de
setembro de 1976, poderá ser objeto de regulamentação pela ANVISA, visando a
desburocratização e a agilidade nos procedimentos, nos termos do art. 41 da Lei n.º
9.782, de 26 de janeiro de 1999;
considerando a missão institucional da ANVISA de promover a proteção da saúde
da população, por intermédio do controle sanitário da produção e da comercialização de
produtos e serviços submetidos à vigilância sanitária, inclusive dos ambientes, dos
processos, dos insumos e das tecnologias a eles relacionados, nos termos do art. 6º da
Lei n.º 9.782, de 26 de janeiro de 1999;
considerando a possibilidade de a ANVISA, a qualquer tempo, solicitar
esclarecimentos e/ou novos documentos e inspecionar a empresa fabricante/produtora,
para verificação de documentação;
considerando o baixo risco sanitário de determinadas alterações pós-registro de
medicamentos;
considerando a determinação constitucional que assegura a razoável duração do
processo e os meios que garantam a celeridade de sua tramitação, nos termos do art. 5º,
inciso LXXVIII, da Constituição Federal de 1988,
adota a seguinte Instrução Normativa e eu, Diretor-Presidente, determino a sua
publicação:
Este texto não substitui o(s) publicado(s) em Diário Oficial da União.
Ministério da Saúde - MS
Agência Nacional de Vigilância Sanitária - ANVISA
Art. 1º As petições de alterações pós-registro de medicamentos genéricos,
similares, específicos e novos, contempladas na relação constante do Anexo desta
Instrução Normativa serão consideradas anuídas, permitindo-se sua imediata
implementação pelas empresas, desde que não tenha sido exarada nenhuma exigência e
não necessitem apresentar estudo de Bioequivalência e Biodisponibilidade, estudos
clínicos e equivalência farmacêutica.
Art. 2° As petições de alterações pós-registro não relacionadas no Anexo desta
Instrução Normativa terão seu procedimento de análise mantido, de forma que somente
poderão ser implementadas após manifestação favorável da ANVISA.
Art. 3º A autenticidade das informações prestadas é de responsabilidade do
detentor do registro e qualquer irregularidade detectada pela ANVISA, em
contrariedade ao disposto na legislação sanitária pertinente, confira infração sanitária,
nos termos da Lei nº 6.437, de 20 de agosto de 1977.
Art. 4º Esta Instrução Normativa entra em vigor na data de sua publicação.
DIRCEU RAPOSO DE MELLO
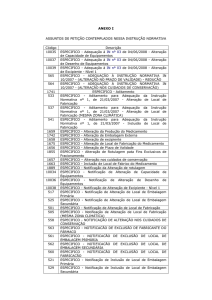
ANEXO I
ASSUNTOS DE PETIÇÃO CONTEMPLADOS NESSA INSTRUÇÃO
NORMATIVA
Código
10035
10037
10039
565
564
1741
533
537
541
Descrição
ESPECÍFICO - Adequação à IN nº 03 de 04/06/2008 - Alteração de
Capacidade de Equipamentos
ESPECÍFICO - Adequação à IN nº 03 de 04/06/2008 - Alteração de
Desenho de Equipamentos
ESPECÍFICO - Adequação à IN nº 03 de 04/06/2008 - Alteração de
Excipiente - Nível 1
ESPECÍFICO - ADEQUAÇÃO À INSTRUÇÃO NORMATIVA IN
10/2007 - (ALTERAÇÃO NO PRAZO DE VALIDADE) - REDUÇÃO
ESPECÍFICO - ADEQUAÇÃO À INSTRUÇÃO NORMATIVA IN
10/2007 - (ALTERAÇÃO NOS CUIDADOS DE CONSERVAÇÃO)
ESPECÍFICO - Aditamento
ESPECÍFICO - Aditamento para Adequação da Instrução Normativa nº 1,
de 21/03/2007 – Alteração de Local de Fabricação
ESPECÍFICO - Aditamento para Adequação da Instrução Normativa nº 1,
de 21/03/2007 – Alteração de Local de Fabricação (MESMA ZONA
CLIMÁTICA)
ESPECÍFICO - Aditamento para Adequação da Instrução Normativa nº 1,
Este texto não substitui o(s) publicado(s) em Diário Oficial da União.
Ministério da Saúde - MS
Agência Nacional de Vigilância Sanitária - ANVISA
1659
1742
1658
1657
1656
1855
1657
1663
1889
10034
10036
10038
517
525
501
505
558
563
561
562
560
521
529
509
513
559
1358
10023
10025
10027
de 21/03/2007 – Inclusão de Local de Fabricação
ESPECÍFICO - Alteração da Produção do Medicamento
ESPECÍFICO - Alteração de Embalagem Externa
ESPECÍFICO - Alteração de excipiente
ESPECÍFICO - Alteração de Local de Fabricação do Medicamento
ESPECÍFICO - Alteração de Prazo de Validade
ESPECÍFICO - Alteração de Rotulagem para Fins Exclusivos de
Fracionamento
ESPECÍFICO - Alteração nos cuidados de conservação
ESPECÍFICO - Inclusão de Local de Fabrico do Medicamento
ESPECÍFICO - Notificação da alteração de rotulagem
ESPECÍFICO - Notificação de Alteração de Capacidade de Equipamentos
ESPECÍFICO - Notificação de Alteração de Desenho de Equipamentos
ESPECÍFICO - Notificação de Alteração de Excipiente - Nível 1
ESPECÍFICO - Notificação de Alteração de Local de Embalagem Primária
ESPECÍFICO - Notificação de Alteração de Local de Embalagem
Secundária
ESPECIFICO - Notificação de Alteração de Local de Fabricação
ESPECIFICO - Notificação de Alteração de Local de Fabricação (MESMA
ZONA CLIMÁTICA)
ESPECÍFICO - NOTIFICAÇÃO DE ALTERAÇÃO NOS CUIDADOS
DE CONSERVAÇÃO
ESPECÍFICO - NOTIFICAÇÃO DE EXCLUSÃO DE FABRICANTE DO
FÁRMACO
ESPECIFICO - NOTIFICAÇÃO DE EXCLUSÃO DE LOCAL DE
EMBALAGEM PRIMÁRIA
ESPECÍFICO - NOTIFICAÇÃO DE EXCLUSÃO DE LOCAL DE
EMBALAGEM SECUNDÁRIA
ESPECÍFICO - NOTIFICAÇÃO DE EXCLUSÃO DE LOCAL DE
FABRICAÇÃO
ESPECÍFICO - Notificação de Inclusão de Local de Embalagem Primária
ESPECÍFICO - Notificação de Inclusão de Local de Embalagem
Secundária
ESPECÍFICO - Notificação de Inclusão de Local de Fabricação
ESPECIFICO - Notificação de Inclusão de Local de Fabricação (MESMA
ZONA CLIMÁTICA)
ESPECÍFICO - NOTIFICAÇÃO DE REDUÇÃO NO PRAZO DE
VALIDADE
ESPECIFICO - Solicitação de Correção de Dados na Base
GENÉRICO - Adequação à IN nº 03 de 04/06/2008 - Alteração de
Capacidade de Equipamentos
GENÉRICO - Adequação à IN nº 03 de 04/06/2008 - Alteração de
Desenho de Equipamentos
GENÉRICO - Adequação à IN nº 03 de 04/06/2008 - Alteração de
Excipiente - Nível 1
Este texto não substitui o(s) publicado(s) em Diário Oficial da União.
Ministério da Saúde - MS
Agência Nacional de Vigilância Sanitária - ANVISA
583
582
1952
535
539
1861
1406
1402
553
1403
1404
1405
1407
1853
1408
1409
1364
1412
556
566
1963
1417
1418
10022
10024
10026
519
527
503
507
GENÉRICO - ADEQUAÇÃO À INSTRUÇÃO NORMATIVA IN
10/2007 - (ALTERAÇÃO NO PRAZO DE VALIDADE) - REDUÇÃO
GENÉRICO - ADEQUAÇÃO À INSTRUÇÃO NORMATIVA IN
10/2007 - (ALTERAÇÃO NOS CUIDADOS DE CONSERVAÇÃO)
GENERICO - Aditamento
GENERICO - Aditamento para Adequação da Instrução Normativa nº 1,
de 21/03/2007 – Alteração de Local de Fabricação
GENÉRICO - Aditamento para Adequação da Instrução Normativa nº 1,
de 21/03/2007 – Alteração de Local de Fabricação (MESMA ZONA
CLIMÁTICA)
GENERICO - Aditamento para fins exclusivos de fracionamento (ATENÇÃO = ESTE ASSUNTO DEVE SER UTILIZADO APENAS
PARA ADEQUAR A EMBALAGEM OU ACRESCENTAR UMA
APRESENTAÇÃO COMERCIAL FRACIONÁVEL DE UM
MEDICAMENTO ANTES DE CONCLUÍDA A ANÁLISE TÉCNICA,
NOS CASOS EM QUE O INTERESSADO JÁ TENHA PETICIONADO
O REGISTRO DO MEDICAMENTO OU A INCLUSÃO PÓSREGISTRO DE UMA NOVA APRESENTAÇÃO COMERCIAL )
GENERICO - Alteração da Produção do Medicamento
GENERICO - Alteração da Rota de Síntese do Fármaco
GENÉRICO - Alteração de Embalagem Externa
GENERICO - Alteração de excipiente
GENERICO - Alteração de Fabricante do Fármaco
GENERICO - Alteração de local de fabricação.
GENERICO - Alteração de Prazo de Validade
GENERICO - Alteração de Rotulagem para Fins Exclusivos de
Fracionamento
GENERICO - Alteração do Tamanho do Lote (igual ou acima de dez
vezes)
GENERICO - Alteração nos cuidados de conservação
GENERICO - Atualização de Especificações e/ou Metodologia Analítica
GENERICO - Inclusão de fabricante do fármaco
GENÉRICO - Inclusão de Indicação Terapêutica já Aprovada no País
GENÉRICO - Inclusão de Local de Fabrico do Medicamento
GENERICO - Inclusão no Tamanho do Lote (igual ou acima de dez vezes)
GENERICO - Notificação da alteração de rotulagem
GENERICO - Notificação da Alteração de Texto de Bula
GENÉRICO - Notificação de Alteração de Capacidade de Equipamentos
GENÉRICO - Notificação de Alteração de Desenho de Equipamentos
GENÉRICO - Notificação de Alteração de Excipiente - Nível 1
GENERICO - Notificação de Alteração de Local de Embalagem Primária
GENERICO - Notificação de Alteração de Local de Embalagem
Secundária
GENERICO - Notificação de Alteração de Local de Fabricação
GENERICO - Notificação de Alteração de Local de Fabricação (MESMA
Este texto não substitui o(s) publicado(s) em Diário Oficial da União.
Ministério da Saúde - MS
Agência Nacional de Vigilância Sanitária - ANVISA
576
581
579
580
578
523
531
511
515
577
1361
10017
10019
10021
574
575
1432
536
540
544
548
1474
1433
1473
ZONA CLIMÁTICA)
GENÉRICO - NOTIFICAÇÃO DE ALTERAÇÃO NOS CUIDADOS DE
CONSERVAÇÃO
GENÉRICO - NOTIFICAÇÃO DE EXCLUSÃO DE FABRICANTE DO
FÁRMACO
GENÉRICO - NOTIFICAÇÃO DE EXCLUSÃO DE LOCAL DE
EMBALAGEM PRIMÁRIA
GENÉRICO - NOTIFICAÇÃO DE EXCLUSÃO DE LOCAL DE
EMBALAGEM SECUNDÁRIA
GENÉRICO - NOTIFICAÇÃO DE EXCLUSÃO DE LOCAL DE
FABRICAÇÃO
GENERICO - Notificação de Inclusão de Local de Embalagem Primária
GENERICO - Notificação de Inclusão de Local de Embalagem Secundária
GENÉRICO - Notificação de Inclusão de Local de Fabricação
GENERICO - Notificação de Inclusão de Local de Fabricação (MESMA
ZONA CLIMÁTICA)
GENÉRICO - NOTIFICAÇÃO DE REDUÇÃO NO PRAZO DE
VALIDADE
GENERICO - Solicitação de Correção de Dados na Base
MEDICAMENTO NOVO - Adequação à IN nº. 03 de 04/06/2008 Alteração de Capacidade de Equipamentos
MEDICAMENTO NOVO - Adequação à IN nº. 03 de 04/06/2008 Alteração de Desenho de Equipamentos
MEDICAMENTO NOVO - Adequação à IN nº. 03 de 04/06/2008 Alteração de Excipiente - Nível 1
MEDICAMENTO NOVO - ADEQUAÇÃO À INSTRUÇÃO
NORMATIVA IN 10/2007 - (ALTERAÇÃO NOS CUIDADOS DE
CONSERVAÇÃO)
MEDICAMENTO NOVO - ADEQUAÇÃOÀ INSTRUÇÃO
NORMATIVA IN 10/2007 - (ALTERAÇÃO NO PRAZO DE
VALIDADE) - REDUÇÃO
1432 MEDICAMENTO NOVO - Aditamento
MEDICAMENTO NOVO - Aditamento para Adequação da Instrução
Normativa nº 1, de 21/03/2007 - Alteração de Local de Fabricação
MEDICAMENTO NOVO - Aditamento para Adequação da Instrução
Normativa nº 1, de 21/03/2007 - Alteração de Local de Fabricação
(MESMA ZONA CLIMÁTICA)
MEDICAMENTO NOVO - Aditamento para Adequação da Instrução
Normativa nº 1, de 21/03/2007 - Inclusão de Local de Fabricação
MEDICAMENTO NOVO - Aditamento para Adequação da Instrução
Normativa nº 1, de 21/03/2007 - Inclusão de Local de Fabricação
(MESMA ZONA CLIMÁTICA)
MEDICAMENTO NOVO - Alteração da Produção do Medicamento
MEDICAMENTO NOVO - Alteração de Embalagem Externa
MEDICAMENTO NOVO - Alteração de excipiente
Este texto não substitui o(s) publicado(s) em Diário Oficial da União.
Ministério da Saúde - MS
Agência Nacional de Vigilância Sanitária - ANVISA
1434
1435
1471
1852
1316
1612
1472
1331
1489
1314
1454
1469
10016
10018
10020
520
528
504
508
567
573
570
571
569
524
532
512
MEDICAMENTO NOVO - Alteração de Fabricante do fármaco
MEDICAMENTO NOVO - Alteração de local de fabricação.
MEDICAMENTO NOVO - Alteração de Prazo de Validade
MEDICAMENTO NOVO - Alteração de Rotulagem para Fins Exclusivos
de Fracionamento
MEDICAMENTO NOVO - Alteração do Tamanho do Lote (igual ou
acima de dez vezes)
MEDICAMENTO NOVO - Alteração na rota de sintese do fármaco
MEDICAMENTO NOVO - Alteração nos cuidados de conservação
MEDICAMENTO NOVO - Atualização de Especificações e/ou
Metodologia Analítica
MEDICAMENTO NOVO - Inclusão de fabricante do fármaco
MEDICAMENTO NOVO - Inclusão de Local de Fabrico do Medicamento
MEDICAMENTO NOVO - Inclusão no Tamanho do Lote (igual ou acima
de dez vezes)
MEDICAMENTO NOVO - Notificação da alteração de rotulagem
MEDICAMENTO NOVO - Notificação de Alteração de Capacidade de
Equipamentos
MEDICAMENTO NOVO - Notificação de Alteração de Desenho de
Equipamentos
MEDICAMENTO NOVO - Notificação de Alteração de Excipiente - Nível
1
MEDICAMENTO NOVO - Notificação de Alteração de Local de
Embalagem Primária
MEDICAMENTO NOVO - Notificação de Alteração de Local de
Embalagem Secundária
MEDICAMENTO NOVO - Notificação de Alteração de Local de
Fabricação
MEDICAMENTO NOVO - Notificação de Alteração de Local de
Fabricação (MESMA ZONA CLIMÁTICA)
MEDICAMENTO NOVO - NOTIFICAÇÃO DE ALTERAÇÃO NOS
CUIDADOS DE CONSERVAÇÃO
MEDICAMENTO NOVO - NOTIFICAÇÃO DE EXCLUSÃO DE
FABRICANTE DO FÁRMACO
MEDICAMENTO NOVO - NOTIFICAÇÃO DE EXCLUSÃO DE
LOCAL DE EMBALAGEM PRIMÁRIA
MEDICAMENTO NOVO - NOTIFICAÇÃO DE EXCLUSÃO DE
LOCAL DE EMBALAGEM SECUNDÁRIA
MEDICAMENTO NOVO - NOTIFICAÇÃO DE EXCLUSÃO DE
LOCAL DE FABRICAÇÃO
MEDICAMENTO NOVO - Notificação de Inclusão de Local de
Embalagem Primária
MEDICAMENTO NOVO - Notificação de Inclusão de Local de
Embalagem Secundária
MEDICAMENTO NOVO - Notificação de Inclusão de Local de
Este texto não substitui o(s) publicado(s) em Diário Oficial da União.
Ministério da Saúde - MS
Agência Nacional de Vigilância Sanitária - ANVISA
516
568
1337
10029
10031
10033
591
590
1416
534
538
542
546
1423
1973
10116
554
1972
1628
1630
1974
1858
1975
Fabricação
MEDICAMENTO NOVO - Notificação de Inclusão de Local de
Fabricação (MESMA ZONA CLIMÁTICA)
MEDICAMENTO NOVO - NOTIFICAÇÃO DE REDUÇÃO NO PRAZO
DE VALIDADE
MEDICAMENTO NOVO - Solicitação de Correção de Dados na Base
SIMILAR - Adequação à IN nº 03 de 04/06/2008 - Alteração de
Capacidade de Equipamentos
SIMILAR - Adequação à IN nº 03 de 04/06/2008 - Alteração de Desenho
de Equipamentos
SIMILAR - Adequação à IN nº 03 de 04/06/2008 - Alteração de Excipiente
- Nível 1
SIMILAR - ADEQUAÇÃO À INSTRUÇÃO NORMATIVA IN 10/2007 (ALTERAÇÃO NO PRAZO DE VALIDADE) - REDUÇÃO
SIMILAR - ADEQUAÇÃO À INSTRUÇÃO NORMATIVA IN 10/2007 (ALTERAÇÃO NOS CUIDADOS DE CONSERVAÇÃO )
SIMILAR - Aditamento
SIMILAR - Aditamento para Adequação da Instrução Normativa nº 1, de
21/03/2007 - Alteração de Local de Fabricação
SIMILAR - Aditamento para Adequação da Instrução Normativa nº 1, de
21/03/2007 - Alteração de Local de Fabricação (MESMA ZONA
CLIMÁTICA)
SIMILAR - Aditamento para Adequação da Instrução Normativa nº 1, de
21/03/2007 - Inclusão de Local de Fabricação
SIMILAR - Aditamento para Adequação da Instrução Normativa nº 1, de
21/03/2007 - Inclusão de Local de Fabricação (MESMA ZONA
CLIMÁTICA)
SIMILAR - Aditamento para fins exclusivos de fracionamento (ATENÇÃO = ESTE ASSUNTO DEVE SER UTILIZADO APENAS
PARA ADEQUAR A EMBALAGEM OU ACRESCENTAR UMA
APRESENTAÇÃO COMERCIAL FRACIONÁVEL DE UM
MEDICAMENTO ANTES DE CONCLUÍDA A ANÁLISE TÉCNICA,
NOS CASOS EM QUE O INTERESSADO JÁ TENHA PETICIONADO
O REGISTRO DO MEDICAMENTO OU A INCLUSÃO PÓSREGISTRO DE UMA NOVA APRESENTAÇÃO COMERCIAL )
SIMILAR - Alteração da Produção do Medicamento
SIMILAR - Alteração da Rota de Síntese do Fármaco
SIMILAR - Alteração de Embalagem Externa
SIMILAR - Alteração de excipiente
SIMILAR - Alteração de Fabricante do fármaco
SIMILAR - Alteração de local de fabricação.
SIMILAR - Alteração de Prazo de Validade
SIMILAR - Alteração de Rotulagem para Fins Exclusivos de
Fracionamento
SIMILAR - Alteração do Tamanho do lote (igual ou acima de 10 vezes)
Este texto não substitui o(s) publicado(s) em Diário Oficial da União.
Ministério da Saúde - MS
Agência Nacional de Vigilância Sanitária - ANVISA
1976
1971
1978
555
1997
1991
1993
1982
1808
10028
10030
10032
518
526
502
506
584
589
587
588
586
522
530
514
585
1895
SIMILAR - Alteração nos cuidados de conservação
SIMILAR - Atualização de Especificações e/ou Metodologia Analítica
SIMILAR - Inclusão de fabricante do fármaco
SIMILAR - Inclusão de Indicação Terapêutica já Aprovada no País
SIMILAR - Inclusão de Local de Fabrico do Medicamento
SIMILAR - Inclusão de nova via de adminstração já aprovada no Pais.
SIMILAR - Inclusão no Tamanho do Lote (igual ou acima de dez vezes)
SIMILAR - Notificação da alteração de rotulagem
SIMILAR - Notificação da Alteração de Texto de Bula
SIMILAR - Notificação de Alteração de Capacidade de Equipamentos
SIMILAR - Notificação de Alteração de Desenho de Equipamentos
SIMILAR - Notificação de Alteração de Excipiente - Nível 1
SIMILAR - Notificação de Alteração de Local de Embalagem Primária
SIMILAR - Notificação de Alteração de Local de Embalagem Secundária
SIMILAR - Notificação de Alteração de Local de Fabricação
SIMILAR - Notificação de Alteração de Local de Fabricação ( MESMA
ZONA CLIMÁTICA)
SIMILAR - NOTIFICAÇÃO DE ALTERAÇÃO NOS CUIDADOS DE
CONSERVAÇÃO
SIMILAR - NOTIFICAÇÃO DE EXCLUSÃO DE FABRICANTE DO
FÁRMACO
SIMILAR - NOTIFICAÇÃO DE EXCLUSÃO DE LOCAL DE
EMBALAGEM PRIMÁRIA
SIMILAR - NOTIFICAÇÃO DE EXCLUSÃO DE LOCAL DE
EMBALAGEM SECUNDÁRIA
SIMILAR - NOTIFICAÇÃO DE EXCLUSÃO DE LOCAL DE
FABRICAÇÃO
SIMILAR - Notificação de Inclusão de Local de Embalagem Primária
SIMILAR - Notificação de Inclusão de Local de Embalagem Secundária
SIMILAR - Notificação de Inclusão de Local de Fabricação (MESMA
ZONA CLIMÁTICA)
SIMILAR - NOTIFICAÇÃO DE REDUÇÃO NO PRAZO DE
VALIDADE
SIMILAR - Solicitação de Correção de Dados na Base
Este texto não substitui o(s) publicado(s) em Diário Oficial da União.