Mini-curso MC-14/ Oceanografia Química
Mini-curso MC-14/ Oceanografia Química
- Salinidade
- Composição da água do mar
- Matéria orgânica nos oceanos
Vanessa Hatje
Laboratório de Oceanografia Química, UFBA
[email protected]
62°Reunião Anual da SBPC, 25 a 30/7/2010
62°Reunião Anual da SBPC, 25 a 30/7/2010
Salinidade nos oceanos
• As águas dos rios, lagos, chuva e mar apresentam
salinidade….. i.e. apresentam sais dissolvidos em
sua composição.
Salinidade
Salinidade é a massa total, expressa em gramas, de todas as
substâncias dissolvidas em um kilo de água do mar quando
todo o carbonato tenha sido substituído por uma quantidade
equivalente de óxido, todo brometo e iodeto tenha sido
substituído por cloreto e todos os compostos orgânicos
tenham sido oxidados em uma temperatura de 480oC.
1
Como determinar a salinidade?
Precipitação?
Precisão de medidas de salinidade
determinadas por diferentes métodos
Sais menos solúveis atingem a saturação primeiro e precipitam.
A ordem de ppt é função da solubilidade e não da abundância.
1) Composição dos componentes maiores
± 0.01
2) Evaporação
± 0.01
3) Clorinidade
± 0.002
5) Densidade
± 0.004
6) Condutividade
± 0.001
7) Índice de refração
± 0.05
Ordem de precipitação
Salinidade nos oceanos
CTD é o instrumento mais utilizado para medir
salinidade, temperatura, pressão e profundidade.
CTD significa: Condutividade –Temperatura –
Depth (profundidade).
• Média do oceano: 33 – 37
• Hipersalinos: S > 40
O CTD pode ser fixo ou utilizado para fazer perfis
verticais.
Alguns CTDs são tão rápidos que podem fazer até
24 medidas por segundo!
– Mar Morto, Vermelho
• Hiposalinos/salobro: S < 25
– Estuários e baías costeiras
2
Salinidade
• Porque o mar é salgado?
• Porque o mar não é doce como os rios que
deságuam no oceano?
• Porque a água do mar tem uma composição
química tão uniforme?
Salinidade nos oceanos está em condição “steadystate”, ou estacionária, pois a quantidade de sal
adicionada (fontes) no sistema é igual a quantidade de
sal removida (sumidouros) ao longo do tempo.
Variações temporais e espaciais da salinidade
• Salinidade é conservativa: controles físicos
– Salinidade ↑: congelamento e evaporação
– Salinidade ↓: precipitação, escoamento e
descongelamento
• Oceano aberto
– Balanço evaporação - precipitação
• Latitude controla a taxa destes processos
• Zona costeira
– Aporte fluvial
– Lençol freático
• Zonas polares
– degelo
Controles da variação da salinidade na superfície
Variação anual da salinidade é 0,5 (33 a 37).
Maiores salinidades são observadas no Mediterrâneo 39 e no Mar Vermelho 41.
3
Águas superficiais do
Oceano Atlântico Tropical
estão se tornando mais
salgadas (0,1 – 0,4).....
Mudança da salinidade nos últimos 40 anos
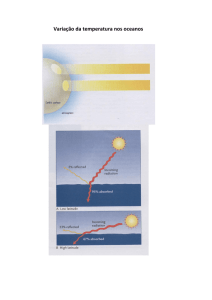
Taxa de evaporação
aumentou 5-10% nas últimas
4 décadas. Oceanos
aumentaram 1°C.
• Oceanos: gde reservatório de água
– 86% evaporação
– 78% precipitação
Controle do
ciclo hidrológico
1967-1972
• Linha entre Groelândia e o sul da América do Sul
–
–
–
–
50°S - 60°N
Mínimas e máximas de E- P nos dois hemisférios
50 anos de dados
Estoque de água doce do mar Nórdico e bacias sub-polares
aumentou 19.000 km3 entre 1960 - 1990
Curry et al., 2003 Nature, 426, 826p.
Curry e Mauritzen, 2005 Science, 308, 1772p.
Efeito de larga escala
1980-1984
1995-2000
Água doce está sendo
perdida nas baixas latitudes
e está se acumulando nos
pólos numa velocidade maior
do que a circulação do
oceano pode compensar
Consequentemente, as águas
de fundo do Atlântico Norte
estão apresentando salinidades
mais baixas
http://www.whoi.edu/institutes/occi/currenttopics/abruptclimate_rcurry_pr.html
E se a salinidade no Atlântico Norte diminuir muito?
Contraste de densidade impulsiona a MOC Atlântica (transporte de calor):
• O aquecimento da superfície da terra: ↑ evaporação e ↑
salinidade em baixas latitudes, e assim, transportando
mais vapor de água doce para os pólos.
• Ciclo hidrológico:
– padrão de precipitação (distribuição, severidade e
freqüência das secas, cheias e tempestades)
– Isso, por si só, poderia aumentar o aquecimento
global, pois estaria adicionando mais vapor d’água na
atm, o qual é um potente gás estufa.
- Água vai parar de afundar e circulação termohalina diminui
MOC
Meridional
Overturning
Circulation
• ↓ salinidade das águas no Atlântico Norte poderia evitar
seu afundamento, ao ponto de diminuir a velocidade ou
até interromper a circulação do oceano.
4
• Isso já aconteceu na história....e causou um esfriamento
na região do Atlântico Norte e secas em várias áreas do
HN em períodos de tempo que variaram de anos a
décadas.
• O degelo das capotas polares no Ártico também são
fontes adicionais de água doce.
• Um esfriamento do Atlântico Norte iria reduzir o processo
de degelo, diminuir o aporte de água doce para o Atlântico
Norte e a circulação termohalina voltaria.
• Entretanto, o aquecimento global e a aceleração do ciclo
de água continuaria a colocar mais água doce para as
altas latitudes.
Ambientes costeiros
• Condições costeiras x oceânicas
– Forçantes: maré, aporte fluvial, vento
– Variações espaciais e temporais são maiores
– Influência antrópica:
•
•
•
•
Maiores gradientes são observados em estuário.
Mas o que são estuários?
Conceitos e características
• Aestuarium = maré, onda abrupta de grande altura
• Estuários: encontro do rio com o mar
• Conexão livre com o oceano
• Ambiente de transição:
– complexo e vulnerável
Carga de sólidos dissolvidos e particulados
Contaminantes orgânicos e inorgânicos
Descarga de líquidos
Portos, barragens
Estuários
• Inicialmente: receptor de esgotos
Metade do século XIX
• Crescimento econômico:
–
–
–
–
–
Acesso ao interior
Portos
Férteis: pesca
Alta taxa de renovação de água
Receptor de esgotos
• Biologicamente produtivos
– nutrientes
5
Zona Costeira: estuários
• 70% da população mundial
• 2/3 das grandes cidades
Definição e Terminologia
• Um estuário pode ser definido de várias maneiras,
i.e. química, física, geologia
• Pritchard (1955) e Cameron & Pritchard (1963):
“estuário é um corpo d’água costeiro semifechado,
com uma livre ligação com o oceano aberto, no
interior da qual a água do mar é mensuravelmente
diluída pela água doce oriunda da drenagem
continental”
• Ambiente altamente impactado
– Contaminação orgânica e inorgânica
– Alta taxa de sedimentação/dragagem
– Perda de habitat
• 70% estuários americanos estão impactados
Distribuição horizontal da salinidade
Perillo, 1995: visão ecológica
isolinhas
“ Estuário é um corpo de água costeiro semifechado, estendendo-se até o limite efetivo da
influência da maré. Dentro dele a água do mar é
diluída significativamente com a água fluvial
proveniente da drenagem continental, podendo
sustentar espécies biológicas eurihalinas durante
uma parte ou por todo o seu ciclo de vida.”
Limite intrusão salina
Miranda et al., 2002
6
Delimitação funcional do estuário
• Zona fluvial: movimentos unidirecionais de água cuja
origem é a drenagem continental
Delimitação funcional do estuário
Limite do efeito da maré
Influência fluvial
S<1
Zona de turbidez
máxima
• Zona de mistura: mistura da água doce e água do mar
• Zona de turbidez máxima: zona de transição, onde a
velocidade resultante dos movimentos convergentes é
nula. Região de alta concentração de MS
Zona de mistura
1<S<35
Pluma estuarina
• Zona de salinidade mínima: 0-5, altamente reativa
Composição da água do mar
Composição da água do mar
• Ciclo hidrológico altera a composição das águas
– Precipitação
– Dissolução
– Evaporação
– Mistura
7
Composição da água do mar
Qual é a composição da água do mar?
Sólidos ( > 0,45 µm)
1.
-
Dissolvido ( < 0,45 µm) orgânica e inorgânica
2.
-
Apenas sais dissolvidos?
Material particulado orgânico (detritos, fito e zooplâncton)
Material particulado inorgânico (minerais)
Maiores (> 1ppm) Ca, Na, K, Mg, Cl
Menores (<< 1ppm) metais, nutrientes e matéria orgânica
Colóides ( < 0,45 µm)
3.
-
4.
Orgânicos (açucares)
Inorgânicos (hydróxidos de Fe)
Gases
-
Conservativos (N2, Ar)
Não-conservativos (O2, CO2)
Divisão operacional
Particulado
mm
Dissolvida
µm
zoo
Fito
bactéria
Detritos
peneiras
colóides
filtros
nm
Quais são os principais constituintes
da fração dissolvida?
Vírus
ultra filtros
peneiras moleculares
8
Sais Dissolvidos
•
•
•
•
•
•
•
Cl- (cloreto) 56%
Na+ (sódio) 28%
SO42-(sulfato) 8%
Mg2+ (magnésio) 4%
Ca2+ (cálcio) 1,5%
K+ (potássio) 1%
HCO3- (bicarbonato) 0,5%
Composição da água do mar
Constituintes maiores (1 ppm)
Íons Maiores
Constituintes traço (1 ppb)
Representam mais de 99%
•
•
•
•
•
•
•
•
Elementos mais abundantes na
crosta terrestre
Si 28,2%
Al 8,2%
Fe 5,6%
Ca 4,2%
Na 2,4%
K 2,4%
Mg 2%
Ti 0,6%
Quantos elementos abundantes
na crosta terrestre estão
presentes na água do mar em
grandes concentrações??
Cl-, Na, SO42-??
Apenas o Na, K, Mg e Ca
PORQUE?
• Grau de solubilidade
• Comportamento/reatividade química
Ex:
Si, Al pouco solúvel
Na, Ca e P muito solúvel
9
Teoria das Proporções Constantes
Princípio de Marcet
• As concentrações dos íons maiores
dissolvidos podem variar de lugar para lugar,
mas a proporção relativa se mantém constante.
Qual é a razão de K na concentração
total de salinidade?
• Salinidade 34,482:
Concentração K
Salinidade total
• A salinidade total pode variar, mas as
proporções dos elementos são constantes.
- não tem efeito na proporção relativa dos íons maiores
- a concentração dos íons varia na mesma proporção
0,380 = 0,011 (cte)
34,482
Se a salinidade for 37 qual será a
concentração de K???
Fatores que podem alterar a salinidade
Em termos gerais:
Salinidade varia em função do balanço E - P, e a
mistura/diluição de águas.
=
•
•
•
•
•
Evaporação
Dissolução
Precipitação
Congelamento
Oxidação
Quais são as regiões/áreas que estes processos podem
mudar a composição de elementos maiores?
• Estuários, bacias anóxicas, bacias evaporação, ventes....
10
Componentes maiores de vários rios
1. Estuários e zonas costeiras
• Influência do aporte fluvial
– 10 - 200 mg/kg sólidos dissolvidos
– Bacia de drenagem
• geologia, tipo de solo, clima
– Basaltos e granitos são as principais rochas fonte
MILLERO, 2006
Intemperismo
Resultado do Intemperismo
- Água + silicatos (feldspato, quartzo, etc.)
silicatos + CO2 + H2O = argilo minerais + Sidis +
MILLERO, 2006
Na+,
• Adição de cátions e alcalinidade
Ca2+,
HCO3-
- Água + carbonatos (calcita e dolomita)
• Remoção de O2 e CO2 da atmosfera
• Água fluvial
– pH 7,3 - 8
– Cátions: Ca2+, Mg2+ e Na+
– Ánions: HCO3-, SO42- e Cl-
Libes, 1992
11
2. Bacias Anóxicas
Água do mar
• Baixa razão SO4-2/Cl-: bactérias fazendo sulfato
redução. H2S é perdido por precipitação do FeS2 e
ZnS, CuS, etc.
Água fluvial
– Baixa circulação
– Alta taxa de matéria orgânica
Ex: Mar Negro
MILLERO, 2006
3. Precipitação e dissolução
4. Congelamento
- Dissolução de CaCO3
na água de fundo
- Precipitação de sais mudando a
composição da solução
- Zonas de gde evaporação
- Circulação restrita
- Formação de evaporitos
- NaCl (haleto)
- CaCO3 (carbonato)
- CaMg(CO3)2 (dolomita)
• Sais podem ficar oclusos no gelo. Ex: o gelo tem a
razão SO4-2/Cl- maior que a água o mar.
5. Água intersticial
Pacífico Norte
Millero, 2006
•
•
•
•
Ca+ – dissolução do CaCO3
SO4-2 – formação de H2S
Cátions – troca com argilominerais
Mg – formação de dolomita
12
6. Trocas oceano-atm
- injeção de bolhas na atm (10 x 109 ton íons/ano)
Elementos maiores são os principais
componentes da água do mar.
- fracionamento:
- enriquecimento: Ca2+, K+, Mg2+
- empobrecimento: Cl-, Br-
7. Vulcanismo submarino
Quais são os outros componentes importantes
da água do mar?
- Pouco efeito
- Alta F/Cl
• Gases dissolvidos
Gases Dissolvidos – trocas livres água-atmosfera
• Matéria orgânica
O2: distribuição de biota e processos redox
• Material particulado
• Nutrientes
• Elementos traço (metais)
13
Matéria orgânica
- CO2: gás estufa, sistema carbonato, pH
- N2: efeito estufa
- DMS: gás biogênico, núcleo de condensação/albedo
- He e Ar
Matéria Orgânica Dissolvida (DOM)
DOM – fração < 0.45 µm (dissolvido e colóides)
Carbono dissolvido – COD (75-100 µM)
Matéria orgânica coloidal (CDOM) é importante!!!
Nutrientes
Matéria Orgânica Particulada (POM)
POM – fração > 0.45 µm
Carbono Orgânico Particulado (POC)
Material detrítico (~0.03 x 1018 gC)
Biomassa viva é secundária (~0.5-1.0 x 1015 gC).
– Quem são:
nitrito, nitrato, fosfato e silicato
– Processos biológicos;
– Nitrogênio é fixado pelo fitoplâncton;
– Silicato é usado na construção de carapaças.
14
Material Particulado
Material Particulado: composição
Inorgânico:
10-20 ng/L
sedimentar, fragmentos de rochas (aluminosilicatos)
Se move livremente no oceano,
ORIGEM EXTERNA (rios, deposição atm, colóides,
precipitados de Fe e Mn e complexos formados em
estuários)
Composição e concentração variável:
- agregação, desagregação, decomposição,
dissolução e incorporação na biota
Controlador da composição da água do mar:
remoção de nutrientes e metais, transporte vertical
e lateral
‘The great particle conspiracy’: controle de metais
Composição das águas naturais
Se os rios são as principais fontes de sais
dissolvidos, matéria orgânica, material
particulado e nutrientes para a água do mar,
porque a água do mar não é uma versão
concentrada da concentração média dos rios???
Orgânico:
material biológico: POC, açucares, aminoácidos,
proteínas, plânctom, pelotas fecais, conchas e detritos
ORIGEM INTERNA
Composição das águas naturais
• Chuva: gases dissolvidos (CO2 e SO2), pH 5.7
• Variações locais
• Ca2+ e HCO3-: carbonatos e silicatos
4
1
60
Ciclo hidrológico?
Reatividade química?
Intemperismo?
Chuva (TDS = 7.1 mg/L)
Rio (TDS = 118.2 mg/L)
10
15
Chuva
Composição das Águas Naturais
Rio
Mar
Composição das Águas Naturais
• Na+, Mg+2, Ca+2: abundância na crosta terrestre;
• Água do mar tem 300 vezes mais sais
dissolvidos que a média da água doce;
• HCO3-, Ca2+ e SiO2: removidos da água
• Grande parte dos elementos tem origem
continental
Origem do Cloreto
É o vulcanismo
- O Cloreto de Hidrogênio (HCl): gases vulcânicos;
•
Cl-:
pequena concentração na crosta (> 0,01%);
• Cl- presente nas águas fluviais são proveniente
da ciclagem dos sais marinhos via aerossóis
Qual é a origem do Cl- então?
- Vulcanismo ativo antigamente;
- Gases solúveis foram emitidos na degaseificação
do interior da terra e se dissolveram no oceano;
- Excesso de voláteis “Excess Volatile”
H, O, Cl, N, S, B e F
16
Origem dos Elementos
• Titulação a longo prazo:
Rochas ígneas + “excess volatiles”
rochas sedimentares + oceanos + atm
Origem dos Elementos
• Todos os elementos presentes nos oceanos podem
ser explicados pelo intemperismo terrestre?
• Como podemos avaliar isto?
Compara-se a quantidade total de um elemento
adicionado no oceano pela ação do
intemperismo rochoso, com sua quantidade
dissolvida na água do mar.
Origem dos Elementos
• Balanço de massa: O Balanço de Sódio
Origem dos Elementos
• Por ex:
– 11g/L de Na na água do mar
•
Na+:
origem exclusivamente terrestre;
– Conc. Média de Na na crosta é 2,4g em 100g rocha
• Calcula-se a quantidade de rocha continental
que tem que sofrer intemperismo para gerar a
concentração observada em 1L de água do mar
(várias simplificações....);
• 75% é dissolvido no intemperismo → oceano
– ≈ 600g de rocha precisa ser intemperizada
17
Origem dos Elementos
• Menos que 10% de qualquer um dos elementos
encontrados nas rochas precisam ser intemperizados para
explicar suas concentrações no oceano
• Será então que o intemperismo não é importante?
• Rápida remoção dos elementos da água do mar
• Menor a % de elemento dissolvido, mais eficiente foi o
processo de remoção biológica ou inorgânica e, portanto,
menor o tempo de residência na coluna d’água.
Open University, 1999
Existem outras fontes importantes de
materiais para os oceanos?
• Grande variação espaço-temporal
Existem outras fontes importantes de
materiais para os oceanos?
• Intemperismo de baixa temperatura da crosta
oceânica (basalto)
• Transporte atmosférico
– Mais forte em baixas latitudes
• Poeira eólica carregada em pulsos
• Transporte glacial
• Reações de alta temperatura – atividade hidrotermal
– Fonte e sumidouro
– Principal fonte de Mn dissolvido
– 2° fonte + importante em termos de massa de material
– Importância local (90% Antártica –anel de sedimento)
18
Oceano é um ambiente dinâmico
• Ambiente dominado por fluxos
• Comportamento dinâmico dos elementos: remoção
dissolvidos → particulado
Processos que controlam a composição da água
• Existe um contínuo aporte e perda dos componentes da
água do mar
• Processos físico-químicos:
–
–
–
–
–
–
Reações ácido-base
Reações de óxido-redução
Reações de complexação
Adsorção
Processos gás-solução
Processos fotoquímicos
Natureza das reações define a composição da
água via aporte, reatividade interna e remoção
Aproximação “steady-state” ou estado estacionário
Os processos no oceano são cíclicos
Taxa de entrada = Taxa de saída
ao longo do tempo
A composição do oceano se mantém
constante nos últimos 100 milhões de anos
Tempo de Residência
Tempo médio que um constituinte
passa dentro do oceano
Tempo de residência = quantidade de elemento no oceano
taxa de entrada ou saída
Assumindo que os rios são as principais fontes
19
Fluxos Fluviais e Tempo de Residência
Concentração x Tempo de Residência
Open University, 1999
Comportamento dos constituintes
Elementos conservativos
Comportamento conservativos são:
• Alterados apenas por processos físicos
– Salinidade
– Concentração de gás inerte
Comportamento não conservativos:
• Alterados por processos biológicos e
químicos
– Nutrientes
– Matéria orgânica
- perfis verticais uniformes
- razão cte elementos/S
- baixa reatividade
- maioria dos elementos maiores
- evaporação e chuva
Millero, 2006
20
Propriedades Não Conservativa
Nutrientes
Propriedades Não Conservativa do O2
Processo Biológico
CO2 + H2O → fotossíntese → matéria orgânica
inorgânico N ← respiração ← + O2
inorgânico P
Processo Físico
O2 atmosfera → O2 dissolvido
←
Elementos ou compostos necessários
para o fitoplâncton
•
•
•
•
N : nitrato e amônio
P: fosfato
S: silicato
Metais traços: Fe, Zn, Mo, Cu, Co
Elementos tipo nutriente: biologicamente ativos
nmol/kg
Conservativos
Tipo nutriente
Tipo removíveis
µmol/kg
• Remoção na superfície e enriquecimento com a profundidade
• Processos biológicos: ciclo do MP e MO
21
O que é Matéria Orgânica?
Matéria Orgânica nos Oceanos
Compostos de C
Propriedade físicas e químicas diversas
grupos funcionais
Base energética e nutricional da cadeia trófica
Importante para especiação de metais
Precursores de combustíveis fósseis
Controle do clima global
Fonte de MO para os oceanos
Fonte
Produção Primária
Fitoplâncton
Macrófitas
Carga líquida
Rios + Subterrânea
Carga atmosférica
Chuva
Deposição seca
1015 gC/ano % total
23,1
1,7
84,4
6,2
1,08
3,95
1,0
0,5
3,65
1,8
Bomba biológica e PP
• Processos fisicos vs produção primária
• Ausência da bomba biológica:
– Nitrato 33 mmol/m3 Variabilidade ± 10%
– Fosfato 2.1 mmol/m3
como a salinidade!
• As concentrações são <<<< nos oceanos
• Existem regiões com altos teores de nutrientes e
baixa PP
22
Classificação da MO
Classificação da MO
Matéria Orgânica Dissolvida (DOM)
1960-70: Dissolvida x Particulada
Filtros de fibra de vidro ou prata de 0,45µm
Particulada
Coloidal
mm
µm
zoo
Fito
peneiras
colóides
Dissolvida
nm
bactéria Microalgas/detritos
Vírus
filtros
ultra filtros
peneiras moleculares
Classificação da MO
Matéria Orgânica Dissolvida (DOM)
A maior parte do DOM
reside no fundo dos oceanos
resistente a biodegradação
Matéria orgânica coloidal (CDOM):
Alto peso molecular (HMW: >1000)
DOM – membrana de 0.45 µm
97% CO na água do mar ocorre na fração dissolvida
filtração não é recomendada
Bactérias heterotróficas são os principais consumidores
DOM: cadeia alimentar microbiana e fluxo de C e energia
O conteúdo de carbono é descrito como COD, sendo que o
COD na água do mar varia entre 75-100 µM
Matéria Orgânica Dissolvida (DOM)
1. DOC: dois reservatórios
a. Novo, rápida ciclagem do plancton (< 1000 anos)
b. Velho, ciclagem lenta a partir do material fluvial
fotodegradado (5000 anos)
2. C/N (8 a 18)
a. Maiores em águas de fundo
b. Maiores para partícula menores:
4 for 500 µm and 10 for 0.003 µ m
c. Maiores para MO terrestre (C/N > 15)
Colóide sólido amorfo, partículas com grande área
superficial (0.001 a 1 µm)
3. Composição pode ser usada como indicativo de
fonte (Biomarcadores)
23
Classificação da MO
Matéria Orgânica Particulada (POM)
Matéria Orgânica Particulada (POM)
POM em suspensão
mistura de detritos e biomassa viva (10:1)
POM – fração retida na membrana de 0.45 µm
zona fótica: biomassa viva (microalgas)
zona afótica: detritos de conchas, esqueletos de
diatomáceas, pelets fecais, “neve marinha”.....
biomarcadores (clor a, carotenóides, ATP, DNA –
biomassa viva)
Fito
Estrutura da comunidade: ciclagem e exportação de MO
mistura complexa de matéria viva e detritos:
variação de tamanho, forma e reatividade
Estrutura básica: diversos grupos (e.g. algas verdes,
diatomáceas)
Diatomáceas de blooms (sazonal e espacial)
Volkman e Tanoue, 2002
Volkman e Tanoue, 2002
POM em suspensão
POM em suspensão
Vírus
Numericamente dominante
Bactérias
Bactérias heterotróficas: prod. secundária → ciclagem C
90% total do carbono biológico
Fração pouco significante na contribuição de MO
Alça microbiana:
DOM (fito) → POM (bactérias) → DOM (protistas e vírus)
dominantes em águas oligotróficas
3-26% COP da PP é reciclado por lise viral para COD
Bactérias aeróbicas: luz solar → energia
infecção viral: declínio de blooms
até 20% total das bactérias (oligotróficos)
não foi provado se elas fixam Cinor → ciclagem global do C
Pastagem por protistas: minimiza
limitação por Fe
Fe biodisponivel é gerado de Fe coloidal nos vacúolos dos protistas
Volkman e Tanoue, 2002
Volkman e Tanoue, 2002
24
POM em suspensão
Neve Marinha
Grandes agregados de matéria orgânica
Mucilagem, cianobactérias, espécies autótrofas, detrítos
Fontes de Matéria Orgânica
Frágeis, degradados até os 1000m
C:N aumentam com o volume (maior agregados/mais velho)
Alóctona e autôctona
Mar Adriático
Kaiser et al, 2005
Fontes de Matéria Orgânica
Aportes fluviais de MO
estuário
Alóctonas: fonte externa
Rios e estuários
Solos (subs. húmicas (70%)
e material refratário)
– Variando de poucos m3/s – 200.000 m3/s (Amazonas)
400
350
River
• Aportes são dependentes:
300
DOC (µ
µ M)
Plantas (50%: carboidratos,
lipídios e material lábil de
LMW –ac.fúlvicos)
• Descarga de água total: 35 x 103 km3/ano
450
250
200
Seawater
150
100
–
–
–
–
Tamanho da bacia de drenagem
Geologia
Regime fluvial
Natureza e uso do solo
Qde/qualidade MO
50
0
5
10
15
20
25
30
35
Salinity
Millero, 2002
25
Zona
COD Descarga de água
mg/L
Exportção do
DOC
Km3/ano
% total
106 t/ano
% total
Tundra
2
1,222
3
2.2
1
Taiga
7
4,376
11.7
30.6
13
Temperado
4
10,285
27.5
41.1
17.6
Tropical
úmido
8
19,186
51.3
153.5
65.6
Tropical seco
3
2,169
5.8
6.5
2.8
Semi-árido
1
Total
262
0.7
0.3
0.1
37,400
100
243.2
100
A taxa de aporte fluvial é baixa
comparada a produção anual dos
oceanos (50Gt C/ano)
• Razões isotópicas
• C:N >15 ambiente terrestre
• C:N ~ 7 ambiente marinho
Leenheer, 1991
Porque a MO nas bacias oceânicas não tem origem terrestre?
• Floculação e precipitação da MO
– Resultados variam:
• Sazonalidade;
• Floculação/agregação (tamanho importa!);
• Físico-química vs. turbulência e tempo de residência
• Fotoxidação
• MO origem antrópica
– zona costeira (salting out)
Fontes de Matéria Orgânica
Atmosfera
Importante na microcamada superficial (0-100 µm)!
- 10x mais DOC que a camada inferior
- Composição pouco conhecida (subst. húmicas, mono e
polissacarídeos, DDT, PCBs, etc.)
- deposição seca e úmida: 2,2 1014 gC/ano
(semelhante a carga fluvial 4,0 1014 gC/ano)
- bolhas: gde parte da deposição atm é reciclada
26
Fontes de Matéria Orgânica
Autóctonas: FONTE INTERNA
Fontes de Matéria Orgânica
Autóctonas:
COP: vivo (menos de 5% do TOC no oceano)
Organismos autotróficos: transformadores
Reduzem o CO2 para C orgânico e estocam a energia química
nos seus tecidos.
Ex: plantas (plâncton e macroalgas) e algumas bactérias.
fitoplancton – fotossíntese – 2 x 1016g C/ano
Organismos microscópios de pequena mobilidade
Diatomáceas: grupo dominante
Cianobactérias, cocolitoforideos,...
Fotossíntese ou produção primária é o processo
global mais importante:
6 CO2 + 6 H2O + nutrientes => C6H12O6 + 6 O2
Composição do Fito
•
•
•
•
40% proteínas
40% carboidratos
15% lipídeos
5% ácidos nucléicos
Variações:
- aporte de nutrientes
- idade
- T°C
- radiação
Composição do Fito
• Simplificação da fotossíntese: C, N e P
106CO2 + 16NO3- + 1HPO42- + 12H2O +
18H+ → C106H263O110N16P + 138O2
C:N:P: 106:16:1
Razão de Redfield
27
Fontes de Matéria Orgânica
Fontes de Matéria Orgânica
Razão de Redfield:
Autóctonas: FONTE INTERNA
razão estequiométrica para o fito/zoo é
constante! (gde escala temporal)
POC: não vivo
Detritos
Organismos mortos
Material fecal
Matéria orgânica
C
H
Oxigênio
O
N
P
Muito altas
Agregados orgânicos
O2
Redfield et al. 1963
106
263
110
16
1
138
Anderson 1995
106
164-186
26-59
16
1
141-161
Hedges 2002
106
177
37
17
0,4
154
•
•
•
•
Aumenta o consumo
Fontes de Matéria Orgânica
COD (principal estoque de CO nos oceanos)
Controvérsia: COD autóctono vs. alóctono
Estima-se que entre 10-50% do COD seja de
origem terrestre
Aglomerados de bactérias/detrítos
Agregação de MO por ação de bolhas
Floculação
Adsorção de COD em partículas
Composição da Matéria Orgânica
Proteínas (amino ácidos) Auto e Alo
Carboidratos Auto e Alo
Lipídios Auto e Alo
COMPORTAMENTO CONSERVATIVO
Pigmentos Auto e Alo
LIGNINA
Lignina Alo
Bauer et al., (2002)
fito
Ácidos Nucléicos Auto e Alo
Dafner & Wangersky (2002) revisão!
28
Composição da Matéria Orgânica
Composição da Matéria Orgânica
POM:
Hidrocarbonetos, ácidos graxos, carboidratos, lignina, detrítos
Terrestre ou Marinha:
N-alcanos (biomarcadores)
C23-C35: terrestre
C15-C21: marinho
POM:
Pequena parcela: biomassa viva
Grande parcela: biomassa morta
Partículas pequenas: maior parte do POM
Partículas grandes: neve marinha/pelets fecais (cadeia
alimentar)
Acidos graxos (biomarcadores)
C14-C36: terrestre
C12-C24: marinho
Composição da Matéria Orgânica
DOM (coluna d’água):
COD: 95% do TOC no oceano
10-20% caracterizada
Fração lábil DOM: lipídios, carboidratos,
aminoácidos, pigmentos
Organismos vivos POC→ DOC:
Exudação do fito
Excreção do zoo
Mineralização da MO
Composição da Matéria Orgânica
DOM (coluna d’água):
Fração não caracterizada: material inerte,
altamente refratário
GELBSTOOF: macromoléculas do tipo
material húmico e lignina
Micro-camada superficial: sopa orgânica
SCUMS
Variedade de substâncias: POC, DOC, P,
N, bactérias, DDT, PCB e metais
29
Referências
Livros textos
S. Libes (1992) An Introduction to Marine Biogeochemistry
R. Chester (2000) Marine Geochemistry
D.A. Hansel & C.A. Carlson (2002) Biogeochemistry of marine
dissolved organic matter
F. Millero (2005) Chemical Oceanography. 3nd Edition. CRC,
USA, 469p.
Para ir mais longe
Volkman, J. & Tanoue, E. (2002) Journal of Oceanography V. 58,
265-279p.
Sarmiento & Gruber (2006) Ocean Biochemical Dynamics,
Princeton, 507p.
Baldock, et al. (2004) Marine Chemistrty V. 92, 39p.
Giorgio & Duarte (2002) Nature V. 420, 379p.
Hopkinson & Vallino (2005) Nature V. 433, 142p.
30