Criar conta
Artigo Discussão
Ler Editar
Entrar
Pesquisa
Água do mar
Origem: Wikipédia, a enciclopédia livre.
Este artigo ou se(c)ção cita fontes fiáveis e independentes, mas elas não cobrem todo o
texto (desde junho de 2011).
Página principal
Conteúdo destacado
Eventos atuais
Esplanada
Página aleatória
Portais
Informar um erro
Colaboração
Boas-vindas
Ajuda
Página de testes
Portal comunitário
Mudanças recentes
Manutenção
Criar página
Páginas novas
Contato
Donativos
Imprimir/exportar
Ferramentas
Noutras línguas
اﻟﻌرﺑﯾﺔ
Azərbaycanca
Català
ﮐوردی
Česky
Deutsch
English
Esperanto
Español
Eesti
Euskara
ﻓﺎرﺳﯽ
Suomi
Français
Galego
עברית
Magyar
Bahasa Indonesia
Italiano
日本語
ქართული
Қазақша
한국어
Latina
മലയാളം
Nederlands
Norsk bokmål
Polski
Runa Simi
Русский
Srpskohrvatski /
српскохрватски
Српски / srpski
ไทย
Türkçe
Українська
Oʻzbekcha
Tiếng Việt
中文
Bân-lâm-gú
Por favor, melhore este artigo providenciando mais fontes fiáveis e independentes, inserindo-as em notas de rodap
é ou no corpo do texto, nos locais indicados.
Encontre fontes: Google — notícias, livros, acadêmico — Scirus — Bing. Veja como referenciar e citar as fontes.
As referências deste artigo necessitam de formatação (desde junho de 2011).
Por favor, utilize fontes apropriadas contendo referência ao título, autor, data e fonte de
publicação do trabalho para que o artigo permaneça verificável no futuro.
Água do mar é a água encontrada em mares e oceanos. A água do mar de todo o mundo tem uma salinidade próxima de 35 (3,5% em
massa, se considermos apenas os sais dissolvido, mas a salinidade não tem unidades),1 o que significa que, para cada litro de água do
mar há 35 gramas de sais dissolvidos, a maior parte é cloreto de sódio (cuja fórmula é NaCl).
A água do mar não tem salinidade uniforme ao redor do globo. A água menos salina do planeta é a do Golfo da Finlândia, no Mar
Báltico. O mar mais salino é o Mar Morto, no Médio Oriente, onde o calor aumenta a taxa de evaporação na superfície e há pouca
descarga fluvial.
Índice [esconder]
1 Aorigem da salinidade do oceano
1.1 Condutividade elétrica
2 Composição química
2.1 Principais íons salinos da água do mar
2.2 Gases dissolvidos na água do mar
2.3 Ciclo do carbono
3 Aspectos culturais
4 Ver também
5 Referências
A origem da salinidade do oceano
[editar]
As teorias científicas para explicar as origens do sal marinho começaram com Edmond Halley, em 1715, que propôs que os sais e
outros minerais foram transportados para o mar pelos rios, tendo sido sugado da terra por queda da chuva, lavando as rochas. Ao
alcançar os oceanos estes sais seriam retidos e concentrados pelo processo de evaporação (veja Ciclo hidrológico) que removem a
água.2 Halley notou que do pequeno número de lagos no mundo que não têm saídas para o oceano (como o Mar Morto e o Mar Cáspio),
a maioria tem alto teor de sais. Halley denominou este processo de "intemperismo continental".
A teoria de Halley estava correta em parte. Ou seja, o sódio foi sugado do fundo do oceano quando os oceanos se formaram. A
presença dos outros elementos dominantes como cloreto, resultaram do escape de gases do interior da terra (na forma de ácido
clorídrico), por vulcões e fontes hidrotermais. O sódio e o cloreto então se combinaram para formar o constituinte mais abundante da
água do mar, o cloreto de sódio.
A salinidade do oceano tem-se mantido estável por milhões de anos, provavelmente como uma consequência de um sistema
tectônico/químico que recicla o sal. Desde o surgimento do oceano, o sódio não é mais libertado pelo fundo do oceano, mas é
capturado de camadas sedimentares que cobrem o leito do oceano. Uma teoria diz que a tectônica de placas faz com que o sal seja
forçado para baixo das massas continentais, onde é lentamente trazido de volta à superfície. Outra fonte importante é o que chamamos
de Água Juvenil, este material é proveniente do interior da Terra e sai por meio de fenômenos como o vulcanismo. Esta água nunca
esteve na superfície da Terra, por isso leva o nome de água juvenil.
Condutividade elétrica [editar]
A água do mar apresenta uma elevada condutividade elétrica. Os sais na água se dissociam em íons. A condutividade varia sobre todo
com a temperatura e a salinidade (a maior salinidade, maior condutividade), e sua medição permite, uma vez controlada a temperatura,
conhecer a salinidade.3
Composição química
[editar]
A ciência que estuda a composição química dos oceanos e as concentrações dos compostos na água do mar se chama oceanografia
química. A água do mar tem composição química quase constante. Há um pouco mais de 70 elementos dissolvidos na água do mar,
mas apenas seis desses constituem mais de 90% dos sais dissolvidos; todos ocorrem como íons.
Os cientistas estudam principalmente os macronutrientes na água do mar (nitrogênio, fósforo e enxofre), já que são os mais importantes
para a vida marinha, principalmente para as plantas, que são a base da produção primária. Mas os micronutrientes também são
largamente estudados, uma vez que, devido às suas baixas concentrações, podem tornar-se limitantes para vários tipos de organismos
marinhos.
Principais íons salinos da água do mar [editar]
Cloreto (Cl-): 55,04 %m (%m significa porcentagem em massa)
+
converted by Web2PDFConvert.com
Bân-lâm-gú
粵語
Editar links
Sódio (Na+): 30,61 %m
Sulfato (SO42-): 7,68 %m
Magnésio (Mg2+): 3,69 %m
Cálcio (Ca2+): 1,16 %m
Potássio (K+): 1,10 %m
Gases dissolvidos na água do mar [editar]
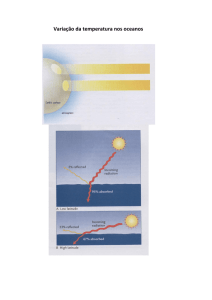
A água do mar também contém pequenas quantidades de gases dissolvidos, principalmente nitrogênio, oxigênio e dióxido de carbono. A
água a uma dada temperatura e salinidade está saturada com gás quando a quantidade de gás que se dissolve na água é igual à
quantidade que sai ao mesmo tempo. A água do mar superficial está geralmente saturada com gases atmosféricos, como oxigênio e
nitrogênio. A quantidade de gás que pode-se dissolver na água do mar é determinada pela temperatura e salinidade da água.
Aumentando-se a temperatura ou a salinidade reduz-se a quantidade de gás que pode ser dissolvido.
Uma vez que a água afunda para baixo da superfície oceânica (por exemplo, por se tornar mais densa pela evaporação), os gases
dissolvidos não podem mais ser trocados com a atmosfera. A quantidade de gás num dado volume de água permanecerá inalterado,
exceto pelo movimento das moléculas de gás através da água, por difusão (processo lento), ou pela mistura da água com outras
massas de água que contêm diferentes teores de gases dissolvidos.
Em geral, o nitrogênio e gases raros inertes (argônio, hélio e outros) comportam-se dessa maneira: suas concentrações são
conservativas e somente afetadas por processos físicos. Em contraste, alguns gases dissolvidos são não-conservativos e participam
ativamente em processos químicos e biológicos que modificam suas concentrações. Exemplos são o oxigênio e o dióxido de carbono
que podem ser liberados e usados a variadas taxas nos oceanos, especialmente pelos organismos.
Ciclo do carbono [editar]
Ver artigo principal: Ciclo do carbono
Os oceanos (pela sua dimensão, mas também as massas de água continentais) têm um papel muito importante no equilíbrio do dióxido
de carbono na atmosfera terrestre. Este gás têm a propriedade de reagir com os íons presentes na água para formar íons bicarbonato.
Dessa maneira, quando há excesso de dióxido de carbono na atmosfera, ele é "absorvido" pela água que se torna um reservatório de
carbono. Quando a biomassa vegetal na água aumenta (por exemplo, por aumento da temperatura ou dos nutrientes), aumenta também
a necessidade de dióxido de carbono para essas plantas realizarem a fotossíntese - nessa altura, o bicarbonato pode "transformar-se"
de novo em dióxido de carbono para repôr o equilíbrio.
Aspectos culturais
[editar]
Mesmo num navio ou ilha no meio do oceano pode haver falta de água, isto é, água doce. É um paradoxo, já que uma pessoa cercada
de água pode morrer de sede. É que por ser salgada a água do mar não é potável. Muitas nações na África e no Oriente Médio com
problemas hídricos aplicam hoje um processo caro, chamado dessalinização, para obterem água potável a partir da água do mar. No
futuro este processo pode-se tornar muito utilizado, dada a presente poluição intensa dos corpos d'água continentais.
Ver também
[editar]
Energia azul
Oceano
Sal
Referências
1. ↑ UFSC Água do mar (PDF).
2. ↑ E. Halley, A short account of the cause of the saltiness of the ocean, and of the several lakes that emit no rivers; with a proposal, by help
thereof, to discover the age of the world, Philosophical Transactions of the Royal Society of London, 29:296—300, 1715.
3. ↑ Título não preenchido, favor adicionar .
Avaliar esta página
Ver avaliações
O que é isto?
Credibilidade
Imparcialidade
Profundidade
Redação
Conheço este assunto muito profundamente (opcional)
Categorias: Soluções aquosas Oceanografia Hidrografia
Esta página foi modificada pela última vez à(s) 20h45min de 30 de maio de 2013.
Este texto é disponibilizado nos termos da licença Atribuição-Partilha nos Mesmos Termos 3.0 não Adaptada (CC BY-SA 3.0) ; pode estar sujeito a condições
adicionais. Consulte as condições de uso para mais detalhes.
Política de privacidade Sobre a Wikipédia Avisos gerais Versão móvel
converted by Web2PDFConvert.com