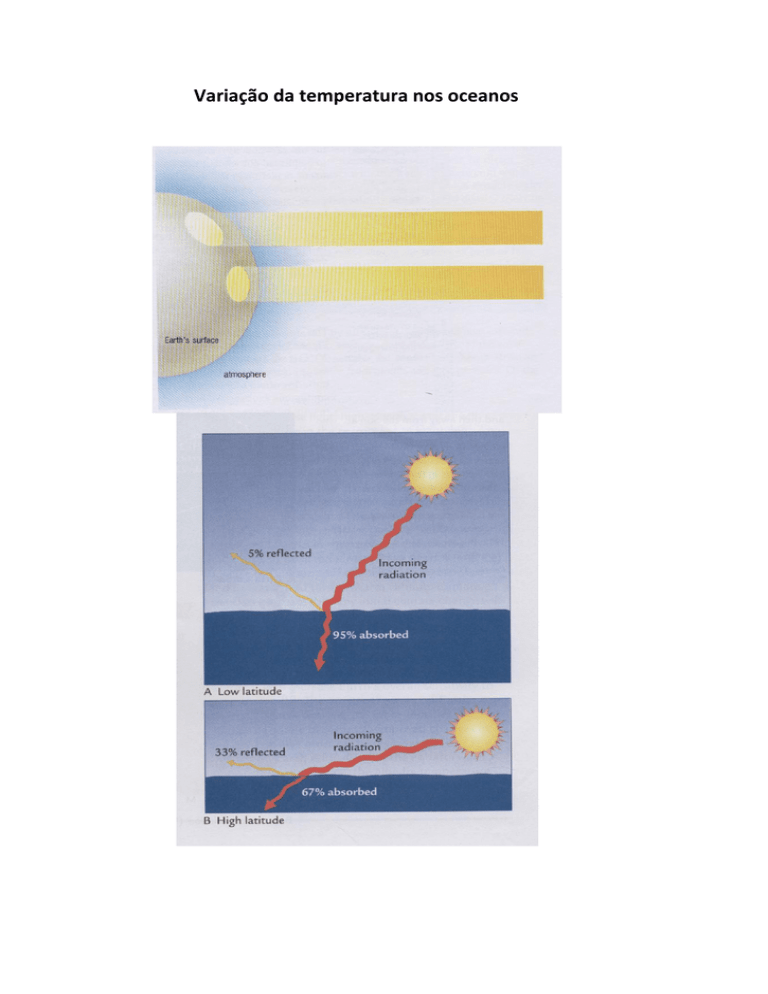
Variação da temperatura nos oceanos
Gases dissolvidos na água do mar
A presença de gases dissolvidos na água do mar é de extrema importância para os organismos
marinhos. Por exemplo, muitos organismos vivem nos oceanos em uma quantidade diminuta de
oxigênio necessária para suprir sua necessidade de oxigênio. Muitos gases na atmosfera são dissolvidos
na água do mar, porém, a quantidade de gases na água do mar depende de vários fatores.
Troca de gás entre a atmosfera e o oceano:
Na superfície do oceano, onde a água do mar fica em contato com a atmosfera, uma pequena
quantidade de gases da atmosfera dissolve-se na água do mar. A ação das ondas aumenta o contato arágua. Ventos fortes aumentam as ondas em tamanho, aumentando a mistura do gás atmosférico com a
água.
A quantidade total de um gás que pode ser dissolvido depende da concentração do gás na atmosfera e
da sua solubilidade. Solubilidade de um gás é a quantidade da substância que pode ser dissolvida em
uma dada pressão e temperatura. A solubilidade de um gás aumenta com o aumento da pressão, e
aumenta com a diminuição da temperatura.
Oxigênio: A concentração do oxigênio na superfície é alta devido principalmente a ação fotossintética
do fitoplâncton, tendo o oxigênio como subproduto. Adicional oxigênio é suprido através da troca com a
atmosfera. A concentração de oxigênio diminui rapidamente com a profundidade nos oceanos devido:
1) A ação fotossintética limita-se apenas nas camadas superiores onde existe penetração de luz; 2) Nas
camadas mais profundas, o oxigênio é usado pelos animais no processo da respiração. Curiosamente,
abaixo da termoclina (1000 metros) a concentração de oxigênio volta a aumentar, devido ao fato das
águas profundas serem originadas na superfície das regiões polares, onde as águas frias são muito
oxigenadas (água fria conserva mais gás dissolvido).
Dióxido de carbono: Embora esse gás esteja em pequena concentração na atmosfera, é o mais
abundante na água do mar, devido a sua alta solubilidade. Porém, CO2 é rapidamente consumido pelas
microalgas durante a fotossíntese. Mesmo assim, existe 60 vezes mais CO2 nos oceanos do que na
atmosfera. Na superfície, a concentração do CO2 encontra-se em equilíbrio com a atmosfera. Essa
concentração aumenta com a profundidade, devido a diminuição do consumo para a fotossíntese e
aumento da produção pela respiração. Abaixo dos 1000m, a concentração desse gás diminui
novamente, pela mesma razão que aumenta o oxigênio.
Acidez e alcalinidade da água do mar:
Íons H+ ácido
Íons OH- básico
H20 OH- + H+ H20, rapidamente dissocia-se e recombina-se novamente.
Quando outras substâncias dissociam-se na água, esta água pode tornar-se ácida ou básica. Por
exemplo, o HCl pode tornar a água mais ácida, e o NaHCO3 pode alcalinizar a água.
O sistema tampão: Quando o CO2 combina-se com a água do mar, forma-se um ácido chamado de
ácido carbônico (H2CO3), o qual se dissocia liberando íons H+, da seguinte forma:
H20 + CO2 H2CO3 H+ + HCO3- (íon bicarbonato)
Por essa reação, a água do mar deveria ser ácida, más não é isso que ocorre, sendo a mesma levemente
alcalina.
Densidade da água do mar
A densidade é um fenômeno muito importante nos oceanos, pois determinam estratificações verticais
nos oceanos. Massas de água com maior densidade fluem por baixo das de menor densidade, podendo
produzir correntes de água muito fortes.
A densidade da água pura é 1.000 g/cm3, servindo de padrão para todas as outras substâncias. A água
do mar contém várias substâncias dissolvidas que aumentam a densidade. No mar aberto a densidade
varia de 1.022 a 1.030g/cm3, dependendo da salinidade. Assim, a densidade da água do mar é cerca de
2 a 3% maior que da água pura. Ao contrário da água pura, a água do mar continua a aumentar sua
densidade até congelar-se a -1,9°C, quando a densidade diminui bastante; o iceberg flutua.
O símbolo para a densidade é a letra grega ρ(rho). A densidade da água do mar depende da
temperatura T, da salinidade S e da pressão p. Essa dependência é conhecida como a Equação de Estado
da Água do Mar.
ρ = ρ (T,S,p)
Temperatura, salinidade e pressão influenciam a densidade da água do mar da seguinte forma:
- Quando a temperatura aumenta, a densidade diminui expansão térmica
- Quando a salinidade aumenta a densidade aumenta Adição de mais material dissolvido
- Quando a pressão aumenta a densidade aumenta Efeito compressivo da pressão
A temperatura e a salinidade influenciam principalmente a densidade na superfície, enquanto a pressão
apenas no mar profundo. Devido ao pequeno efeito compressivo da água, o efeito da pressão é muito
pequeno e pode ser ignorado.
Devido a variação da temperatura superficial dos oceanos ser maior do que a variação da salinidade, a
temperatura exerce uma maior influência na densidade da água do mar. A salinidade só tem maior
importância na densidade da água do mar nas regiões polares, onde a constante baixa temperatura
durante quase todo o ano mantém a densidade uniforme. Com o degelo durante o curto verão, ocorre
uma diminuição da salinidade superficial e consequentemente estratificação das camadas de água.
Os oceanógrafos comumente usam o símbolo σt (a letra grega sigma com um subscrito t) para
densidade, para o qual eles pronunciam "sigma-t". Essa quantidade é definida como σt = ρ - 1.000 e não
possui unidades geralmente (ele deveria ter as mesmas unidades que ρ). Uma densidade típica da água
do mar é portanto σt = 25.
A figura mostra que a variação da temperatura em águas quentes, de baixas latitudes, afeta muito mais
a densidade, do que a variação da temperatura em águas frias, de altas latitudes.












