Modelos atômicos
Dalton – Thomson – Rutherford
Professor: Hugo Cesário
Tales de Mileto
Do que tudo é feito ?
Thomson
Aristóteles
Dalton
Rutherford
Átomo/Filosofia
Filosofia
Tales de Mileto (600 a.C.)
Do que tudo é feito ?
Empédocles (450 a.C.)
Quatro “raízes”
água
Raízes unidas pelo amor e
separadas pela discórdia
Leucipo (500 – 430 a.C.)
- Surge a ideia de átomo.
A-tomo ( o que não pode se
dividido)
-Demócrito era discípulo de
Leucipo (460 – 370 a.C.).
*Disseminação da teoria.
*Átomos com diferentes
tamanhos e formas.
*Teoria contestada e
menosprezada
Átomo/Filosofia
Filosofia
Platão
*Resgate da ideia das quatro “Raizes”.
*Pensamento que dominou o mundo ocidental até o início
de século XVII
Aristóteles
Modelo atômico de Dalton
1803 -1808
Esférico – Maciço – Indivisível
– Indestrutível - Base teórica , leis ponderais.
Dalton – Foi Professor de química e
matemática na Universidade de Manchester.
* Renascimento do atomismo.
Daltonismo, em sua homenagem.
1803 -1808 - Modelo atômico de Dalton
Postulados
-A matéria é formada por átomos indivisíveis e indestrutíveis.
(Essas ideias não mais fazem parte do modelo atômico atual)
-Todos os átomos de um determinado elemento são idênticos quanto às suas massas e às
suas propriedades químicas.
(Isótopos) –idênticos em número atômico e propriedades químicas.
-Átomos de elementos diferentes possuem massas e propriedades diferentes.
(Isóbaros)
-Átomos de elementos diferentes combinam em uma proporção fixa para originar
determinado composto químico.
(Ainda aceito) Lei de Proust
-Durante as reações químicas, átomos não são criados nem destruídos, mas apenas
rearranjados, formando novas substâncias.
(Ainda aceito) reações não mudam a identidade química dos átomos.
-Átomos de certo elemento químico não podem se converter em átomos de outro
elemento.
(Dalton não conhecia reações nucleares)
Modelo atômico de Thomson
1897
“Pudim de passas”
Divisível – natureza elétrica da
matéria – Tubos de raios catódicos
Joseph John Thomson – Foi Professor na
Universidade de Cambridge. Sete de seus
alunos e assistentes receberam o Prêmio
Nobel.
*Descoberta do elétron (Prêmio Nobel 1906)
*Razão carga-massa 1,2 10^8 C/g (Thomson),
atualmente 1,76.10^8 C/g.
Alessandro Volta 1800
(Criador da Pilha elétrica)
Michael Faraday 1832
(Leis sobre eletrólise)
1897 - Modelo atômico de Thomson
Ampola de William Crookes
1909 – Determinação da carga do Elétron
Robert A. Millikan
*Gotas com cargas
negativas e as cargas
eram múltiplos de
1,6.10^-19C
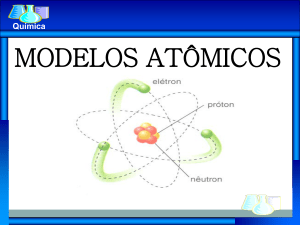
Modelo atômico de Rutherford
1911
Radioatividade – núcleo atômico – modelo planetário
Ernest Rutherford
*Prêmio Nobel de química em 1908
(desintegração dos elementos).
1911 - Modelo atômico de Rutherford
- Possui um centro de diâmetro muito
pequeno.
- Esse núcleo é positivo e maciço.
- Os elétrons estão na eletrosfera ( maior
parte do átomo e constituída principalmente
de espaços vazios)
- Elétrons estão orbitando em torno do
núcleo.
1919 – Descoberta do próton --------------------------------------- 1932 – Descoberta de Nêutron
Rutherford
• Raios canais (Eugen Goldstein)
do hidrogênio (Rutherford).
• Comprovação da partícula
positiva em uma transmutação.
James Chadwick
(Prêmio Nobel em 1935)
Números químicos
Semelhanças Atômicas
Semelhanças Atômicas
Obs: