Vestibulando Web Page – www.vestibulandoweb.com.br
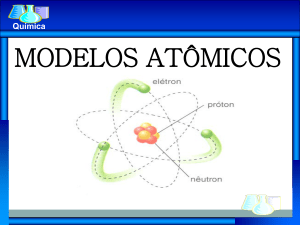
- MODELOS ATÔMICOS -
1. A experiência de Rutherford, que foi, na verdade,
realizada por dois de seus orientados, Hans Geiger e
Ernest Marsden, serviu para refutar especialmente o
modelo atômico
a) de Bohr.
b) de Thomson.
c) planetário.
d) quântico.
e) de Dalton.
As afirmativas corretas são aquelas contidas apenas em
a) I, II e III.
b) II, III e IV.
c) I e II.
d) II e IV.
e) IV.
3. (G1 - cftmg 2005) Referindo-se à evolução dos
modelos atômicos, é INCORRETO afirmar que
a) a energia de um elétron é quantizada, isto é, restrita a
determinados valores, segundo Bohr.
b) as partículas alfa de carga positiva, sofrem desvios,
porque são repelidas pelos elétrons, de acordo com
Rutherford.
c) a formação dos materiais ocorre através de diferentes
associações entre átomos iguais ou diferentes, conforme
Dalton.
d) a descontinuidade dos espectros de absorção ou
emissão de energia pelo átomo de hidrogênio evidencia
a existência de níveis de energia.
w
w
w.
v
es
t
ib
ul
an
do
w
2. (Fgv 2008) As figuras representam alguns
experimentos de raios catódicos realizados no início do
século passado, no estudo da estrutura atômica.
I. Na figura (b), fica evidenciado que os raios catódicos
se movimentam numa trajetória linear.
II. Na figura (c), verifica-se que os raios catódicos
apresentam carga elétrica negativa.
III. Os raios catódicos são constituídos por partículas
alfa.
IV. Esses experimentos são aqueles desenvolvidos por
Rutherford para propor a sua teoria atômica, conhecida
como modelo de Rutherford.
eb
.c
om
.b
r
TEXTO PARA A PRÓXIMA QUESTÃO
(Ufrs 2005) - Algumas cadeias carbônicas nas questões
de química orgânica foram desenhadas na sua forma
simplificada apenas pelas ligações entre seus carbonos.
Alguns átomos ficam, assim, subentendidos.
- Constantes físicas: 1 bar = 10¦ N.m­£
1 faraday = 96500 coulombs
R = 8,314 J.mol­¢ K­¢
O tubo nas figuras (a) e (b) contém um gás submetido à
alta tensão. Figura (a): antes de ser evacuado. Figura
(b): a baixas pressões. Quando se reduz a pressão, há
surgimento de uma incandescência, cuja cor depende do
gás no tubo. A figura (c) apresenta a deflexão dos raios
catódicos em um campo elétrico.
Em relação aos experimentos e às teorias atômicas,
analise as seguintes afirmações:
4. (G1 - cftmg 2006) O modelo de Rutherford, proposto
em 1911, contribuiu para o conhecimento do modelo
atômico atual. Considerando as propostas de
Rutherford, é INCORRETO afirmar que
a) o átomo é constituído de núcleo e eletrosfera.
b) a carga negativa do átomo está confinada no núcleo.
c) o núcleo contém quase a totalidade da massa do
átomo.
d) os elétrons se situam na eletrosfera em região de
baixa densidade.
5. (G1 - cftmg 2007) Em fogos de artifício, observam-se
as colorações, quando se adicionam sais de diferentes
metais às misturas explosivas. As cores produzidas
resultam de transições eletrônicas. Ao mudar de
camada, em torno do núcleo atômico, os elétrons
emitem energia nos comprimentos de ondas que
caracterizam as diversas cores. Esse fenômeno pode ser
explicado pelo modelo atômico proposto por
Vestibulando Web Page – www.vestibulandoweb.com.br
6. (G1 - cftmg 2008) A periodicidade da energia de
ionização pode ser explicada pelo modelo atômico de
a) Bohr.
b) Dalton.
c) Thomson.
d) Rutherford.
7. (Pucmg 2006) O modelo atômico de Rutherford NÃO
inclui especificamente:
a) nêutrons.
b) núcleo.
c) próton.
d) elétron.
A partir das informações do texto, pode-se concluir que
o melhor modelo atômico que representa o
funcionamento dos interruptores no escuro é o de:
a) Rutherford
b) Bohr
c) Thomson
d) Heisenberg
11. (Pucrs 2002) O átomo, na visão de Thomson, é
constituído de
a) níveis e subníveis de energia.
b) cargas positivas e negativas.
c) núcleo e eletrosfera.
d) grandes espaços vazios.
e) orbitais.
ib
ul
an
do
w
8. (Pucmg 2007) Assinale a afirmativa que descreve
ADEQUADAMENTE a teoria atômica de Dalton.
Toda matéria é constituída de átomos:
a) os quais são formados por partículas positivas e
negativas.
b) os quais são formados por um núcleo positivo e por
elétrons que gravitam livremente em torno desse núcleo.
c) os quais são formados por um núcleo positivo e por
elétrons que gravitam em diferentes camadas
eletrônicas.
d) e todos os átomos de um mesmo elemento são
idênticos.
de zinco é um composto fosforescente. Ao absorverem
partículas luminosas, os elétrons são estimulados e
afastados para longe do núcleo. Quando você desliga o
interruptor, o estímulo acaba e os elétrons retornam, aos
poucos, para seus lugares de origem, liberando o seu
excesso de energia na forma de fótons. Daí a
luminescência.
(Texto adaptado do artigo de aplicações da
fluorescência e fosforescência, de Daniela Freitas)
eb
.c
om
.b
r
a) Niels Bohr.
b) Jonh Dalton.
c) J.J. Thomson.
d) Ernest Rutherford.
w
w
w.
v
es
t
9. (Pucmg 2007) Observe atentamente a representação a
seguir sobre um experimento clássico realizado por
Rutherford.
Rutherford concluiu que:
a) o núcleo de um átomo é positivamente carregado.
b) os átomos de ouro são muito volumosos.
c) os elétrons em um átomo estão dentro do núcleo.
d) a maior parte do volume total um átomo é constituído
de um espaço vazio.
10. (Pucmg 2007) Os interruptores brilham no escuro
graças a uma substância chamada sulfeto de zinco
(ZnS), que tem a propriedade de emitir um brilho
amarelo esverdeado depois de exposta à luz. O sulfeto
12. (Pucrs 2007) Um experimento conduzido pela
equipe de Rutherford consistiu no bombardeamento de
finas lâminas de ouro, para estudo de desvios de
partículas alfa. Rutherford pôde observar que a maioria
das partículas alfa atravessava a fina lâmina de ouro,
uma pequena parcela era desviada de sua trajetória e
uma outra pequena parcela era refletida. Rutherford
então idealizou um outro modelo atômico, que
explicava os resultados obtidos no experimento.
Em relação ao modelo de Rutherford, afirma-se que
I. o átomo é constituído por duas regiões distintas: o
núcleo e a eletrosfera.
II. o núcleo atômico é extremamente pequeno em
relação ao tamanho do átomo.
III. os elétrons estão situados na superfície de uma
esfera de carga positiva.
IV. os elétrons movimentam-se ao redor do núcleo em
trajetórias circulares, denominados níveis, com valores
determinados de energia.
As afirmativas corretas são, apenas,
a) I e II
b) I e III
c) II e IV
d) III e IV
e) I, II e III
Vestibulando Web Page – www.vestibulandoweb.com.br
- a grande maioria das partículas ‘ atravessava a lâmina
de ouro sem sofrer desvios ou sofrendo desvios muito
pequenos;
- uma em cada dez mil partículas ‘ era desviada para
um ângulo maior do que 90°.
Com base nas observações acima, Rutherford pôde
chegar à seguinte conclusão quanto à estrutura do
átomo:
a) o átomo é maciço e eletricamente neutro
b) a carga elétrica do elétron é negativa e puntiforme
c) o ouro é radioativo e um bom condutor de corrente
elétrica
d) o núcleo do átomo é pequeno e contém a maior parte
da massa
a) Os átomos de um mesmo elemento são todos
idênticos.
b) Uma substância elementar pode ser subdividida até se
conseguirem partículas indivisíveis chamadas átomos.
c) Dois ou mais átomos podem-se combinar de
diferentes maneiras para formar mais de um tipo de
composto.
d) É impossível criar ou destruir um átomo de um
elemento químico.
GABARITO
1. [B]
6. [A]
11. [B]
7. [A]
12. [A]
8. [D]
13. [D]
4. [B]
9. [A]
14. [E]
5. [A]
10. [B]
15. [C]
2. [C]
3. [B]
w
w
w.
v
es
t
ib
ul
an
do
w
14. (Ufpr 2006) O modelo atômico de Bohr, apesar de
ter sido considerado obsoleto em poucos anos, trouxe
como principal contribuição o reconhecimento de que
os elétrons ocupam diferentes níveis de energia nos
átomos. O reconhecimento da existência de diferentes
níveis na eletrosfera permitiu explicar, entre outros
fenômenos, a periodicidade química. Modernamente,
reconhece-se que cada nível, por sua vez, pode ser
subdividido em diferentes subníveis. Levando em
consideração o exposto, assinale a alternativa correta.
a) Os três níveis de mais baixa energia podem acomodar
no máximo, respectivamente, 2, 8 e 8 elétrons.
b) O terceiro nível de energia é composto por quatro
subníveis, denominados s, p, d e f.
c) O que caracteriza os elementos de números atômicos
11 a 14 é o preenchimento sucessivo de elétrons no
mesmo nível e no mesmo subnível.
d) Os elementos de números atômicos 10, 18, 36 e 54
têm o elétron mais energético no mesmo nível, mas em
diferentes subníveis.
e) O que caracteriza os elementos de números atômicos
25 a 28 é o preenchimento sucessivo de elétrons no
mesmo nível e no mesmo subnível.
Com base na evolução teórica e, considerando os
postulados de Dalton citados abaixo, marque a ÚNICA
alternativa considerada correta nos dias atuais.
eb
.c
om
.b
r
13. (Uerj 2002) Em 1911, o cientista Ernest Rutherford
realizou um experimento que consistiu em bombardear
uma finíssima lâmina de ouro com partículas ‘,
emitidas por um elemento radioativo, e observou que:
15. (Ufu 2004) Podemos considerar que Dalton foi o
primeiro cientista a formalizar, do ponto de vista
quantitativo, a existência dos átomos.