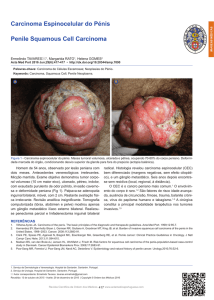
CÂNCER DE PÊNIS: ASPECTOS IMUNOLÓGICOS
André Fellipe Freitas Rodrigues1
RESUMO
Câncer de pênis apresenta incidência considerável nos países em
desenvolvimento. A doença acomete principalmente indivíduos da quarta
década em diante. Apresenta vários cofatores associados à carcinogênese,
todavia, não há evidencias concretas sobre o principal agente etiológico,
embora o papiloma vírus humano seja o mais frequente nestes tumores. Várias
pesquisas buscam elucidar o mecanismo de carcinogênese, entretanto, o papel
do microambiente tumoral tem sido pouco avaliado no carcinoma de pênis. O
microambiente tumoral tem sido investigado em vários tipos de cânceres em
diferentes topografias, corroborando a importância da resposta imune celular,
assim como a humoral frente à carcinogênese. Os mecanismos de
carcinogênese e progressão tumoral podem ser favorecidos ou impedidos pela
resposta imune peritumoral, inclusive no câncer de pênis se mostrando como
fator prognóstico relevante.
Palavras-chave: Câncer de pênis. Microambiente Tumoral. Resposta Imune
Contra Tumores.
PENILE CANCER: ASPECTS IMMUNOLOGICAL
ABSTRACT
Cancer of the penis has considerable impact in developing countries. The
disease mainly affects individuals of the fourth decade onwards. Presents
various cofactors associated with carcinogenesis, however, there is no concrete
evidence about the primary etiologic agent, although the human papillomavirus
is the most common in these tumors. Several studies seek to elucidate the
mechanism of carcinogenesis, however, the role of the tumor microenvironment
has been poorly assessed in penile carcinoma. The tumor microenvironment
has been investigated in several types of cancers in different topographies,
corroborating the importance of the cellular immune response, as well as
humoral front of carcinogenesis. The mechanisms of carcinogenesis and tumor
progression may be helped or hindered by peritumoral immune response,
1 Farmacêutico. Mestre em Oncologia pelo Hospital do Câncer A.C. Camargo – São Paulo
(SP). Docente da Faculdade de Colíder (FACIDER), Colíder (MT). E-mail:
[email protected]. Endereço para correspondência: Avenida Senador Julio
Campos, 995. Loteamento Trevo. Bairro: Centro. CEP: 78.500-000. Colíder – Mato Grosso,
Brasil.
including cancer of the penis is showing as a prognostic factor.
Key words: Penile Cancer. Tumor Microenvironment. Immune Response
Against Tumors.
1. EPIDEMIOLOGIA
O câncer de pênis é uma doença rara em países desenvolvidos,
correspondendo a 0,4 a 0,6% de todas as neoplasias malignas (MOSCONI et
al. 2005; GOODMAN et al. 2007; BARNHOLTZ-SLOAN et al. 2007;
FERRÁNDIZ-PULIDO et al. 2012). Nos Estados Unidos a incidência diminuiu
nos últimos 30 anos embora mais atualmente os pacientes se apresentem em
estádios mais avançados (BARNHOLTZ-SLOAN et al. 2007). A incidência é
também baixa na China (DAI et al. 2006). O câncer de pênis continua sendo
um problema importante de saúde pública nos países em desenvolvimento,
onde constitui cerca de 10% dos tumores malignos do homem (MISRA et al.
2004). A maior incidência desta neoplasia é na Índia (3,32/100000 habitantes),
este é o tumor mais comum entre homens de Uganda e os menores índices
estão entre os judeus nascidos em Israel e nos EUA (0/100000 e 0,07/100000,
respectivamente) (PERSKY et al. 1997; MISRA et al. 2004).
No Brasil o câncer de pênis corresponde a aproximadamente a 2,1% de
todos os tumores do homem. Um estudo epidemiológico realizado no Brasil,
mostra que há regiões que registram 2,9 a 6,8 casos/100.000 habitantes,
representando até 5,7% de todas as neoplasias no sexo masculino. Em regiões
de maior incidência, o câncer de pênis sobrepõe os casos de câncer de
próstata e de bexiga. Cerca de 53% de todos os casos de câncer de pênis no
país são oriundos das regiões norte e nordeste. No estado do Maranhão, um
estado com baixo índice de desenvolvimento humano (IDH), corresponde a
22,7% dos casos de câncer de pênis. Todavia, o câncer de pênis representa
menos de 1% no sul brasileiro (FAVORITO et al. 2008).
No mundo o câncer de pênis acomete principalmente pacientes entre 60
e 70 anos, entretanto é pouco frequente em adultos jovens e raro em crianças
(FICARRA et al. 2006; BLEEKER et al. 2009; SALVIONI et al. 2009).
O câncer de pênis no Brasil ocorre mais precocemente em relação à
população mundial, a partir da quarta década de vida (FAVORITO et al. 2008).
A maioria dos pacientes brasileiros diagnosticados com câncer de pênis são
caucasianos, entretanto, a etnia não parece ser um fator de risco determinante
para esta neoplasia (FAVORITO et al. 2008).
Assim como nos Estados Unidos, os pacientes brasileiros com câncer de
pênis são diagnosticados tardiamente, aproximadamente 70% deles morrem
entre dois e três anos após o diagnóstico (FAVORITO et al. 2008).
2. ETIOLOGIA
Vários fatores têm sido associados ao câncer de pênis, porém a etiologia
concreta continua incerta.
Os principais fatores de risco são a presença de fimose, as baixas
condições socioeconômicas, número elevado de parceiras sexuais, história de
doença venérea, em especial o papiloma vírus humano (HPV), más condições
de higiene e o tabagismo. Outras condições associadas a estes tumores são
inflamação, feridas ou ulcerações no pênis (DALING et al. 2005; BLEEKER et
al. 2009; FERRÁNDIZ-PULIDO et al. 2012). A associação entre o câncer de
pênis e a fimose pode resultar do esmegma, substância que é resultante da
descamação das células epiteliais da face interna do prepúcio e que tem sido
sugerido como agente carcinogênico (SHABAD 1964; RAJU et al. 1985). Por
sua vez a fimose pode causar a retenção de esmegma, assim favorecendo
condições de irritação crônica com ou sem inflamação bacteriana do prepúcio e
da glande, que podem representar um componente crítico no desenvolvimento
e progressão do tumor (BLEEKER et al. 2009).
O papel do HPV na carcinogênese peniana tem sido reportada tanto em
estudos clínicos (BRINTON et al. 1991), quanto em estudos experimentais
abordando o genoma viral e o DNA de células tumorais penianas
(ROSEMBERG et al. 1991, BEZERRA et al. 2001; FERRÁNDIZ-PULIDO et al.
2012). Além dos estudos de biologia molecular para avaliar a presença de
infecção por HPV em espécimes tumorais, mais comente a expressão imunohistoquímica da proteína p16 tem sido utilizada como marcador de infecção
pelo HPV em tumores de cabeça e pescoço e colo do útero. A infecção é
transmitida na maior parte das vezes durante o contato sexual, sem o uso do
preservativo, por acesso direto das partículas virais às células basais através
de pequenos traumas ou soluções de continuidade (BROKER 1987;
FERRÁNDIZ-PULIDO et al. 2012).
O HPV 16 é identificado em aproximadamente 80-90% das neoplasias
malignas do pênis positivas para a infecção, enquanto o HPV 18 é encontrado
em cerca de 10% dos casos (CUPP et al. 1995; GUTIÉRREZ-PASCUAL et al.
2012). No Brasil, uma análise com 82 pacientes relatou a presença do DNA de
HPV em 30,5% dos casos, sendo 52% do tipo 16 e 16% do tipo 18 (BEZERRA
et al. 2001). Taxas consideráveis de infecção pelo HPV são encontradas em
câncer de pênis, que variam entre 31 a 63% (BEZERRA et al. 2001), porém
não se pode atribuir que o vírus do HPV seja a causa do câncer peniano, mas
um cofator associado importante.
A associação entre tabagismo e carcinoma peniano tem sido relatada,
porém continua obscuro qual seria o mecanismo de ação do tabaco na
carcinogênese peniana (HELLBERG et al. 1987; MADEN et al. 1993; HARISH
e RAVI 1995).
Todavia, como fator protetor contra o câncer de pênis podemos citar a
circuncisão, onde vários estudos comprovaram esta associação com incidência
de 3,3% nos indivíduos não circuncidados, e 0% nos indivíduos submetidos à
cirurgia quando recém-nascidos (PAYMASTER e GANGADHARAN 1967;
GUTIÉRREZ-PASCUAL et al. 2012). MADEN et al. (1993), encontraram risco
de 3,2 vezes maior entre homens não circuncidados em relação àqueles
circuncidados ao nascimento e 3 vezes maior em relação àqueles
circuncidados após o período neonatal. Isto demonstra que a circuncisão é
potencialmente protetora quando realizada em recém-nascidos.
3. PATOGÊNESE
O câncer de pênis quase que em 48% dos casos a lesão é evidenciada
na glande, em prepúcio 21% e ambas as áreas 9%, já no sulco coronal
apresenta 6% das lesões. A lesão pode se estender quando não tratada em
estágios iniciais para o prepúcio, infiltrando tecidos adjacentes como o
subepitelial, conjuntivo, corpo esponjoso e cavernoso, e pode invadir órgãos
como próstata e bexiga. São raras as metástases à distância. (CUBILLA,
2009).
Na maioria dos casos a apresentação dos carcinomas de pênis é de
crescimento infiltrativo, mas pode ter apresentação exofítico. GUIMARÃES et
al. (2006) avaliou o padrão de invasão e a embolização e tais achados foram
considerados como fatores independentes na predição de metástases
linfonodais.
O pênis é um órgão muito vascularizado, porém as metástases por via
hematogênica são raras ocorrendo entre 1 a 10%. Em casos avançados, as
principais causas de morte são decorrentes das complicações locorregionais,
com tumor infiltrando feixe vasculonervoso levando à hemorragia e septicemia
(PURAS et al. 1978). A principal via de disseminação é a linfática,
apresentando
metástases
regionais,
para
os
linfonodos
inguinais
e,
posteriormente, para os ilíacos (NARAYAMA et al. 1982; PERSKY e
DEKERNION 1986). Sendo assim, as metástases linfonodais se perfazem
como o principal fator prognóstico para o carcinoma de pênis, e que podem
inclusive ocorrer em estágios precoces da doença (LOPES et al. 1996).
Contudo, pelo menos a metade dos linfonodos presentes são decorrentes de
processos inflamatórios relacionados ao tumor, não sendo assim causados por
metástases de câncer peniano.
Todavia, aproximadamente 20% dos pacientes negativos na avaliação
clínica dos linfonodos têm micro metástases ocultas ao exame histopatológico
(HORENBLAS 2001; FICARRA et al. 2009).
Métodos de diagnóstico por imagem como ultrassonografia, tomografia
computadorizada
e
ressonância
nuclear
magnética
apresentam
baixa
sensibilidade e especificidade para detectar metástases linfonodais (SOLSONA
et al. 2004; FICARRA et al. 2009). A linfadenectomia é indicada na vigência de
comprometimento linfonodal, por aumentar a sobrevida naqueles pacientes
positivos para metástase linfonodal. Entretanto, este procedimento causa altas
taxas de complicações, como infecção do campo cirúrgico (em 24 – 87% dos
casos), necrose (8 – 54%), linfedema (27 – 100%) e óbito (3%). As
complicações decorrentes da linfadenectomia tornam imprescindível o rigoroso
cuidado para selecionar pacientes a serem submetidos a tal procedimento
(FICARRA et al. 2002).
4. ASPECTOS PATOLÓGICOS
Os dados morfológicos além de classificar corretamente o subtipo
tumoral, também podem fornecer informações relevantes em relação ao
comportamento biológico do tumor. Dentre eles podemos destacar o grau
histológico (VELAZQUEZ et al. 2008) a invasão vascular (LOPES et al. 1996),
a invasão perineural (CUBILLA 2007) e o padrão de invasão do tumor
(GUIMARÃES et al. 2006), como aspectos importantes na predição das
metástases linfonodais e da sobrevida.
O carcinoma representa aproximadamente 95% das neoplasias
malignas penianas. Dos casos de carcinoma epidermoide aproximadamente
50% são do tipo usual. Outros tipos histológicos são o carcinoma verrucoso,
basocelular,
melanoma,
sarcoma,
e
o
mais
recentemente
descrito,
pseudoglandular (CUNHA et al. 2009).
Não menos importante para o prognóstico do paciente é o subtipo
histológico, que tem sido associado ao risco de metástases linfonodais e de
morte. Subtipos como papilar e warty são de baixo risco tanto para metástases
quanto para morte, já os sarcomatoides tem alto risco tanto para metástases
quanto para óbito (GUIMARÃES et al. 2009).
O comprometimento linfonodal pela neoplasia é informação importante
para o prognóstico dos pacientes com câncer de pênis, a embolização vascular
e linfática descrita por LOPES et al. (1996) foi relatada como fator prognóstico
independente associado ao status linfonodal. Mais tarde, outros estudos
reproduziram estes resultados (SLATON et al. 2001; FICARRA et al. 2002;
GUIMARÃES et al. 2006), outro achado associado a este evento foi a
espessura tumoral (LOPES et al. 1996).
O sistema de classificação do câncer de pênis TNM, lançado em 2010
de acordo com a American Joint Comitee on Cancer (AJCC) se baseia na
avaliação da extensão tumoral (T), extensão do comprometimento linfonodal
(N) e presença de metástases (M).
Outra informação relevante como preditiva de comprometimento
linfonodal é o grau de diferenciação. Em geral, tumores pouco diferenciados
apresentam risco maior de desenvolvimento de metástases (SLATON et al.
2001; FICARRA et al. 2002; CUNHA et al. 2009). Informação histológica
também importante é o padrão de crescimento e invasão tumoral sendo
exofítico ou infiltrativo e correlacionado ao comprometimento linfonodal, o
padrão infiltrativo apresenta maior incidência de metástases linfonodais (65%)
quando comparado ao padrão exofítico (23%) (GUIMARÃES et al. 2006).
Diante de várias variáveis que predizem prognósticos, o comprometimento
linfonodal é o principal fator. No intuito de minorar a problemática de seleção de
pacientes que se beneficiariam com a linfadenectomia radical tendo em vista o
prognóstico e sobrevida, ainda que este procedimento esteja relacionado às
altas taxas de morbidade e mortalidade, vem sendo elaborados alguns
nomogramas que se norteiam pelo estadiamento clínico dos linfonodos
inguinais e nos achados patológicos dos tumores primários (FICARRA et al.
2006; VELAZQUEZ et al. 2008). Porém, não são totalmente fidedignos quanto
à precisão para o estadiamento tumoral. Diante de vários métodos
controversos quanto à predição de prognóstico e avaliação de envolvimento
linfonodal, vários trabalhos buscam encontrar fatores biomoleculares que sejam
capazes de solucionar tal problema.
5. ASPECTOS IMUNOLÓGICOS NO CÂNCER DE PÊNIS
Através de coloração de hematoxilina e eosina (HE), LOPES, et al.
(1996) estudou 145 pacientes com carcinoma de pênis onde a presença de
eosinofilia peritumoral foi associada à melhor sobrevida, ONO et al. (2001)
usando a mesma metodologia avaliou 17 pacientes e mostrou que eosinofilia
peritumoral melhora a sobrevida de pacientes com câncer de pênis avançado,
FICARRA et al. (2002) ainda na avaliação do infiltrado mononuclear peritumoral
com coloração de HE, o trabalho de FICARRA et al. (2002) não revelou
associação estatística. Já noutro trabalho que estudou 39 pacientes com
carcinoma de pênis, verificou-se que a atividade das células Natural Killer (NK)
no sangue periférico destes pacientes foi estatisticamente diminuída em
relação ao grupo controle (CAMPOS et al. 1998). BEZERRA et al. (2001)
investigou a associação entre HPV e presença de infiltrado mononuclear
peritumoral, bem como eosinofilia em 82 pacientes com carcinoma de pênis,
não houveram associações. Todos os trabalhos que buscaram investigar o
papel da resposta inflamatória peritumoral em carcinomas de pênis utilizaram
somente coloração de rotina HE e observação morfológica.
6. RESPOSTA IMUNE PERITUMORAL
A resposta imune peritumoral ou ainda a presença de linfócitos
infiltrando tumores (TIL) tem sido investigada em vários modelos tumorais.
Em equinos foram estudados por imuno-histoquímica a presença da
resposta inflamatória peritumoral em carcinomas de pênis (onze casos),
conjuntiva (quatro casos), tegumento (dois casos), cavidade nasal (um caso) e
cavidade oral (um caso). Neste estudo o infiltrado inflamatório abundante foi
evidenciado na maioria dos carcinomas, este infiltrado era principalmente
composto por células T (CD3+), células B (CD79+), plasmócitos, macrófagos e
células dendríticas (MHC classe II). Nenhuma das células presentes no
infiltrado peritumoral foi associada com grau histológico ou invasão, sugerindo
que a resposta imune antitumoral falhou na prevenção de invasão e
metástases (PEREZ et al. 1999).
Em humanos o infiltrado inflamatório peritumoral tem sido reportado em
várias topografias, como em carcinoma de cabeça e pescoço, carcinoma de
cólon, carcinoma de ovário, dentre outros. Assim, como para muitos outros
tipos de tumores, no carcinoma de cabeça e pescoço os estudos limitam-se a
avaliação subjetiva do infiltrado inflamatório em espécimes tumorais corados
por HE (hematoxilina e eosina). Um estudo detalhado que ilustra este tipo de
análise avaliou a infiltração de linfócitos em mais de 200 carcinomas
epidermoides de cavidade oral (BRANDWIN-GENSLER et al. 2005). Utilizando
análise multivariada, estes investigadores identificaram que uma resposta
linfocitária fraca ou limitada no tumor e no estroma foi associada à recidiva
locorregional associada com uma redução da sobrevida global. Outros critérios
patológicos também foram estudados, mas a falta de definição do que
realmente constitui o infiltrado linfocitário demonstra a limitação desta
abordagem.
No carcinoma de cabeça e pescoço, assim como em outras topografias
os
primeiros
estudos
que
examinaram
especificamente
os
linfócitos
peritumorais foram à década de 1980 usando na época a recém tecnologia dos
anticorpos monoclonais específicos (WOLF et al. 1986).
Desde então o infiltrado peritumoral no carcinoma de cabeça e pescoço
passou a ser estudado com o propósito de avaliar as populações especificas
de linfócitos. Com o uso de um ponto de corte para avaliação de células por
campo, WOLF et al. (1986), identificaram melhor sobrevida para os pacientes
que tinham a presença no infiltrado intra-tumoral, células T CD4+, mas não
células T CD8+ (WOLF et al. 1986). GUO et al. (1987) examinaram 26
pacientes, a partir de vários subtipos tumorais e encontraram uma tendência de
melhora na sobrevida naqueles pacientes que tinham todas as populações de
linfócitos T aumentadas, porém não foram estatisticamente significativas.
Corroborando com os resultados de WOLF et al. (1986) um estudo em
carcinoma de laringe demonstrou que TIL CD4+ mas não CD8+ são
significativamente
correlacionados
com
a
sobrevida
desses
pacientes
(BADOUAL et al. 2006).
Células T regulatórias (Treg) ou ainda FOXP3+ (Forkhead box P3) são
evidenciadas em abundância em alguns tipos tumorais como no carcinoma de
ovário (CURIEL et al. 2004), carcinoma de mama (RONCADOR et al. 2005) e
linfoma (LEONG et al. 2006). Essa população de células pode tornar-se
abundante nos tumores, através de vários mecanismos facilitados pelo
microambiente tumoral. Citocinas e quimiocinas produzidas dentro dos tumores
podem sustentar a proliferação, migração, retenção e até mesmo a
sobrevivência de Treg em comparação com outros TIL (CURIEL et al. 2004).
Num estudo com carcinomas de mama o padrão de expressão de
FOXP3+ foi caracterizado pela imuno-histoquímica em tumores primários de
397 pacientes e sua alta expressão foi associada com pior probabilidade de
sobrevida global, o aumento de FOXP3+ também se mostrou um forte fator
prognóstico para a sobrevida livre de metástases à distância, porém, não para
o risco de recorrência local. Na análise multivariada FOXP3 resultou como fator
prognóstico independente, a taxa de expressão de FOXP3 e o risco de
linfonodos comprometidos pela neoplasia foram semelhantes (MERLO et al.
2009).
Linfócitos B também têm sido investigados no infiltrado peritumoral. No
carcinoma de cabeça e pescoço um estudo avaliou TIL tanto no tumor primário
quanto em linfonodos regionais por imuno-histoquímica em trinta e três
pacientes, foi evidenciado que células B em grande quantidade é relevante
como prognóstico destes pacientes (PRETSCHER et al. 2009).
A presença de macrófagos associados a tumores (TAM) em mama,
próstata e bexiga são correlacionados com pior prognóstico (SICA et al. 2008).
O papel do infiltrado inflamatório peritumoral tem sido investigado em vários
modelos tumorais, porém, pouco ou quase nada se sabe a respeito no
carcinoma de pênis.
CONSIDERAÇÕES FINAIS
O câncer de pênis tem incidência considerável em países em
desenvolvimento como o Brasil, alguns pesquisadores buscam elucidar a
etiologia e melhor conduta clínica inerente a esta neoplasia, porém em relação
à resposta imunológica desencadeada por este câncer não há dados
satisfatórios, ou seja, que determinem qual o papel da resposta imune celular
ou humoral através de técnicas de biologia molecular ou ensaios imunológicos
fidedignos.
REFERÊNCIAS
Badoual C, Hans S, Rodriguez J, et al. Prognostic value of tumor-infiltrating
CD4+ T-cell sub populations in head and neck cancers. Clin Cancer Res 2006;
2:465-72.
Barnholtz-Sloan JS, Maldonado JL, Pow-sang J, Giuliano AR. Incidence trends
in primary malignant penile cancer. Urol Oncol 2007; 25:361-7.
Bezerra AL, Lopes A, Santiago GH, Ribeiro KC, Latorre MR, Villa LL. Human
papillomavirus as a prognostic factor in carcinoma of the penis: analysis of 82
patients treated with amputation and bilateral lymphadenectomy. Cancer 2001;
12:2315-21.
Bleeker MCG, Heideman DAM, Snijders PJF, Horemblas S, Dillner J, Meijer
CJLM. Penile cancer: epidemiology, pathogenesis and prevention. World J
Urol 2009; 27:141-50.
Brandwin-Gensler M, Teixeira MS, Lewis CM, et al. Oral squamous cell
carcinoma: histologic risk assessment, but not margin status, is strongly
predictive of local disease-free and overall survival. Am J Surg Pahol 2005;
29:167-178.
Brinton LA, Juan-Yao L, Shou-de R, et al. Risk factors for penile cancer:
results from a case-control study in China. Int J Cancer 1991; 47:504-9.
Broker TR. Structure and genetic expression of papillomaviruses. Obstet
Gynecol Clin North Am 1987; 14:329-48.
Campos MM, de Souza MH, Pires V, Scheiner MA, Esteves EB, Ornellas AA.
Clinical implications of natural killer cytotoxicity in patients with squamous cell
carcinoma of the penis. Nat Immun 1998; 16:256-62.
Cubilla A. The role of pathologic prognostic factors in squamous cell carcinoma
of the penis. World J Urol 2009; 2:169-77.
Cunha IW, Guimarães GC, Soares FA, et al. Pseudoglandular (adenoid,
acantholytic) penile squamous cell carcinoma: a clinicopathologic and outcome
study of 7 patients. Am J Surg Pathol 2009; 33:551-5.
Cupp MR, Malek RS, Goellner JR, Smith TF, Espy MJ. The detection of human
papillomavirus deoxyribonucleic acid in intraepithelial, in situ, verrucous and
invasive carcinoma of the penis. J Urol 1995; 154:1024-9.
Curiel TJ, Coukos G, Zou L, et al. Specific recruitment of regulatory T cells in
ovarian carcinoma fosters immune privilege and predicts reduced survival. Nat
Med 2004; 9:942-9.
Dai B, Ye DW, Kong YY, Yao XD, Zhang HL, Shen YJ. Predicting regional lymph
node metastasis in Chinese patients with penile squamous cell carcinoma: the
role of histopathologic classification, tumor stage and depth of invasion. J Urol
2006; 176:1431-5.
Daling JR, Madeleine MM, Johnson LG, et al. Penile cancer: importance of
circumcision, human papillomavirus and smoking in in situ and invasive
disease. Int J Cancer 2005; 116:606-16.
Favorito LA, Nardi AC, Ronalsa M, Zequi SC, Sampaio JBS, Glina S.
Epidemiologic study of penile cancer in Brazil. Int Braz j Urol 2008; 34:587-93.
Ferrándiz-Pulido C, de Torres I, García-Patos V. Penile squamous cell
carcinoma. Actas Dermosifiliogr 2012;103:478-87.
Ficarra V, Martignoni G, Maffei N, et al. Predictive pathological factors of lymph
nodes involvement in the squamous cell carcinoma of the penis. Int Urol
Nephrol 2002; 34:245-50.
Ficarra V, Zattoni F, Artibani W, et al. Nomogram predictive of pathological
inguinal lymph node involvement in patients With squamous cell carcinoma
of the penis. J Urol 2006; 175:1700-5.
Ficarra V, Novara G, Boscolo-Berto R, Artibani W, Kattan MW. How accurate
are present risk group assignment tools in penile cancer? World J Urol 2009;
27:155-60.
Goodman MT, Hernandez BY, Shvestov YB. Demographic and pathologic
differences in the incidence of invasive penile cancer in the United States,
1995-2003. Cancer Epidemiol Biomarkers Prev 2007; 16:1833-9.
Guimarães GC, Lopes A, Campos RSM, Zequi SC, Leal MLO, Carvalho AL,
Cunha IW, Soares FA. Front pattern of invasion in squamous cell carcinoma of
the penis: new prognostic factor for predicting risk of lymph node metastasis.
Urology 2006; 68:148-53.
Guimarães G, Cunha IW, Soares FA, et al. Clinicopathological features, nodal
metastasis and outcome according to WHO classification of penile squamous
cell carcinoma: a report of 333 cases. J Urol 2009; 182:528-34.
Guo M, Rabin BS, Johnson JT, Paradis IL. Lymphocyte phenotypes at tumor
margins in patients with head and neck cancer. Head Neck Surg 1987; 9:265271
Gutiérrez-Pascual
M,
Vicente-Martín
FJ,
López-Estebaranz
JL.
Lichen
sclerosus and squamous cell carcinoma. Actas Dermosifiliogr. 2012 103:21-8.
Harish K, Ravi R. The role of tobacco in penile carcinoma. Br J Urol 1995;
75:375-7.
Hellberg D, Valentin J, Eklund T, Nilsson S. Penile cancer: is there an
epidemiological role for smoking and sexual behavior? Br Med J 1987;
1995:1306-8.
Horenblas S. Lymphadenectomy for squamous cell carcinoma of the penis. Part
1: Diagnosis of lymph node metastasis. BJU International 2001; 88:467-72.
Leong PP, Mohammad R, Ibrahim N, et al. Phenotyping of lymphocytes
expressing regulatory and effector markers in infiltrating ductal carcinoma of the
breast. Immunol Lett 2006; 102:229-36.
Lopes A, Rossi BM, Fonseca FP, Morini S. Unrealiability of modified inguinal
lymphadenectomy for clinical staging of penile carcinoma. Cancer 1996;
77:2099-02.
Maden C, Sherman KJ, Beckmann AM, et al. History of circumcision, medical
conditions, and sexual activity and risk of penile cancer. J Natl Cancer Inst
1993; 85:19-24.
Merlo A, Casalini P, Carcangiu ML, et al. FOXP3 expression on overall survival
in breast Cancer. J Clin Oncol 2009; 11:1747-52.
Misra S, Chaturvedi A, Misra NC. Penile carcinoma: a challenge for the
developing world. Lancet Oncol 2004; 5:240-7.
Mosconi AM, Roila F, Gatta G, Theodore C. Cancer of the penis. Crit Rev
Oncol/Hematol 2005; 53:165-77.
Narayama AS, Olney LE, Loening AS, et al. Carcinoma of the penis: analysis
of 219 cases. Cancer 1982; 49:2185-91.
Ono Y, Ozawa M, Tamura Y, et al. Tumor-associated tissue eosinophilia of
penile cancer. Int J Urol 2002; 9:82-7.
Paymaster JC, Gangadharan P. Cancer of the penis in India. J Urol 1967;
97:110-3.
Perez J, Mozos E, Martin MP, Day MJ. Immunohistochemical study of the
inflammatory infiltrate associated with equine squamous cell carcinoma. J
Comp Path 1999; 121:385-97.
Persky L, Dekernion J. Carcinoma of the penis. CA Cancer J Clin 1986;
36:258-73.
Persky L. Epidemiology of cancer of the penis. Recent Results Cancer Res
1997; 60:97-109.
Pretscher D, Distel LV, Grabenbauer GG, Wittlinger M, Buettner M, Niedobitek
G. Distribution of immune cells in head and neck cancer: CD8+ T-cells and
CD20+ B-cells in metastatic lymph nodes are associated with favourable
outcome in patients with oro- and hypopharyngeal carcinoma. BMC Cancer
2009; 9:292-98.
Puras A, Gonzales-Flores B, Rodrigues R. Treatment of carcinoma of the penis.
Proc Kimbrough Urol Semin 1978; 12:143-52.
Raju GC, Naraynsingh V, Venu PS. Carcinoma of the penis in the West Indies:
a Trinidad Study. Trop Geogr Med 1985; 37:334-6.
Roncador G, Garcia JF, Maestre L, et al. FoxP3, a selective marker for a subset
of adult T-cell leukaemia/lymphoma. Leukemia 2005; 19:2247-53.
Rosemberg SK, Hennan G, Elfonte E. Sexually transmitted papillomaviral
infection in the male. VII. Is cancer of penis sexually transmitted? Urology
1991; 37:437-40.
Salvioni R, Necchi A, Piva L, Colecchia M, Nicolai N. Penile cancer. Urol Oncol
2009; 27:677-85.
Shabad AL. Some aspects of etiology and prevention of penile cancer. J Urol
1964; 92:696-702.
Sica A, Larghi P, Mancino A, et al. Macrophage polarization in tumour
progression. Semin Cancer Biol 2008; 5:349-55.
Slaton JW, Morgenstern N, Levy DA, et al. Tumor stage, vascular invasion and
the percentage of poorly differentiated cancer: independent prognosticators for
inguinal lymph node metastasis in penile squamous cancer. J Urol 2001;
165:1138-42.
Solsona E, Algaba F, Horenblas S, Pizzocaro G, Windahl T; European
Association of Urology. EAU Guidelines on Penile Cancer. Eur Urol 2004; 46:18.
Velazquez EF, Cubilla AL. Penile squamous cell carcinoma. Anatomic,
pathologic, and viral studies in Paraguay (1993-2007). Anal Quant Cytol Histol
2007; 29:185-98.
Wolf GT, Hudson JL, Peterson KA, Miller HL, McClatchey KD. Lymphocyte
subpopulations infiltrating squamous carcinomas of the read and neck:
correlations with extent of tumor and prognosis. Otolaryngol Head Neck Surg
1986; 95:142-52.