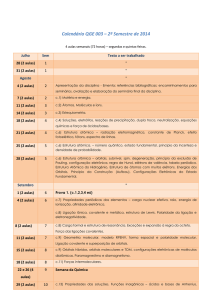
Química Orgânica I
UNIDADE 3
Prof. Dr. Samuel Mendes
Quím. Orgânica I - Prof. Dr. Samuel Mendes
Quím. Orgânica I - Prof. Dr. Samuel Mendes
2
Quím. Orgânica I - Prof. Dr. Samuel Mendes
Unidade 3
Carbono:
Hibridização e características estruturais
3
Quím. Orgânica I - Prof. Dr. Samuel Mendes
Carbono
O Carbono é um átomo pequeno forma ligações
simples, duplas e triplas;
-tem eletronegatividade intermediária (2.5);
-forma ligações fortes com C, H, O, N, e alguns
metais.
4
Quím. Orgânica I - Prof. Dr. Samuel Mendes
5
Elementos Organógenos
É um conjunto de 4 elementos que formam praticamente todos os
compostos da Química orgânica.
Além do carbono, que é tetravalente, temos:
Quím. Orgânica I - Prof. Dr. Samuel Mendes
6
Elementos Organógenos
Outros elementos que também formam compostos orgânicos, mas em
menor número, são:
Quím. Orgânica I - Prof. Dr. Samuel Mendes
7
Hibridização
- A combinação de dois ou mais orbitais
Linus Pauling
atômicos para formar um novo conjunto
de orbitais atômicos, denominados de orbitais atômicos
híbridos;
-Um átomo de carbono tende a partilhar elétrons em
ligações covalentes;
- Um único átomo de carbono pode partilhar um máximo de
quatro pares de elétrons para formar compostos do tipo
metano CH4.
Quím. Orgânica I - Prof. Dr. Samuel Mendes
8
Orbitais Híbridos sp³
Estrutura do metano
Tetraedro regular com hidrogênio nos quatro vértices e carbono
no centro, sendo os ângulos H-C-H de 109,5°
- As quatro ligações covalentes são equivalentes.
- Os quatro orbitais do carbono também devem ser
equivalentes.
Quím. Orgânica I - Prof. Dr. Samuel Mendes
9
Orbitais Híbridos sp³
- Se os átomos de H se ligam aos orbitais 2s, 2px, 2py e 2pz, os
ângulos entre as ligações seriam diferentes de 109,5°.
- Na verdade a explicação está baseada na hibridização
(hibridação) de quatro orbitais atômicos.
Os orbitais 2s, 2px, 2py e 2pz do carbono,
cada um contendo um elétron de valência,
formam quatro orbitais sp³ equivalentes.
Quím. Orgânica I - Prof. Dr. Samuel Mendes
10
Orbitais Híbridos sp³
- Permitem a formação de ligações mais fortes (σ) e nas
direções adequadas para minimizar as repulsões dos núcleos
de hidrogênio.
Quím. Orgânica I - Prof. Dr. Samuel Mendes
11
Orbitais Híbridos sp³
O carbono no metano está ligado a quatro átomos, de modo que ele hibridiza
quatro orbitais – um “s” e três “p”.
2px 2py 2pz
1s 2s
Estado fundamental de um
átomo de carbono
promoção
p
p
p
s
hibridização
sp3 sp3 sp3 sp3
orbitais híbridos
quatro orbitais
são hibridizados
Quím. Orgânica I - Prof. Dr. Samuel Mendes
Quím. Orgânica I - Prof. Dr. Samuel Mendes
12
Orbitais Híbridos sp³
- O átomo de carbono ocupa o centro do tetraedro e os átomos
de hidrogênio ocupam os vértices.
Quím. Orgânica I - Prof. Dr. Samuel Mendes
13
Orbitais Híbridos sp³
- Arranjo espacial em que a distância entre os átomos de
hidrogênio e consequentemente, a repulsão entre os elétrons
das ligações C-H é minimizada.
Quím. Orgânica I - Prof. Dr. Samuel Mendes
Orbitais Híbridos sp³
Etano: C2H6
Tetraedros ligados pelos vértices
14
Quím. Orgânica I - Prof. Dr. Samuel Mendes
15
Orbitais Híbridos sp³
- Oxigênio e o Nitrogênio também podem ter hibridização sp³.
- O ângulo de ligação H-X-H diminui na ordem:
.
H
N
C
H
H
H
H
H
O
H
H
H
109,5 °
107 °
104,5 °
tetraédrica
piramidal
angular
- Os elétrons em uma ligação, são atraídos por dois núcleos, eles não se
repelem tanto quanto os pares de elétrons não-ligantes. Consequentemente,
os ângulos de ligação diminuem quando o número de pares de elétrons nãoligantes aumenta.
Quím. Orgânica I - Prof. Dr. Samuel Mendes
Orbitais Híbridos sp2
16
Quím. Orgânica I - Prof. Dr. Samuel Mendes
Orbitais Híbridos sp2
17
Quím. Orgânica I - Prof. Dr. Samuel Mendes
18
Orbitais Híbridos sp2
O carbono no eteno está ligado a três átomos, de modo que ele hibridiza três
orbitais – um “s” e dois “p”.
2px 2py 2pz
1s 2s
Estado fundamental de um
átomo de carbono
p
promoção
p
p
p
hibridização
s
sp2 sp2 sp2
orbitais híbridos
Três orbitais
são hibridizados
Vista frontal
Vista superior
Quím. Orgânica I - Prof. Dr. Samuel Mendes
Quím. Orgânica I - Prof. Dr. Samuel Mendes
19
Orbitais Híbridos sp2
Observe que, o carbono deve reservar 1 orbital p puro (sem hibridizar) para
fazer a ligação π.
Quím. Orgânica I - Prof. Dr. Samuel Mendes
20
Orbitais Híbridos sp2
- A aproximação entre dois átomos de carbono sp² leva à formação da ligação
σ (sp²-sp²) por meio da sobreposição frontal entre os orbitais sp² de cada
átomo.
- A sobreposição lateral entre os orbitais 2p resulta na ligação π.
Quím. Orgânica I - Prof. Dr. Samuel Mendes
Orbitais Híbridos sp2
Quím. Orgânica I - Prof. Dr. Samuel Mendes
21
Quím. Orgânica I - Prof. Dr. Samuel Mendes
22
Orbitais Híbridos sp2
- Os átomos de carbono encontram-se ligados por meio de uma
ligação dupla, sendo uma delas do tipo σ e outra do tipo π.
Eteno
- Ângulo entre as ligações ~ 120°.
- Geometria da molécula: trigonal plana.
Quím. Orgânica I - Prof. Dr. Samuel Mendes
Orbitais Híbridos sp
23
Quím. Orgânica I - Prof. Dr. Samuel Mendes
24
Orbitais Híbridos sp
- Neste caso, um orbital 2s se combina com um orbital 2p para formar dois
orbitais híbridos sp. A ligação σ (C-C) é formada pela sobreposição frontal
dos orbitais sp, cada um de um carbono.
Quím. Orgânica I - Prof. Dr. Samuel Mendes
25
Orbitais Híbridos sp
O carbono no etino está ligado a dois átomos, de modo que ele hibridiza dois
orbitais – um “s” e um “p”.
2px 2py 2pz
1s 2s
Estado fundamental de um
átomo de carbono
p
promoção
p
p
s
p
hibridização
sp sp
orbitais híbridos
dois orbitais
são hibridizados
Quím. Orgânica I - Prof. Dr. Samuel Mendes
p
Quím. Orgânica I - Prof. Dr. Samuel Mendes
26
Orbitais Híbridos sp
Observe que, neste caso, o
carbono deve reservar 2
orbitais p puros (sem hibridizar)
para fazer as ligações π.
Quím. Orgânica I - Prof. Dr. Samuel Mendes
Orbitais Híbridos sp
27
Quím. Orgânica I - Prof. Dr. Samuel Mendes
Orbitais Híbridos sp - Etino
Quím. Orgânica I - Prof. Dr. Samuel Mendes
28
Quím. Orgânica I - Prof. Dr. Samuel Mendes
29
Orbitais Híbridos sp
- O átomo de carbono que se liga a outros átomos por meio de uma
ligação σe duas ligações π, apresenta hibridização sp;
- O ângulo entre os orbitais é de 180 °e a geometria é linear;
-O hidrocarboneto mais simples que possui carbono sp é o acetileno:
Quím. Orgânica I - Prof. Dr. Samuel Mendes
Orbitais Híbridos sp
- O átomo central do aleno também apresenta hibridização sp.
30
Quím. Orgânica I - Prof. Dr. Samuel Mendes
Resumo
31
Resumo
Quím. Orgânica I - Prof. Dr. Samuel Mendes
32
• Uma ligação π é mais fraca que uma ligação σ;
• Quanto maior a densidade de elétrons na região de sobreposição dos
orbitais, mais forte a ligação;
• Quanto maior o caráter s, mais curta e mais forte a ligação.
Quím. Orgânica I - Prof. Dr. Samuel Mendes
Quím. Orgânica I - Prof. Dr. Samuel Mendes
Unidade IV
• Análise conformacional
33