Lista de Exercícios
Aluno (a): ____________________________________________________ Nº. ____
Professora: Núbia de Andrade
Série: 2º ano (Ensino médio) Turma: ____
Disciplina: Química
Goiânia, ____ / ____ / 2014
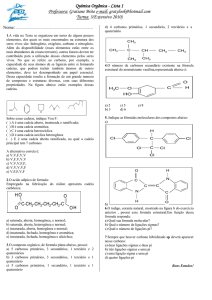
01) Recentemente, os produtores de laranja do Brasil foram surpreendidos com a notícia de que a exportação de
suco de laranja para os Estados Unidos poderia ser suspensa por causa da contaminação pelo agrotóxico
carbendazim, representado a seguir.
De acordo com a estrutura, afirma-se que o carbendazim possui:
a) fórmula molecular C9H11N3O2 e um carbono terciário.
b) fórmula molecular C9H9N3O2 e sete carbonos secundários.
c) fórmula molecular C9H13N3O2 e três carbonos primários.
d) cinco ligações pi () e vinte e quatro ligações sigma ().
e) duas ligações pi () e dezenove ligações sigma ().
02) A anemia falciforme é uma doença provocada por uma mutação no cromossomo 11. Caracteriza-se pela
substituição de um ácido glutâmico por uma valina em uma das cadeias que compõem a molécula de hemoglobina.
Essa alteração provoca a mudança da forma das hemácias fazendo com que elas apresentem uma estrutura em
forma de foice, o que gera graves dificuldades para a sua circulação pelos vasos sanguíneos. Abaixo, estão as
estruturas químicas do ácido glutâmico e da valina.
a) Quantos carbonos primários, secundários e terciários existem na estrutura do ácido glutâmico e da valina?
b) Qual é a função da molécula de hemoglobina presente nas hemácias?
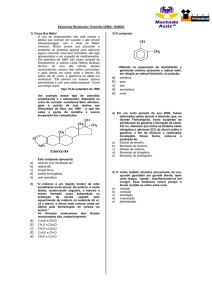
03) O composto apresenta:
CH3
CH3
C
CH3
NH2
a) cadeia carbônica insaturada.
b) somente carbonos primários.
c) um carbono quaternário.
d) três carbonos primários e um terciário.
e) cadeia carbônica heterogênea.
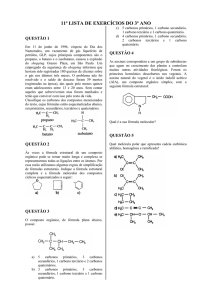
04) O composto de fórmula:
CH3
CH3
C
CH
C
OH
CH3 H
CH
CH
N
CH3
CH
CH3
CH3
CH3
Apresenta quantos carbonos primários, secundários, terciários e quaternários, respectivamente?
a) 5, 5, 2 e 1
b) 5, 4, 3 e 1
c) 7, 4, 1 e 1
d) 6, 4, 1 e 2
e) 7, 3,1 e 2
www.colegioanhanguera.com.br
1
05) O composto orgânico, de fórmula plana, possui:
CH3 H
CH3
C
C
CH2
CH3
CH3 CH3
a) 5 carbonos primários, 3 carbonos secundários, 1 carbono terciário e 2 carbonos quaternários.
b) 3 carbonos primários, 3 carbonos secundários, 1 carbono terciário e 1 carbono quaternário.
c) 5 carbonos primários, 1 carbono secundário, 1 carbono terciário e 1 carbono quaternário.
d) 4 carbonos primários, 1 carbono secundário, 2 carbonos terciários e 1 carbono quaternário.
06) “Química Orgânica é o ramo da Química que estuda os compostos do carbono”. A maioria dos seus compostos
são importantes em nossas vidas, destacando o álcool comum, a gasolina, o ácido acético, as proteínas e as
vitaminas.
Assinale a alternativa que mostra a característica correta do átomo de carbono.
3
a) Forma ligação tripla, e nesta situação o carbono é do tipo sp .
b) O carbono é tetravalente somente nos hidrocarbonetos.
c) Apresenta capacidade de formar cadeias longas, variadas e estáveis.
d) Liga-se a várias classes de elementos químicos, com exceção da classe dos calcogênios.
07) No hidrocarboneto de fórmula estrutural representada abaixo, os átomos de carbono estão numerados de 1 a 7.
H
H
H
H
H
C
C
C
6
5
C4
7
H
H
H
C
3
C
2
C1
H
H
Sobre esse hidrocarboneto são feitas as seguintes afirmativas:
I. O total de ligações (pi) na estrutura é igual a 3.
II. O átomo de carbono 2 forma 3 ligações (pi) e 1 ligação (sigma).
III. O átomo de carbono 5 forma 3 ligações (sigma) e 1 ligação (pi).
IV. O átomo de carbono 1 forma 4 ligações (sigma).
São CORRETAS apenas as afirmativas:
a) I, III e IV.
b) II e IV.
c) I e II.
d) I, II e IV.
08)
A distribuição eletrônica do carbono, no estado fundamental, entretanto, mostra que ele é bivalente. Para que o
carbono atenda ao postulado de Kekulé, ele sofre:
a) ressonância.
b) isomeria.
c) protonação.
d) hibridização.
e) efeito indutivo.
09) O composto H C C H deve apresentar na sua estrutura, para cada carbono:
a) 2 ligações sigma e 2 ligações pi
b) 2 ligações sigma e 3 ligações pi
c) 3 ligações sigma e 2 ligações pi
d) 5 ligações sigma
e) somente ligações pi
10) A seqüência correta dos orbitais híbridos em que estão ligados os átomos de carbono na molécula do 1,3pentadieno, cuja fórmula está abaixo representada, é:
H2C = CH – CH = CH – CH3
2
2
2
2
3
a) sp – sp – sp – sp – sp .
3
2
2
2
3
b) sp – sp – sp – sp – sp .
3
2
3
3
2
c) sp – sp – sp – sp – sp .
2
2
2
2
d) sp – sp – sp – sp – sp.
2
3
2
e) sp – sp – sp – sp – sp .
11) O gráfico a seguir mostra a solubilidade de alguns sais, em gramas do soluto/100mL de água, em função da
temperatura:
www.colegioanhanguera.com.br
2
Baseando-se nesse gráfico, responda às questões a seguir:
o
o
a) qual o sal cuja solubilidade sofre um maior efeito da temperatura, no intervalo de 60 C a 100 C?
o
o
b) qual o sal cuja solubilidade sofre um menor efeito da temperatura, no intervalo de 60 C a 100 C?
c) qual a temperatura em que o NaCl e o KCl apresentam a mesma solubilidade?
o
d) qual a menor quantidade de água, a 60 C, necessária para dissolver completamente 200g de Pb(NO3)2?
12) Uma solução saturada de nitrado de potássio (KNO 3) constituída, além do sal, por 100g de água está à
o
o
temperatura de 70 C. Essa solução é resfriada a 40 C, ocorrendo precipitação de parte do sal dissolvido.
Calcule:
a) a massa do sal que precipitou;
b) a massa do sal que permaneceu em solução.
A seguir, o gráfico da solubilidade do nitrato de potássio em função da temperatura.
13) O gráfico a seguir apresenta os coeficientes de solubilidade, em gramas/100mL de água, de algumas
substâncias A, B, C, D em função da temperatura.
o
a) D é a substância mais solúvel, em gramas, a 20 C.
b) B é mais solúvel a quente
o
c) a 40 C a substância A é mais solúvel em gramas, que a substância D
o
d) a concentração de C duplica a cada 20 C.
o
e) todas as substâncias têm o mesmo coeficiente de solubilidade a 45 C.
14) O gráfico mostra a curva de solubilidade de um sal em água.
Considerando que em uma determinada temperatura 40g deste sal foram dissolvidos em 100g de água. Indique:
a) a característica desta solução, quanto à concentração, nos pontos A, B e C do gráfico;
o
b) a quantidade de sal que será possível cristalizar, resfriando a solução até 30 C;
o
c) a quantidade de sal que será cristalizada quando se evapora 20g de água a 40 C.
15) As curvas de solubilidade de dois sais A e B, em água, são dadas abaixo:
www.colegioanhanguera.com.br
3
Dissolvendo 100g de cada sal em 100g de água a 60ºC, determine a massa total do precipitado existente:
a) 60 g
b) 70 g
c) 80 g
d) 120 g
e) 140 g
16) A curva de solubilidade de um dado sal é apresentada abaixo.
Considerando a solubilidade deste sal a 30ºC, qual seria a quantidade máxima (aproximada) de soluto
cristalizada quando a temperatura da solução saturada (e em agitação) fosse diminuída para 20ºC?
a) 5 g
b) 10 g
c) 15 g
d) 20 g
e) 30 g
17) Sobre o seguinte gráfico de solubilidade do nitrato de potássio (KNO3), assinale o que for correto.
01. O ponto B corresponde à máxima solubilidade do KNO3 à temperatura de ebulição da água.
02. No ponto D, a massa de KNO3 dissolvida é igual ao seu coeficiente de solubilidade.
04. No ponto A, o KNO3 apresenta seu menor grau de saturação, constituindo uma solução diluída.
08. No ponto C, a solução é concentrada.
16. Em qualquer ponto da curva de solubilidade, a solução é saturada.
18) O gráfico a seguir representa a curva de solubilidade de NaNO 3 em função da temperatura.
www.colegioanhanguera.com.br
4
Quatro misturas de nitrato de sódio, A, B, C e D, foram preparadas, em diferentes temperaturas, misturando-se
diferentes massas de NaNO3 em água.
A partir da análise desse gráfico, é correto afirmar que:
a) as misturas A e C apresentam precipitado;
b) apenas a mistura A apresenta precipitado;
c) as misturas C e D formam soluções supersaturadas;
d) a mistura C apresenta a maior quantidade de sólido precipitado;
e) as concentrações das soluções aquosas resultantes das misturas A e D são iguais.
19. Qual a concentração em g L–1 de uma solução resultante da dissolução de 50 gramas de NaCl para um
a)
b)
c)
d)
e)
volume final de 200 mL?
–1
0,25 g L
–1
25 g L
–1
250 g L
–1
4gL
–1
0,4 g L
20. Considere duas latas do mesmo refrigerante, uma na versão “diet” e outra na versão comum. Ambas contêm
o mesmo volume de líquido (300 mL) e têm a mesma massa quando vazias. A composição do refrigerante é
a mesma em ambas, exceto por uma diferença: a versão comum contém certa quantidade de açúcar,
enquanto a versão “diet” não contém açúcar (apenas massa desprezível de um adoçante artificial). Pesandose duas latas fechadas do refrigerante, foram obtidos os seguintes resultados:
amostra
lata com refrigerante comum
lata com refrigerante “diet” 316,2
massa (g)
331,2
Por esses dados, pode-se concluir que a concentração, em g/L, de açúcar no refrigerante comum é de,
aproximadamente,
a) 0,020
b) 0,050
c) 1,1
d) 20
e) 50
21. Nutrientes para a pele, como as vitaminas A e E, ajudam a reduzir os danos causados pelos radicais livres,
a)
b)
c)
d)
e)
graças às suas fortes propriedades antioxidantes. A dose diária de vitamina C recomendada para satisfazer
as necessidades do corpo é de 100 mg. Assim, ao dissolver essa quantidade de vitamina C em meio copo
d’água (cerca de 100 mL), obtém-se uma solução de vitamina C de concentração, em g/L, de,
aproximadamente,
0,1
0,2
0,5
0,8
1,0
www.colegioanhanguera.com.br
5