Hospital do Servidor Público Municipal
LINFOMA NÃO-HODGKIN OCULAR EM PACIENTE
COM LÚPUS ERITEMATOSO SISTÊMICO
MARIA CAROLINA DE CAMARGO VIEIRA
São Paulo
2011
Hospital do Servidor Público Municipal
LINFOMA NÃO-HODGKIN OCULAR EM PACIENTE
COM LÚPUS ERITEMATOSO SISTÊMICO
MARIA CAROLINA DE CAMARGO VIEIRA
São Paulo
2011
MARIA CAROLINA DE CAMARGO VIEIRA
LINFOMA NÃO-HODGKIN OCULAR EM PACIENTE
COM LÚPUS ERITEMATOSO SISTÊMICO
Trabalho de Conclusão de Curso, apresentado à Comissão de Residência
Médica do Hospital do Servidor Público Municipal, como parte dos requisitos
para obtenção do título de Residência Médica.
Área de concentração: Clínica Médica
Orientadora: Drª Pérola Goberstein Lerner
São Paulo
2011
AUTORIZO A REPRODUÇÃO E DIVULGAÇÃO TOTAL OU PARCIAL DESTE
TRABALHO, POR QUAQUER MEIO CONVENCIONAL OU ELETRÔNICO,
PARA FINS DE ESTUDO E PESQUISA, DESDE QUE CITADA A FONTE E
COMUNICADO AO AUTOR A REFERÊNCIA DA CITAÇÃO
SÃO PAULO, _____DE __________________DE ____________
Assinatura do autor:
E-mail do autor:
[email protected]
MARIA CAROLINA DE CAMARGO VIEIRA
LINFOMA NÃO-HODGKIN OCULAR EM PACIENTE
COM LÚPUS ERITEMATOSO SISTÊMICO
Trabalho de Conclusão de Curso, apresentado à Comissão de Residência
Médica do Hospital do Servidor Público Municipal, para obtenção do título de
Residência Médica.
Área de Concentração: Clínica Médica
Orientador: Drª Pérola Goberstein Lerner
APROVADO EM ____/____/____
BANCA EXAMINADORA
Avaliador 1
_______________________________________________________________
Avaliador 2
_______________________________________________________________
Avaliador 3
Resumo
O Lúpus Eritematoso Sistêmico (LES) é uma doença crônica auto-imune, de
causa desconhecida, com predomínio no sexo feminino, caracterizado pela
presença de anticorpos à diversos antígenos nucleares. Seu curso apresenta
períodos de remissão e recidivas, podendo evoluir com diversas manifestações
clínicas, incluindo alterações hematológicas, cutâneas, neurológicas, renais e
músculo-esqueléticas. Seu diagnóstico inclui critérios clínicos e/ou
laboratoriais.
Os linfomas são tumores sólidos que têm origem em tecido linfóide normal,
classicamente divididos em não-Hodgkin ou Hodgkin, com base em achados
clínicos-patológicos. Os linfomas não Hodgkin, na maioria dos casos, têm
etiologia indefinida e multifatorial e sua fisiopatologia deriva de alterações nas
células do sistema imune durante seus diferentes estágios de maturação. São
subclassificados em diversos tipos sendo linfoma de células B da zona
marginal extra nodal (MALT) um deles. Suas manifestações clínicas dependem
do local acometido, sendo o olho uma localização pouco comum. O diagnóstico
se dá através de biópsia.
Desta forma, o objetivo do estudo foi descrever e comparar com a literatura o
caso de uma paciente acompanhada pelo Serviço de Reumatologia do Hospital
do Servidor Público Municipal, com diagnóstico de Lúpus Eritematoso
Sistêmico que desenvolveu linfoma não-Hodgkin ocular do tipo células B da
zona marginal extra nodal.
Ao final do trabalho pode-se verificar a relação entre doenças auto-imunes e
linfoma não Hodgkin.
Palavras-chave= lúpus; linfoma
Abstract
Systemic Lupus Erythemathosus (SLE) is a chronic autoimmune disease, with
unknown cause, affecting mainly females, characterized by the presence of
antibodies against some nuclear antigens. The disease’s course has periods of
remission and recurrence, and it can evolve with different clinical manifestation,
including hematological, skin, neurological, renal and musculoskeletal
abnormalities. The diagnosis include clinical and/or laboratory criteria.
Lymphomas are solid tumors that are originate in a normal lymphoid tissue,
classically divided into non-Hodgkin or Hodgkin Lymphoma, based on clinicalpathologic finds. The non-Hodgkin Lymphomas, in most cases, have unknown
and multifactorial etiology. The pathophysiology stems from changes in the
immune cells during its different stages of maturation.
They are classified into several subtypes and Extra Nodal Marginal-zone B-cell
Lymphoma (of the mucosa-associated lymphoid tissue (MALT) is one of them.
The clinical manifestations depend on the affected area, and the eye is an
unusual place. Diagnosis is done through biopsy.
Thus, the aim of this study was to describe and compare with the literature, a
patient case accompanied by Department of Rheumatology at Servidor Publico
Municipal Hospital, diagnosed with SLE who developed ocular Extra Nodal
Marginal-zone B-cell non-Hodgkin lymphoma.
At the end of the work, we can verify the relationship between autoimmune
diseases and non-Hodgkin lymphoma.
Keywords = lupus, lymphoma
Sumário
Introdução...............................................................................................pág. 09
Relato de caso .......................................................................................pág. 11
Discussão...............................................................................................pág. 14
Conclusão...............................................................................................pág. 17
Referências bibliográficas.......................................................................pág. 18
INTRODUÇÃO
O Lúpus Eritematoso Sistêmico (LES) é uma doença de causa desconhecida que
pode produzir combinações variáveis de febre, eritema, perda de cabelo, artrite,
pleurite, pericardite, nefrite, anemia, leucopenia, trombocitopenia e doença do
sistema nervoso central. O curso clínico é caracterizado por períodos de remissões e
de recaídas, agudas ou crônicas. Anormalidades imunes características,
especialmente anticorpos a vários antígenos nucleares, desenvolvem-se em
pacientes com LES. O diagnóstico é feito através de critérios clínicos e/ou
laboratoriais (1).
Linfomas são tumores sólidos com origem no tecido linfoide normal, geralmente
nos linfonodos, classicamente divididos em Hodgkin e não-Hodgkin, conforme
os achados clínicos-patológicos.. O linfoma não-Hodgkin (LNH) caracteriza-se
por proliferações clonais das células imunológicas (linfócitos B, T e células
reticulares) em diferentes estágios de maturação e em qualquer parte do corpo
onde estas células sejam encontradas. Os linfomas orbitais geralmente são de
linfócitos B pequenos do tipo MALT (1).
Independente dos esforços em pesquisas nos últimos anos, as causas de
linfoma não- Hodgkin (LNH) ainda são pouco compreendidas (2), embora
houve um aumento dramático na sua incidência pelo mundo todo nas últimas
décadas (3).
Deficiência do sistema imunológico, hereditária ou adquirida, é o fator de risco
mais conhecido, como a infecção pelo HIV ou diversas doenças auto-imunes
como artrite reumatoide (AR), Síndrome de Sjogren (SS) e lúpus eritematoso
sistêmico (4,5,6). Entretanto, embora de forma menos consistente, está
crescendo a evidencia do surgimento de subtipos específicos de LNH em
algumas doenças infecciosas ( 7) e em outras doenças e condições
inflamatórias como Diabetes Mellitus (8,9), psoríase (10,11), sarcoidose(12) ,
anemia hemolítica auto-imune (13), tireoidite de Hashimoto (14),doenças
inflamatórias intestinais como doença de Crohn e retocolite ulcerativa
(15,16,17), esclerose sistêmica(18) e granulomatose de Wegener (19), as quais
também cursam com fenômenos auto-imunes. Na maioria dos casos, o
desenvolvimento destas doenças precede o do linfoma(20).
Estudos investigando associações entre doenças auto-imunes e LNH são
limitados devido a baixa prevalência destas doenças e a raridade dos subtipos
de alguns linfomas ( 21,22,14) .
Entre os subtipos de LNH, a maioria das associações feitas com doenças autoimunes foram observadas para o linfoma de células B tipo amplo difuso, da
zona marginal e subtipos de LNH de células T (22,23).
Este estudo, do tipo relato de caso, desenvolvido em conjunto no Hospital do
Servidor Público Municipal em São Paulo, pelas equipes de Reumatologia,
Hematologia e Oftalmologia, descreve um caso raro de associação entre
Linfoma não-Hodgkin de órbita do tipo células B marginal extra-nodal (MALT) e
Lúpus Eritematoso Sistêmico e o correlaciona com a literatura.
RELATO DO CASO
Paciente do sexo feminino, em outubro de 1999, aos 33 anos, apresentou
quadro de Acidente Vascular Cerebral Isquêmico em topografia de artéria
cerebral média esquerda. Foi submetida à investigação etiológica e o único
diagnóstico constatado foi de Lúpus Eritematoso Sistêmico.
Através de revisão de prontuário, só foram encontrados acompanhamentos da
paciente em nosso hospital a partir de julho de 2003. Nesta ocasião, constava
como critérios para a doença auto-imune citada fotossensibilidade, artrite,
comprometimento hematológico (leucopenia e linfopenia), comprometimento
imunológico( Antifosfolípide Ig G e IgM positivos) e FAN positivo.
Durante a evolução, paciente também apresentou úlcera isquêmica em pé
(janeiro de 2004), vasculite em mãos, palato e orelhas (novembro de 2006),
sendo submetida a pulsoterapia. Com a baixa da imunidade, foi internada por
Herpes-Zolster, principalmente em região de nádegas, em março de 2008. Não
teve acometimento de nenhum outro órgão ou sistema, exceto, ao final deste
mesmo ano, quando começou a relatar nas consultas dor e hiperemia ocular.
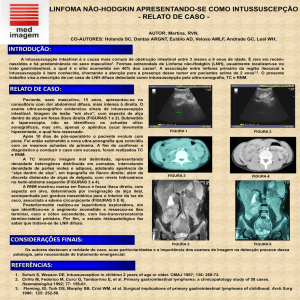
Em março de 2009 passou pela oftalmologia pois apresentava também edema
ocular bilateral, pior a esquerda, diplopia e lacrimejamento (Imagem 1).
Tomografia de órbita evidenciou uma massa extra e intra conal à esquerda, a
qual podia corresponder a um pseudotumor de órbita idiopático (massa
inflamatória) ou a um processo linfoproliferativo (Imagem 2). Realizada biópsia
da lesão cuja imunohistoquímica identificou estrutura folicular associada à lise
folicular intensa, extensão difusa de linfócitos B com moderada atividade
proliferativa, componente plasmocitário com evidências de monoclonalidade
para a cadeia Lambda e expressão difusa de Bcl-2, aspectos estes que ao
serem comparados com a clínica eram consistentes com Linfoma não- Hodgkin
de células B da zona marginal extra-nodal (MALT).
Foi submetida à radioterapia conformacional em dois campos da órbita
esquerda, com dose escalonada total de 3060 Gy (frações diárias de 180 cGy),
no período de dezessete de fevereiro a vinte e cinco de março de 2010.
Evoluiu com resolução do quadro mas em agosto de 2010 iniciou com novo
edema palpebral, agora à direita. Nova tomografia evidenciou proptose
bilateral, predominando a direita, massa de tecidos moles extra-conal,
envolvendo o músculo reto-lateral, sem plano de clivagem e também o globo
ocular parcialmente em sua margem lateral, além de espessamento palpebral
bilateral, maior à direita.
Feita biópsia ocular direita, condizente apenas com processo inflamatório
crônico, sem neoplasias.
Restante da investigação de linfoma em outros sítios sempre negativa.
Paciente sem condições psicológicas de ser submetida à nova biópsia. Pelo
quadro clínico e pelos antecedentes, teve novo ciclo de radioterapia indicado,
pelo alto risco e pelos mesmos aspectos anteriores de linfoma, independente
do resultado do último anatomopatológico.
Figura 1
Figura 2
DISCUSSÃO
Embora os mecanismos que sustentem as associações entre condições autoimunes e o desenvolvimento de linfomas sejam desconhecidos, estudos
recentes indicam que doenças crônicas inflamatórias auto-imunes como
síndrome de Sjögren, lúpus e artrite reumatoide estão associadas à
desregulação e hiper-atividade de células B, representando fatores de risco
para o desenvolvimento de linfomas derivados destas células(24).
Os linfócitos B apresentam funções regulatórias complexas dentro do sistema
imune, além de serem precursores das células secretoras de anticorpos
(25,26). Células tronco linfoides são produzidas pela medula óssea. Elas
amadurecem em células B e T indiferenciadas e se direcionam para os
linfonodos onde são submetidas à exposição antigênica no centro germinativo
dos folículos. As células B se proliferam e sofrem transformações neste centro,
o qual é envolto por uma zona de manto e uma zona marginal. As células B
antígeno específico geradas nestes folículos seguem para regiões mais
periféricas do linfonodo, onde consequentemente ficam as células
plasmocíticas produtoras de imunoglobulinas. A proliferação das células T
ocorre na região paracortical do linfonodo (1).
Mediante a proeminente atividade celular, molecular e genética que ocorre no
centro germinativo, reações neste local são um grande fator de risco para a
ocorrência ou iniciação de transformação maligna da célula B, tanto que a
maioria dos linfomas associados às doenças auto-imunes parece se
desenvolver durante a ativação antigênica ou no estágio subsequente a esta
exposição. Durante as reações no centro germinativo, translocações
cromossomais e/ou mutações de genes regulatórios não-imunoglobulina
podem ocorrer ou se tornar evidentes, levando a desregulação do ciclo celular
e/ou inibindo a apoptose, necessária para a manutenção da homeostasia das
células B (24, 27,28).
Notavelmente, em casos de linfoma não-Hodgkin com origem pós-centro
germinativo, como no linfoma de células B da zona marginal ou no linfoma de
células B amplo difuso não-centro germinativo, a lesão genética primária pode
ter se iniciado durante uma reação no centro germinativo ou reação centro
germinativo-like, levando à expressão de fenótipo maligno no subsequente
estágio de diferenciação após a aquisição de alterações oncogênicas
adicionais. Danos no controle das células T também podem levar ao
desenvolvimento de LNH de células B (29).
Processos afetados se tornam clinicamente aparentes através da presença de
hipergamaglobulinemia, auto-anticorpos circulantes ou locais, complexos
imunes circulantes, formação de tecido linfoide ectópico, linfoproliferação
benigna (30-35) e, eventualmente um risco aumentado dos pacientes
desenvolverem linfomas de células B quando comparado à população geral (5).
Devido aos distintos subtipos de linfoma não-Hodgkin se desenvolverem a
partir de diferentes estágios da diferenciação linfoide e/ou através de diferentes
vias (7,36), vários estudos buscam melhorar o entendimento tanto da base da
desregulação imune da doença quanto da linfogênese.
Em um estudo escandinavo realizado por Smedby et al, Síndrome de Sjögren
primária, lúpus eritematoso sistêmico, doença celíaca e artrite reumatoide
foram apresentadas por serem associadas com linfoma de células B amplo
difuso , o tipo mais comum de linfoma não-Hodgkin na população adulta em
geral, responsável por mais de 40% de todos os tumores linfoides (21).
Lesley et al observaram que as neoplasias de células B mais agressivas como
o amplo difuso estão mais frequentemente associados às doenças auto-imunes
em relação aos linfomas mais indolentes. Observou também que o linfoma da
zona marginal e subtipos de linfomas de células T também estavam associados
a estas doenças (23).
O InterLymph Consortium também investigou a relação entre linfomas e
doenças auto-imunes e observou um aumento do linfoma de células B tipo
amplo difuso e linfoma da zona marginal em pacientes com LES(22).
Smedby et al também notaram algumas evidencias de que os riscos eram
mais altos em indivíduos com inflamação severa (EX: AR) e com longa data de
inflamação (ex: doença celíaca), mas haviam poucas evidências que
sustentassem noções prévias de que o aumento nos riscos de LNH são
associados com os tratamentos médicos nestas condições. Observaram que o
tratamento com drogas anti-inflamatórias não esteroidais , corticoides
sistêmicos ou imunossupressores selecionados foi associado com aumento do
risco de LNH em sujeitos com AR, mas não em sujeitos sem AR (21),
mantendo o questionamento se a relação entre o risco de desenvolvimento de
LNH é devido à atividade e o tempo da doença auto-imune ou ao tratamento
dessa.
Hansen et al não puderam descartar o risco do desenvolvimento de
malignidades em virtude do tratamento com inibidores do fator de necrose
tumoral pois não comprovaram se estes agentes constituem fator potencial
para o surgimento de neoplasias ou apenas sejam indicativos de doença
severa e com risco próprio para os linfomas (29).
Adicionalmente, medicações imunossupressoras usadas no tratamento de
algumas doenças auto-imunes(como por exemplo Metotrexato na AR) podem
causar reativação do vírus Epstein Barr, o qual pode levar ao desenvolvimento
de linfoma, especialmente do tipo célula B amplo difuso Epstein Barr positivo, o
qual assemelha-se a linfomas pós transplante (37), embora alguns estudos
recentes causem dúvida sobre esta hipótese (38,39).
CONCLUSÃO
Muitas condições auto-imunes , especialmente aquelas associadas com
manifestações sistêmicas, foram associadas ao risco de desenvolvimento de
LNH subtipo específico. Os tipos mais associados ao LES foram o linfoma de
células B amplo difuso e o marginal. Estes riscos estão relacionados à
severidade da doença auto-imune, ao estágio no processo de diferenciação da
célula B que foi afetado e talvez também ao tratamento da doença de base. De
qualquer modo, mais estudos que correlacionem o risco de desenvolvimento de
linfoma em pacientes com doenças auto-imunes são necessários para que a
linfogênese destes subtipos de linfoma assim como a relação com o sistema
imune seja melhor compreendida.
REFERÊNCIAS BIBLIOGRÁFICAS:
1- Tratado de Medicina Interna- Cecil. 2005; 2:1937-1947
2- Chiu BC, Weisenburger DD. Na update of epidemiology of Non-Hodgkin’s
lymphoma. Clin Lymphoma 2003; 4:161-8
3- Jaffe ES HN, Stein H, Vardiman JW, eds. Pathology and Genetics of
Tumours of Hematopoietic and Lymphoid Tissues. Lyon, France: IARC Press;
2001
4- Engels EA, Pfeiffer RM, Goedert JJ, Virgo P, McNeel TS, Scoppa SM, Biggar
RJ. Trends in cancer risk among people with AIDS in the United States 19802002. AIDS 2006;20(12):1645–54. [PubMed: 16868446]
5- Zintzaras E, Voulgarelis M, Moutsopoulos HM. The risk of lymphoma
development in autoimmune diseases: a meta-analysis. Arch Intern Med
2005;165(20):2337–44. [PubMed: 16287762]
6- Franklin J, Lunt M, Bunn D, Symmons DP, Silman AJ. Incidence of
lymphoma in a large primary care derived cohort of inflammatory polyarthritis.
Ann Rheum Dis. 2006; 65:617-622
7- Hennessy BT et al. (2004) Non-Hodgkin lymphoma: an update. Lancet
Oncol 5: 341–353
8- Cerhan JR, Wallace RB, Folsom AR, Potter JD, Sellers TA, Zheng W, et al.
Medical history risk factors for non-Hodgkin’s lymphoma in older women. J Natl
Cancer Inst 1997; 89:314-8
9- Hjalgrim H, Frisch M, Ekbom A, Kyvik KO, Melbye M, Green A. Cancer and
diabetes – a follow-up study of two population-based cohorts of diabetic
patients. J Intern Med 1997; 241: 471-5
10- Gelfand JM, Berlin J, Van Voorhees A, Margolis DJ. Lymphoma rates are
low but increased in patients with psoriasis: results from a population-based
cohort study in the United Kingdom. Arch Dermatol. 2003; 139:1425-9
11- Margolis D, Bilker W, Hennessy S, Vittorio C, Santanna J, Strom BL. The
risk of malignancy associated with psoriasis. Arch Dermatol. 2001;137:778-783
12- Askling J, Grunewald J, Eklund A, Hillerdal G, Ekbom A. Increased risk for
cancer following sarcoidosis. Am J Respir Crit Care Med 1999; 160: 1668-72
13- Soderberg KC, Jonsson F, Winqvist O, Hagmar L, Feychting M.
Autoimmune diseases, asthma and risk of haematological malignancies: A
nationwide case-control study in Sweden. Eur J Cancer 2006;42(17):3028–33.
[PubMed: 16945522]
14- Engels EA, Cerhan JR, Linet MS, Cozen W, Colt JS, Davis S, Gridley G,
Severson RK, Hartge P. Immune-related conditions and immune-modulating
medications as risk factors for non-Hodgkin’s lymphoma: a case-control study.
Am J Epidemiol 2005;162(12):1153–61. [PubMed: 16251389]
15- Arseneau KO, Stukenborg GJ, Connors AF Jr, Cominelli F. The incidence of
lymphoid and myeloid malignancies among hospitalized Crohn’s disease
patients. Inflamm Bowel Dis 2001; 7:106-12.
16- Mir-Madjlessi SH, Farmer RG, Easley KA, Beck GJ. Colorectal and extracolonic malignancy in ulcerative colitis. Cancer 1986; 58: 1569-74
17- Askling J, Brandt L, Lapidus A, et al. Risk of haematopoietic cancer in
patients with inflammatory bowel disease. Gut. 2005; 54:617-622
18- Pearson JE, Silman AJ. Risk of cancer in patients with scleroderma. Ann
Rheum Dis 2003; 62: 697-9
19- Knight A, Askling J, Ekbom A. Cancer incidence in a population-based
cohort of patients with Wegener’s granolomatosis. Int J Cancer 2002; 100: 82-5
20- Mackay IR and Rose NR (2001) Autoimmunity and lymphoma: tribulations
of B cells. Nat Immunol 2: 793–795
21- Smedby KE, Hjalgrim H, Askling J, Chang ET, Gregersen H, PorwitMacDonald A, Sundstrom C, Akerman M, Melbye M, Glimelius B, Adami HO.
Autoimmune and chronic inflammatory disorders and risk of non-Hodgkin
lymphoma by subtype. J Natl Cancer Inst 2006;98(1):51–60. [PubMed:
16391371]
22 - Smedby KE, Vajdic CM, Falster MO, Engels EA, Martinez-Maza O, Turner
J, Hjalgrim H, Vineis P, Costantini AS, Bracci PM, Holly EA, Willett E, et al.
Autoimmune disorders and risk of non-Hodgkin lymphoma subtypes: a pooled
analysis within the InterLymph Consortium. Bloob 2008;111(8):4029–38.
23- Anderson LA, Gadalla S, Morton LM, Landgren O, Pfeiffer R, Warren JL,
Berndt SI, Ricker W, Parsons R, Engels EA. Population-based study of
autoimune conditions and the risk of specific lymphoid malignancies. Int J
Cancer. 2009; 125(2): 398-405
24- Landgren O et al. (2006) Autoimmunity and susceptibility to Hodgkin
lymphoma: a populationbased case-control study in Scandinavia. J Natl Cancer
Inst 98: 1321–1330
25- Delves PJ, Roitt IM (2000) The immune system. Second of two parts. N
Engl J Med 343:108–117
26 - Radbruch A et al. (2006) Competence and competition: the challenge of
becoming a long-lived plasma cell. Nat Rev Immunol 6: 741–750
27- Sánchez-Beato M et al. (2003) Cell cycle deregulation in B cell lymphomas.
Blood 101: 1220–1235
28- Isaacson PG, Du MQ (2004) MALT lymphoma: from morphology to
molecules. Nat Rev Cancer 4: 644–653
29- Hansen A, Lipsky PE, Dorner T. B-cell lymphoproliferation in chronic
inflammatory rheumatic diseases. Nat Clin Pract Rheumatol 2007;3(10):561–9.
[PubMed: 17906611]
30- Youinou P et al. (2006) B lymphocytes in the front line of autoimmunity.
Autoimmun Rev 5: 215–221
31- Lipsky PE (2001) Systemic lupus erythematosus: an autoimmune disease
of B cell hyperactivity. Nat Immunol 2: 764–766
32- Dörner T, Lipsky PE (2002) Abnormalities of B cell phenotype,
immunoglobulin gene expression and the emergence of autoimmunity in
Sjögren’s syndrome. Arthritis Res 4: 360–371
33- Fox RI (2005) Sjögren’s syndrome. Lancet 366: 321–331
34- Weyand CM et al. (2005) B cells in rheumatoid synovitis. Arthritis Res Ther
7 (suppl 3): S9–S12
35- Machold KP et al. (2006) Early rheumatoid arthritis. Curr Opin Rheumatol
18: 282–288
36- Weller S et al. (2001) CD40-CD40L independent Ig gene hypermutation
suggests a second B cell diversification pathway in humans. Proc Natl Acad Sci
USA 98: 1166–1170
37- Gottschalk S, Rooney CM, Heslop HE. Post-transplant lymphoproliferative
disorders. Annu Rev Med 2005;56:29–44. [PubMed: 15660500]
38- Smedby KE, Baecklund E, Askling J. Malignant lymphomas in
autoimmunity and inflammation: a review of risks, risk factors, and lymphoma
characteristics. Cancer Epidemiol Biomarkers Prev 2006;15(11):2069–77.
[PubMed: 17119030]
39- King JK, Costenbader KH. Characteristics of patients with systemic lupus
erythematosus (SLE) and non-Hodgkin’s lymphoma (NHL). Clin Rheumatol
2007;26(9):1491–4. [PubMed: 17297594]