INTRODUÇÃO
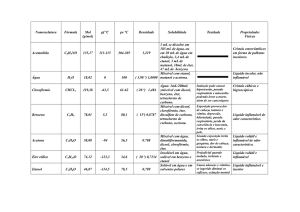
Cristalização: método que permite a obtenção de sólidos bastante puros. Forma-se
o núcleo e então as moléculas são orientadas na rede cristalina de maneira extremamente
seletiva, por isso, a cristalização deve ser lenta.
Precipitação: a formação do núcleo ocorre de maneira rápida, arrastando impurezas
para dentro do cristal.
Nem sempre a cristalização permite obter um composto 100% puro; neste caso,
pode-se fazer uma nova cristalização, ou seja, uma recristalização, que resulta num
produto mais puro, embora com menor rendimento.
Recristalização: é usada desde o tempo dos alquimistas e se mantém até hoje como
o procedimento mais adequado para a purificação de sólidos.
A purificação por recristalização baseia-se no fato de que a maioria dos sólidos é
mais solúvel em um solvente a quente do que a frio.
IMPUREZAS
ESCOLHA DO SOLVENTE
“Semelhante dissolve semelhante”. Esta frase resume o comportamento da
solubilidade de um composto em determinado solvente. A solubilidade depende da
polaridade, capacidade de ionização, formação de pontes de hidrogênio.
Compostos polares ou iônicos: dissolvem-se em água ou em substâncias
igualmente polares (álcoois, ácidos carboxílicos).
R-OH, R-COH, R-CO-R, R-COOH e R-CONH2 }
Álcool, aldeído, cetona, ác. carboxílico e amida } compostos capazes de formar
pontes de hidrogênio: dissolvem-se em solventes hidroxílicos (água, álcoois), com
exceção daqueles cuja parte alquílica da molécula é superior a quatro ou cinco átomos de
carbono.
Compostos apolares: dissolvem-se em éter etílico, benzeno, tolueno, hexano,
ligroína, éter de petróleo e outros solventes não associados.
Características de um bom solvente:
• Dissolver grande quantidade da substância em temperatura elevada e pequena
quantidade em temperatura ambiente ou abaixo dela.
Solubilidade
A
B
C
Temperatura
• Dissolver as impurezas a frio, ou então não dissolvê-las mesmo a quente.
• Não reagir quimicamente com a substância de interesse.
• Permitir boa formação dos cristais.
• Ter ponto de ebulição mais baixo que a substância a ser cristalizada.
• Ser facilmente removido dos cristais purificados na secagem.
• Ser de baixa toxicidade, volatilidade, inflamabilidade e custo.
Caso não haja como substituir um solvente muito volátil, inflamável, tóxico ou caro
recomenda-se usar um condensador de refluxo.
A melhor maneira para escolher o solvente mais adequado é realizar testes
preliminares em tubo de ensaio com os solventes mais comuns, observando a ação do
solvente a frio e à temperatura de ebulição, o volume necessário por grama de amostra e a
formação de cristais durante o resfriamento.
Quando um composto for muito solúvel em um solvente a frio e pouco solúvel em
outro, mesmo a quente, pode-se usar o par de solventes para proceder a recristalização. A
substância a purificar deve ser aquecida com o melhor solvente até a ebulição e adicionar o
pior solvente, gota a gota, até aparecer uma leve turvação, desfeita pela adição de gotas do
melhor solvente.
DISSOLUÇÃO DO SÓLIDO
Para minimizar as perdas do material por solubilização deve-se saturar o solvente
em ebulição com o soluto.
A substância a ser purificada é aquecida, sob agitação, com uma quantidade de
solvente menor que a necessária para solubilizá-la totalmente, até a temperatura de
ebulição. Adiciona-se mais solvente (também na temperatura de ebulição) em pequenas
porções, agitando sempre, até que todo o material tenha se dissolvido.
Soluções supersaturadas provocam a formação de uma espécie de óleo que não
recristaliza quando o solvente esfria. Se isso ocorrer, deve-se tentar dissolver o óleo e
deixar resfriar para tentar a recristalização. No caso da acetanilida, uma concentração maior
que 5,5% pode formar o óleo.
A utilização errônea de um solvente com ponto de ebulição mais baixo que o do
soluto e alguns tipos de impurezas também provocam a formação do óleo.
REMOÇÃO DE IMPUREZAS
Esse procedimento só deve ser usado se permanecer material insolúvel, mesmo a
quente ou se carvão ativo for usado.
•
Impurezas coloridas: geralmente substâncias orgânicas de peso molecular
elevado que conferem cor à substância de interesse. Removidas pela adição de carvão ativo
e posterior filtração.
•
Carvão ativo:
9
As impurezas são adsorvidas na superfície das partículas de
carvão.
9
Deve-se empregar a mínima quantidade possível, visto que
certa quantidade do composto de interesse também é adsorvida,
provocando perdas.
9
Quantidade: 1 a 2% da massa da amostra. Se não for
suficiente adicionar mais 0,5% até que as impurezas sejam removidas.
9
Se adicionado em porções é necessária uma quantidade
menor.
9
Não deve ser adicionado sobre a solução em ebulição, pois
provoca grande agitação da solução, podendo haver perda por
derramamento.
9
Cuidado para não aspirar. O pó fino faz mal aos pulmões.
•
Impurezas insolúveis: substâncias que permanecem insolúveis mesmo na
temperatura de ebulição do solvente. Removidos por decantação, filtração ou pipeta
filtrante.
•
Decantação:
9
É o método mais simples.
9
As partículas assentam facilmente no fundo do frasco.
9
O sobrenadante é vertido em outro frasco, deixando o sólido.
9
Pipeta pré-aquecida (para evitar cristalização nas paredes da
pipeta) pode ser usada para remover a solução quente.
•
Pipeta filtrante:
9
Usada se o volume da solução for menor que 10mL.
9
É necessário adicionar um excesso de solvente que
posteriormente é removido por evaporação até que a solução volte a ficar
saturada, para evitar a cristalização.
•
Filtração a quente:
9
Preferida quando carvão ativo é usado.
9
A solução deve ser levada à ebulição antes da filtração.
9
Funil de haste curta e papel de filtro pregueado devem ser
previamente aquecidos.
9
A operação deve ser rápida.
9
Se houver formação de alguns cristais durante a filtração, uma
quantidade mínima de solvente em ebulição é adicionada para
redissolvê-los. O excesso de solvente é eliminado por evaporação.