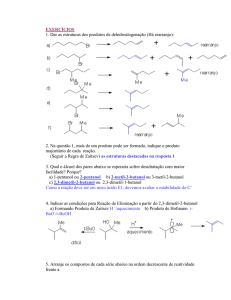
Ministério da Educação
Universidade Tecnológica Federal do Paraná
Campus de Curitiba
Gerência de Ensino e Pesquisa
Departamento Acadêmico de Química e Biologia
Disciplina: Mecanismos de Reações Orgânicas 1 – QB52C-N61
Bibliografia
Vollhardt, K. P. C., Schore, N. E., Química Orgânica – Estrutura e Função. 4a
Ed., 2004.
Bruice, P. Y., Organic Chemistry, 4ª Ed., Prentice Hall, 2003.
Solomons, T.W., Fryhle, C. B. Organic Chemistry, 8a Ed. (2004).
Carey, F.A., Organic Chemistry, 4ª Ed., McGraw-Hill, New York, 2000.
Morrinson, R. Boyd, R., Química Orgânica, 13a Ed., Calouste Gulbenkian, Lisboa, 1996.
Allinger,N.L., Cava, M.P., Química Orgânica, 2a Ed., Guanabara Dois, Rio de Janeiro, 1978
Sykes, P., A Guidebook to Mechanism in Organic Chemistry, John Wiley & Sons, New York, 1993.
McMurry, Organic Chemistry, 5ª Ed., Brookscole, 1999;
Tópicos que serão estudados
Relação entre a Estrutura e a Reatividade de Compostos Orgânicos
Estabilidade e reatividade de Intermediários Orgânicos
Substituição Alifática Nucleofílica
Reações de Substituição SN1 e SN2
Reações de Eliminação E1 e E2
Substituição Nucleofílica e Eletrofílica em Sistemas Aromáticos
Homólise e Heterólise de ligações covalentes
A ligação covalente pode ser quebrada de duas maneiras diferentes.
Quebra Homolítica (Grego: Homo = igual; lise = perca ou clivagem): É a quebra de uma
ligação covalente na qual ambos os fragmentos saem com um elétron da ligação. Ocorre a
geração de radicais.
Quebra Heterolítica (Grego: Hetero = diferente; lise = perca ou clivagem): É a quebra de
uma ligação covalente onde os dois elétrons da ligação vão para o mesmo fragmento.
Ocorre à formação de íons positivos e negativos
Heterólise de Ligações envolvendo um Carbono
Formação de Carbocátions e Carbânions
A Heterólise de uma ligação contendo um carbono pode gerar dois tipos de íons. Os com
carga positiva (carbocátions) e os com carga negativa (carbânions).
Os radicais livres, os carbocátions e os carbânions são:
Espécies altamente reativas.
Atuam como intermediários transitórios em reações orgânicas.
Os cátions de carbono são chamados de carbocátions
Os ânions de carbono são chamados de carbânions.
Os radicais livres e os carbocátions são espécies deficientes em elétrons.
Os carbânions são espécies ricas em elétrons.
O que são eletrófilos?
São reagentes que procuram elétrons, ou seja, gostam de elétrons.
O que são nucleófilos? São reagentes que procuram prótons ou centros positivos.
Qual é a definição para ácidos de Lewis?
São espécies capazes de receber um par
de elétrons
Qual é a definição para bases de Lewis?
São espécies capazes de doar um par de
elétrons
Os ácidos de Lewis são eletrófilos ou nucleófilos?
Os ácidos de Lewis são eletrófilos, ou seja, procuram elétrons
As bases de Lewis são eletrófilos ou nucleófilos?
As bases de Lewis são nucleófilos, ou seja, doam elétrons para um núcleo.
Estrutura do CH4, CH3+, CH3- e .CH3
Metano (CH4)
Carbocátion de metila (CH3+) Hibridização sp2
Configuração eletrônica igual a do boro: 6C+ 1s2 2s2 2p1
Os carbocátions: Evidências experimentais indicam que a estrutura dos carbocátions é trigonal plana.
Está estrutura pode ser explicada com base na hibridização de orbitais. O carbono central possui
hibridização sp2, é deficiente em elétrons, com seis elétrons no seu nível de energia mais externo. Estes
seis elétrons formam as ligações covalentes com os hidrogênios (ou com os grupos alquila), do tipo sigma
(σ). O orbital p não contém elétrons.
Radical de metila (CH3.) Hibridização sp2
Os radicais: Evidências experimentais indicam que a estrutura dos radicais é trigonal plana. Esta estrutura
pode ser alterada para pirâmidal se os grupos que estão ligados ao carbono central forem volumosos. O
carbono central possui hibridização sp2. Entretanto, o orbital p não está vazio, mas contém um elétron
desemparelhado.
Carbânion de metila (CH3:-) Hibridização sp3
Os carbânions: Evidências experimentais indicam que a estrutura dos carbânions é piramidal. O carbono
central possui hibridização sp3. Está estrutura lembra a estrutura da amina (NH3), só que com carga.
Energias de Dissociação das Ligações e Estabilidades Relativas dos Radicais Livres
As energias de dissociação das ligações permitem avaliar as estabilidades
relativas dos radicais livres. Os radicais livres são classificados como terciários (3º),
secundários (2º), primários (1º) e de metila, com base na natureza do carbono que
apresenta o elétron desemparelhado.
Qual é a ordem de estabilidade destes radicais?
A Estabilidade dos Carbocátions
As estabilidades relativas dos carbocátions são paralelas às dos radicais
livres. A ordem geral de estabilidade é:
Como justificar esta ordem de estabilidade?
Esta ordem de estabilidade dos carbocátions está relacionada com o Efeito
Indutivo (possibilidade de dispersão da carga positiva) e com o Efeito Hiperconjugativo.
Efeito Indutivo - Dispersão da Carga Positiva:
Quanto maior o número de grupos alquilas ligados ao carbono positivo, maior será a
dispersão desta carga.
Os grupos alquila adquirem parte da carga positiva e estabilizam o carbocátion.
A ordem de estabilidade dos carbocátions é paralela ao número de grupos metila (alquila)
presentes.
Os carbonos com hibridização sp2 são mais eletronegativos que os com hibridização sp3.
Efeito Hiperconjugativo: Representação Completa
H
C
+
H
H
C
H
+
H
C
H
H
H
H
H
C
H
C
H
H
+
H
H
H
C
H
C
+
C
H
H
C
H
H
H
C
H
H
Quanto maior o número de metilas ligadas ao carbono carregado positivamente
(carbocátion) maior será a interação do orbital p do carbocátion com o orbital sp3 da ligação
C-H da metila. Está interação favorece a distribuição da carga positiva.
H
H
H
C
H
+
H
H
H
δ+
carbocátion de metila
C
H
δ+
C
ário
1
δ+
H
H
+C
δ
H
H
C
H
H
+
δ+
2
ário
C
δ+
H
H
H
δ+
H
H
C
H
δ+
C
H
C
+
C
δ+
H
δ+
H
H
3 ário
Quanto mais distribuída a carga positiva, mais estável é o carbocátion
A estabilização resulta da indução ou da hiperconjugação?
Resposta: Ambos são importantes, e como os dois efeitos funcionam na mesma direção. A
teoria nos diz que eles devem ter mais ou menos a mesma importância.
Comparação da Acidez dos compostos CH4, NH3, H2O e HF.
Estes compostos possuem em comum um elemento da mesma linha da Tabela Periódica.
Sabendo que a eletronegatividade aumenta da esquerda para a direita.
Qual é a ordem de Acidez dos compostos CH4, NH3, H2O e HF?
Comparação da Acidez dos compostos HF, HCl, HBr e HI, Qual é mais Ácido?
Tipos de Reações Orgânicas
As Reações de Substituição Nucleofílica e de Eliminação em Carbonos Saturados
Exemplo Geral
As reações de Substituição e de Eliminação ocorrem geralmente ao mesmo tempo.
Começando pelas Reações de Substituição Nucleofílicas
Tipos de Reações de Substituição Nucleofílica
As reações de substituição ocorrem porque o grupo abandonador (geralmente
halogênios) é mais eletronegativo que o carbono, deixando este mais deficiente em
elétrons.
A Molecularidade e Cinética das Reações de Substituição Nucleofílica
O que é Molecularidade de uma reação?
É o número de moléculas ou íons que participam do estado de transição da etapa
determinante da velocidade (etapa lenta).
O que é uma Reação Unimolecular?
É a reação em que somente uma espécie (molécula ou íon) está envolvida no estado de
transição da etapa determinante da velocidade (etapa lenta).
O que é uma Reação Bimolecular?
É a reação em que duas espécie (molécula ou íon) estão envolvidas no estado de
transição da etapa determinante da velocidade (etapa lenta).
O que é um Estudo Cinético?
É o estudo da medida da variação da velocidade de uma reação quando se varia a
concentração de cada reagente. A cinética determina a molecularidade de uma reação
química.
A velocidade da reação será igual:
A velocidade na qual o reagente Nu:-, ou R-L, desaparece da mistura ou,
A velocidade na qual L:-, ou Nu-R, se forma na mistura produto.
Pode-se medir a velocidade do desaparecimento dos íons haletos por sua
precipitação com nitrato de prata e pesando o precipitado.
Pode-se medir a velocidade de desaparecimento dos íons hidróxido,
titulando as amostras com ácido.
Pode-se seguir a velocidade de muitas reações espectroscopicamente.
Reação Bimolecular
A Reação é Bimolecular se a velocidade de reação é diretamente proporcional à
concentração do Nu:- e do R-L. Portanto, o Nu:- e o R-L estão envolvidos no estado de
transição da etapa determinante da velocidade.
Pode-se representar esta proporcionalidade por uma equação da velocidade:
ou
k (Constante da velocidade).
A equação da velocidade é de primeira ordem em relação ao [Nu:-] e ao [R-L].
Mas globalmente é de segunda ordem porque depende de duas concentrações.
Reação SN2 - Exemplo
Observou-se que se dobrando a concentração do cloreto de etila e se mantendo
a concentração do íon hidróxido constante a velocidade da reação é dobrada. Observou-se
também que se dobrando a concentração do íon hidróxido, enquanto se mantém constante
a concentração do cloreto de etila, a velocidade é dobrada. E, finalmente que se dobrando
simultaneamente as duas concentrações (do íon hidróxido e do cloreto de etila) a
velocidade quadruplica.
A expressão da velocidade para esta reação é de segunda ordem.
O estado de transição para a etapa determinante da velocidade da reação depende
tanto da concentração do cloreto de etila quanto da concentração do íon hidróxido e que
esta reação é bimolecular.
Chama-se este tipo de reação de uma reação SN2 que significa Substituição
Nucleofílica Bimolecular.
Mecanismo:
3 átomos de hidrogênio estão no mesmo plano
A energia de ativação
para a reação SN2 de um
haleto
de
alquila
secundário é maior do
que para um primário
devido ao efeito estérico.
Tipos de Compostos que podem ser obtidos a partir das reações SN2
A Estereoquímica e os Mecanismos das Reações SN2
A reação SN2 ocorre com inversão de configuração do carbono que sofre a
substituição, quando este carbono for quiral.
Exemplos: 2-bromo-octano e o álcool 2-octanol apresentam pares de enantiômeros.
C6H13
H
C
CH3
C 6H13
C6H13
Br
Br
C
CH3
H
H
C
CH3
C6H13
OH
HO
C
CH3
H
Exemplos de Reação que ocorre com inversão de configuração (SN2).
C6H13
H
C
C6H13
HO
Br
CH3
Mecanismo:
HO-
C
CH3
C6H13
H
Br
H
CH3
C6H13
H
C
δ−
HO
−
C
CH3
δ
Br
C6H13
HO
C
H
+ Br
CH3
O nucleófilo aborda o carbono que sustenta o grupo abandonador por trás, isto é, do lado diretamente
oposto ao grupo abandonador.
A configuração do átomo de carbono se inverte da mesma maneira que uma sombrinha se inverte
quando é apanhada por um vento forte.
O estado de transição é aquele em que o nucleófilo e o grupo abandonador estão parcialmente
ligados ao carbono que sofre a inversão.
Uma vez que este estado de transição envolve tanto o nucleófilo quanto o substrato, este mecanismo
explica a cinética de segunda ordem da reação observada.
A Reação SN1 - Exemplo
CH3
H3C C Br
CH3
+
CH3
H2 O
H3C C OH +
Br
_
+
+ H3 O
CH3
O estudo cinética da reação do brometo de terc-butila com água mostrou que a velocidade de
reação é de primeira ordem, ou seja, só depende da concentração do brometo de terc-butila.
Quando se dobra a concentração do brometo de terc-butila, observa-se que a velocidade da reação
dobra. Mas, quando se dobra, ou mesmo triplica, a quantidade de água a velocidade da reação não se
altera.
Portanto, o brometo de terc-butila é a única espécie que está envolvida no estado de transição da
etapa que define a velocidade.
Esta reação é Unimolecular. Chama-se este tipo de reação de reação SN1 (Substituição
Nucleofílica Unimolecular).
Mecanismo:
vídeo
O que é Solvólise?
É uma reação em que o nucleófilo é uma molécula do solvente.
Solvólise (Grego: Solvó = solvente; lise = quebra ou clivagem). Quebra pelo solvente.
A Estereoquímica e os Mecanismos das Reações SN1
A reação seguinte depende somente da concentração do 3-bromo-3-metil-hexano. Portanto a
velocidade da reação é de primeira ordem. Neste caso ocorre a Racemização Total.
Mecanismo: Primeira Etapa (Lenta)
Segunda Etapa (Rápida)
Por que é importante saber a estereoquímica de uma substância quiral?
Talidomida (Desenvolvido na Alemanha, em 1954)
É uma substância usualmente utilizada como medicamento sedativo, antiinflamatório e hipnótico (induz o sono). Devido a seus efeitos teratogênicos
(anomalias), tal substância deve ser evitada durante a gravidez, pois causa
malformação ou ausência de membros no feto.
A talidomida é um derivado do ácido glutâmico e estruturalmente contém dois
anéis amida e um único centro quiral. Este composto existe na forma de mistura
equivalente dos enantiômeros S e R que se interconvertem rapidamente em condições
fisiológicas. O enantiômero S está relacionado com os efeitos teratogênicos da talidomida
enquanto que o enantiômero R é responsável pelas propriedades sedativas da mesma.
Fatores que Afetam as Velocidades das Reações SN1 E SN2
Os fatores mais importantes são:
1. A estrutura do carbono que sustenta o grupo abandonador.
2. O Efeito eletrônico (Indutivo)
3. A concentração do nucleófilo.
4. A reatividade do nucleófilo (só para reações bimoleculares).
5. A polaridade e a natureza do solvente.
6. O tamanho do nucleófilo:
7. A natureza do grupo abandonador.
1. A estrutura do carbono que sustenta o grupo abandonador.
Os haletos de alquila simples apresentam a seguinte ordem geral de reatividade nas
reações SN2.
Os haletos alílicos e benzílicos simples são geralmente mais reativos do que os
haletos primários ou mesmo do que os haletos de metila em reações SN2.
Os haletos de neopentila, apesar de serem haletos primários são pouco reativos em
reações SN2.
A diminuição na reatividade para as reações SN2 é principalmente decorrente dos
efeitos estéricos. Os substituintes volumosos ligados ao carbono ou próximo dele têm um
efeito inibidor na reação SN2. O aumento do efeito estérico favorece o mecanismo SN1.
Vídeo 1
2 – Efeito Eletrônico (Indutivo)
O Fator Eletrônico (Indutivo) é o fator mais importante na determinação da reatividade
dos substratos orgânicos, numa reação SN1.
Os únicos compostos orgânicos que sofrem reação por um caminho SN1 são aqueles
que são capazes de formar carbocátions relativamente estáveis.
As reações SN1 estão limitadas a compostos tais como: carbonos terciário, alílico,
benzílico ou algum outro grupo estabilizador.
Regra Geral de Reações SN2 e SN1
Os substratos alílicos e benzílicos substituídos bloqueiam acentuadamente a
aproximação do nucleófilo, reagindo somente através de um mecanismo SN1.
Comparação entre as reações SN2 e SN1.
SN2
SN1
Mecanismo em uma única etapa
Mecanismo em várias etapas
É uma reação Bimolecular
É uma reação Unimolecular
Não ocorre rearranjo de carbocátion
Ocorre rearranjo de carbocátion
O produto apresenta a configuração
O produto apresenta uma
invertida com relação ao reagente
configuração invertida e outra retida
com relação ao reagente
Ordem de reatividade
Ordem de reatividade
3 - O Efeito da Concentração do Nucleófilo
As velocidades das reações SN1 não são afetadas pela concentração do nucleófilo.
As velocidades das reações SN2 dependem de ambos.
4 - O Efeito da Força do Nucleófilo
Tipos de Nucleófilos
Nucleófilo forte: Reage rapidamente com o substrato
Nucleófilo fraco: Reage lentamente com o substrato.
Força dos Nucleófilos. Afeta o mecanismo e a velocidade das reações SN2 e SN1.
Nucleófilos fortes favorecem o mecanismo SN2 e os Nucleófilos fracos favorecem o
mecanismo SN1 quando existe a possibilidade de formação de um carbocátion estável.
Um nucleófilo carregado negativamente é sempre mais forte do que o seu ácido conjugado.
Exemplos:
OH- é um nucleófilo mais forte do que o H2O
RO- é mais forte do que ROH.
Qual reação é mais rápida?
+ Cl
CH3Cl
+ HO
CH3OH
CH3Cl
+ H2O
CH3OH2
CH3Cl
+ H2N -
CH3NH2
CH3Cl
+ H3N
CH3NH3
+
+ Cl
+
Rápido
SN2
Muito Lento
+ Cl -
Muito Rápido
+ Cl -
Mais Lento
SN2
Em um grupo de nucleófilos no qual o átomo nucleofílico é o mesmo, a
nucleofilicidade é paralela à basicidade. Exemplo para compostos oxigenados:
Está é a ordem de reatividade e de basicidade.
H3O+
pKa
-1,7
CH3OH2+ CH3COOH
4,8
-2,5
H2O CH3OH CH3CH2OH
16,0
15,7
16
ArOH
10,0
A nucleofilicidade decresce da esquerda para a direita na Tabela Periódica.
Exemplo:
CH3CH2Br
+
H3N
CH3CH2NH3+
CH3CH2Br
+
H2O
CH3CH2OH2
+
+
Br
-
+
Br
-
Rápido
Muito Lento
Tipos de Solventes
Solventes próticos: têm um hidrogênio ligado a um átomo fortemente eletronegativo
(oxigênio, nitrogênio, etc.). Exemplos: H2O, CH3CH2OH, CH3OH, NH3, etc.
Solventes apróticos: Não têm um hidrogênio ligado a um elemento fortemente
eletronegativo. Exemplos: Benzeno, alcanos, DMSO, DMA, DMF, etc.
Exceções:
Para compostos que tem em comum átomos de um mesmo grupo da tabela
periódica, em solventes próticos (água, etanol, etc.) a força do nucleófilo não é paralela à
sua basicidade, mas sim ao seu tamanho.
Em solventes próticos, o nucleófilo (que tem em comum átomos de um mesmo
grupo da tabela periódica) mais forte é o nucleófilo maior. Isto se deve ao Efeito da
Solvatação.
Os tióis (R-SH) são nucleófilos mais fortes do que os álcoois (R-OH)
Os íons RS- são nucleófilos mais fortes do que os íons RO-.
Os íons haletos mostram a seguinte ordem:
H
O Efeito da Solvatação nos Nucleófilos Pequenos. O
Os ânions menores são mais solvatados por
solventes próticos porque possuem a carga negativa mais
concentrada.
Quanto menor o ânion mais forte é a Ligação de
hidrogênio, consequentemente maior será o efeito da
solvatação.
H
H
O
H
.. :X
..:
H
O
H
H
O
H
Ânion cloreto em água (Solvente Prótico)
CH3CH2OH (pKa=16,0)
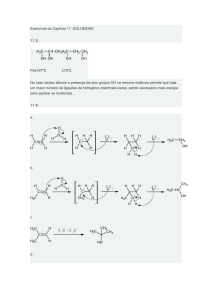
MECANISMO SN1
MECANISMO SN2
CH3CH2SH (pKa=10,5)
5 - O Efeito da Polaridade e da Natureza do Solvente
Polaridade do Solvente
Os solventes polares solvatam e estabilizam mais os íons do que os solventes não-polares.
Constante dielétrica
Quanto maior a constante dielétrica, maior será a polaridade do solvente e
maior será a sua capacidade para solvatar os íons. A constante dielétrica é a habilidade
de separar cargas.
O Efeito do Solvente na velocidade das Reações SN2
As reações SN2 aumentam a velocidade de reação, em solventes apróticos
altamente polares porque os ânions não são solvatados.
.
A Reação SN1 será favorecida por um nucleófilo fraco em um solvente polar prótico.
6 - O Tamanho do Nucleófilo:
Os nucleófilos Estericamente Impedidos são menos reativos. Exemplo:
Entre os ânions etóxido e terc-butóxido, qual é a base mais forte? e qual é o melhor nucleófilo?
A base mais forte é o terc-butóxido porque ele doa o par de elétrons com maior facilidade.
O melhor nucleófilo é o etóxido porque ele é menor e menos impedido estericamente.
7 - A Natureza do Grupo Abandonador
Os melhores grupos abandonadores são aqueles que produzem as moléculas ou íons
mais estáveis, depois de sua separação.
Quanto menos básico é o grupo, mais facilmente ele se desliga do carbono.
Exemplo: A água é um grupo abandonador melhor do que o íon hidróxido.
Os
álcoois
não reagem com íons haleto em
meio neutro, porque, sob estas
condições, o grupo abandonador
seria
um
álcoois,
íon
hidróxido.
entretanto,
Os
reagem
facilmente com os íons haleto em
meio ácido. Em meio ácido o
grupo abandonador é a água.
Para os halogênios, a ordem do melhor grupo abandonador é inversa a da
basicidade, ou seja, quanto menos básico melhor é o grupo abandonador:
I- > Br- > Cl- > F-
Outros Bons Grupos Abandonadores
A reação SN1 é favorecida por melhores grupos de saída (Ver estado de transição),
mas deve existir a possibilidade de gerar um carbocátion estável e o solvente ser prótico.
Qual reação ocorrerá pelo mecanismo SN2?
CH3
C
CH3
..
.. _
Br : + CH3S :
..
..
Propano (acetona)
CH3SNa / CH3SH
..
CH3S
..
C
.. _
:
+ : Br
..
CH3
H
H
CH3
C
CH3
CH3
H
O
O S CF3
O
CH3
H2O
C
CH3
H
O
OH
+
H O S CF3
O
As reações SN1 ocorrem geralmente quando o solvente prótico é o nucleófilo
Qual reação ocorrerá pelo mecanismo SN2?
Quanto mais forte for o nucleófilo, mais favorecida será o mecanismo SN2
Esta reação pode ocorrer por um mecanismo SN1 porque o nucleófilo é fraco, o
solvente é prótico e principalmente porque o cátion benzílico (cátion primário) é
estabilizado por ressonância.
etanol
2-bromobutano + etóxido de sódio
CH3CH2
.. ._
O.
..
H
+
CH3CH2
CH3CH2 H
Br
C
S
Qual é o mecanismo? O que será formado?
δ−
CH3CH2O
δ−
Br
C
CH3
CH3
Qual é o mecanismo? O que será formado?
H
H
CH3CH2
S
C
CH3
Br
H
H
C
CH3CH2
+
C
CH2CH3 + Br-
R
CH3
2-bromobutano + H2O
H
CH3CH2O
CH3
+
-
Br
+
H
..O..
CH3CH2
H
H
H
H
CH3CH2
H
CH3
C
O
R
+
H
CH3CH2
CH3
C
+O
+
CH3CH2
H
O
H
C
S
+
CH3
H
H
O+
H
+
H
O
C
+
CH3
H
..O..
H