184
REB Volume 6 (2): 184-204, 2013
ISSN 1983-7682
APLICAÇÃO DE MICRORGANISMOS DISPONIBILIZADORES DE
FOSFATO IMOBILIZADOS EM ALGINATO DE CÁLCIO NA
AGRICULTURA
APPLICATION OF PHOSPHATE ENABLING MICROORGANISMS
IMMOBILIZED IN CALCIUM ALGINATE ON AGRICULTURE
Sabrina Moro Villela Pacheco1; Felipe Damasio2
2Mestre em Ensino de Física pela Universidade Federal de Rio Grande do Sul e professor do Centro Federal de
Educação Tecnológica de Santa Catarina - Campus Araranguá
[email protected]
[email protected]
Resumo
Com o crescente aumento da população mundial e consequente aumento da demanda de
alimentos, a agricultura já ocupou mais de um quarto da superfície do planeta. No
entanto, o aumento de produtividade torna-se abalado devido aos vários processos de
degradação que os solos vêm sofrendo, como erosão, salinização, poluição e etc. Dessa
forma, visando sanar esses problemas, algumas medidas têm sido adotadas, como a
implantação de programas racionais de adubação. Grande parte dos solos é deficiente
em fósforo, um elemento essencial para as plantas e para suprir essa deficiência, é
adicionado aos solos, fertilizantes fosfatados, onde os mais comuns são os
superfosfatos. No entanto, até 90% do fósforo adicionado no solo, é convertido a formas
não disponíveis para a planta. A aplicação de inóculos de microrganismos que auxiliam
a planta na absorção do fósforo na agricultura tem se mostrado uma atraente alternativa
para o melhor aproveitamento desse elemento. Além disso, alguns estudos têm revelado
que quando esses microrganismos estão imobilizados em algum material polimérico,
185
como alginato de cálcio, eles passam a adquirir várias vantagens em relação aos
microrganismos livres.
Palavras-chave: Fósforo, disponibilização, microrganismos, agricultura, alginato de
cálcio, imobilização.
Abstract
With the increasing world population and increase in food demand, agriculture has held
more than a quarter of the planet's surface. However, increased productivity becomes
shaken due to various degradation processes that have suffered soils, such as erosion,
salinization and pollution. To remedy these problems, some measures have been
adopted, such as the deployment of rational fertilization programs. Much of the soil is
deficient in phosphorus, an essential element for plants and to supply this deficiency, is
added to soil, phosphate fertilizers, which are the most common Superphosphates.
However, up to 90% of phosphorus added in the soil is converted to forms that are not
available to the plant. The application of microbial inoculants that help the plant uptake
of phosphorus in agriculture has become an attractive alternative for the best use of this
element. In addition, some studies have shown that when these microorganisms are
immobilized on a polymeric material such as alginate, they begin to acquire several
advantages over the free microorganisms.
Key Words: Phosphorus, availability, microorganisms, agriculture, calcium alginate
immobilization.
INTRODUÇÃO
A população mundial já ultrapassou a marca dos sete bilhões, sem sinais de
estabilização, embora o ritmo de crescimento tenha diminuído em relação às previsões
feitas há alguns anos (UNITED STATES, 2012). Apenar para se ter uma ideia do
impacto do contingente populacional, em 2000, ano no qual a população já era de mais
mais de seis bilhões, a agricultura tomava mais uma de um quarto da superfície do
planeta, para promover alimentação e conforto para tanta gente. Vale a pena lembrar
que deste total de áreas agrícolas, apenas, três quartos eram solos de baixa fertilidade e
metade localizavam-se em terrenos acidentados, com baixa produtividade (JOHN,
186
2000). Além disso, cabe ressaltar que desde esta época até os dias atuais a agricultura
atual vem enfrentando problemas como o empobrecimento das terras devido a vários
processos de degradação, como: erosão, salinização, poluição ou degradação biológica,
intensificados nos últimos anos. Assim, a manutenção e a restauração da fertilidade do
solo por meio de um plano racional de adubações devem fazer parte de qualquer
programa de atividade agrícola.
A adubação com fosfatos solúveis é utilizada em larga escala pelos agricultores,
onerando os custos, entretanto, a maior parte destes fertilizantes é convertida a formas
insolúveis e consequentemente indisponíveis aos vegetais (NARLOCH, 2002). Desde a
década de 30, é conhecido o fato de que, em presença de matéria orgânica, os fosfatos
insolúveis do solo tendem a tornar-se disponíveis, provavelmente por atividade
microbiana. Consequentemente, vários tipos de microrganismos (de vida livre e os que
formam associações mutualísticas com as plantas), vêm sendo isolados do solo, tendo
sua importância comprovada na solubilização de formas de fosfatos indisponíveis para
as plantas (BRANCO et al, 2001)( BARROW et al 2002). Vários estudos vêm sendo
realizados para a aplicação de uma quantidade adicional de microrganismos
disponibilizadores de fósforo no solo para auxiliar a planta na absorção deste nutriente e
conseqüentemente, minimizar os custos com fertilizantes (MARCOS et al, 1996)
(NARLOCH, 2002) (MIYASAKA et al 2003) (SIQUEIRA et al 1998) (CARNEITO at
al 1999) (VASSILEV et al 1997) (RUBIO at al 2003) (KAPOOR et al 2004).
A importância do fósforo para as plantas
O fósforo é o elemento que mais frequentemente limita o crescimento vegetal.
Faz parte da estrutura de moléculas orgânicas como os nucleotídeos, os ácidos nucléicos
e os fosfolipídios presentes em todas as membranas, além de estar envolvido na
conservação e transferência de energia nas células, (substâncias como ATP, ADP, PPi,
GTP, fosfocreatina) podem ser hidrolisadas, liberando grandes quantidades de energia
que tornam-se, então, disponíveis para a atividade metabólica da planta. O fósforo
também desempenha funções importantes no metabolismo do carbono, via participação
na formação de poder redutor (NADPH) usado na redução do CO2, formação de
açúcares fosfatados e, em adição, afeta significativamente a exportação de açúcares dos
cloroplastos, aumentando a razão amido/sacarose quando ele está em deficiência
187
(CARDOSO et al, 1992). A deficiência de fósforo está associada a um menor
crescimento e baixo teor de glicídios de reserva nas plantas. As folhas mais velhas
ficam verdes escuras ou avermelhadas, devido à acumulação de antocianinas (Figura 1).
Figura 1: Sintomas da deficiência de fósforo; À direita: a folha com deficiência de P e
à esquerda: a folha sadia (MATTA, 2004).
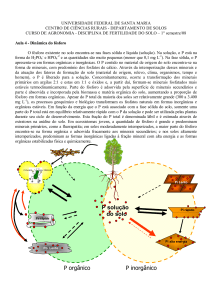
O comportamento do fósforo no solo
Estima-se que o conteúdo de fósforo no solo oscila entre 500 e 2500 kg/ ha, dos
quais cerca de 15 a 70% se encontram fortemente adsorvidos ou em formas inorgânicos
insolúveis, sendo o restante de natureza orgânica, sobretudo provindo de
microrganismos (CORREIA, 1980). A disponibilidade do fósforo no solo está
relacionada às transformações químicas, físicas e biológicas desse elemento. O fósforo
entra na biosfera com a adição de fertilizantes, por exemplo, e ao ser absorvido pelas
plantas e microrganismos, retorna ao solo, após decomposição da matéria orgânica
proveniente dos mesmos. Dessa forma, é a atividade microbiana, a principal responsável
pela manutenção do ciclo do fósforo (figura 2) (CARDOSO et al, 1992)(MATTA,
2004). O fósforo é geralmente encontrado nos solos na forma de fosfato tricálcico
(Ca3(PO4)2), praticamente insolúvel e indisponível para as plantas. Além disso, pode
ocorrer na forma de compostos orgânicos fosforados e, finalmente na forma de mineral
solúvel. Entretanto nesta última forma ele é muito instável, dificilmente permanecendo
em condições de ser assimilado. Essa tendência à indisponibilidade é devido a processos
de fixação que ocorrem de diferentes maneiras: formação de compostos com cálcio
188
passagem, por exemplo, da forma de fosfato monocálcico, ou “superfosfato”, que é a
mais solúvel de todas para formas de fosfato bicálcico, pouco solúvel, ou tricálcico que
é a forma menos solúvel de todas; a precipitação pelo ferro, alumínio ou manganês,
formando compostos insolúveis; adsorção pelas argilas ou pelos hidróxidos de alumínio
ou ferro; formação de compostos orgânicos que, embora não possam ser diretamente
assimilados pelas plantas, apresentam a possibilidade de ser lentamente mineralizados e
assim, suprir as necessidades dos vegetais (BRANCO et al, 2001).
Figura 2: Ciclo do fósforo no solo (adaptado de NARLOCH, 2002).
O fósforo orgânico dos solos provém, sobretudo da autólise e decomposição da
vegetação natural e em muito menor parte dos resíduos de origem animal. Os principais
produtos orgânicos fosforados do solo são os inositol-fosfatos, os fosfolipídios, ácidos
nucléicos e seus derivados e os glúcidos fosforilados, sendo, no entanto os primeiros, os
principais constituintes da matéria orgânica do solo. Admite-se que, a proveniência dos
produtos orgânicos fosforados do solo seja, sobretudo, oriunda de microorganismos do
solo e da mesofauna. Além disso, a mineralização e a imobilização do fósforo realizada
pela atividade microbiana serem extraordinariamente importantes no ciclo geral do
fósforo na natureza (Figura 2) (CORREIA, 1980) (CARDOSO et al, 1992) (PAUL et al
1988).
4) Formas disponíveis de fósforo para as plantas
A maior proporção de fósforo no solo está fixada em formas que a planta não
189
aproveita diretamente como fosfatos de ferro e alumínio, que são as mais abundantes
nos solos ácidos das regiões subtropicais e tropicais. Uma fração muito pequena é
disponível para raízes, por se encontrar no solo ou fracamente adsorvida no complexo
coloidal (argila e matéria orgânica) (FREDERICK, 1989). Quando se aplicam
fertilizantes solúveis nos solos, como os superfosfatos, por exemplo, os íons fosfatos
são inicialmente liberados no solo e ficam em equilíbrio com a fração lábil, que repõe o
fósforo à medida que ele vai sendo utilizado pelas plantas. Da fração lábil, os íons
fosfatos são convertidos a fosfatos insolúveis, por adsorção na superfície de um sólido
ou por precipitação. O fosfato passa progressivamente da fração lábil para a fração não
lábil, tornando-se cada vez menos disponível para as plantas (Figura 3) (NARLOCH,
2002).
O retorno à fração lábil é lento, mas pode ser otimizado e acelerado por
mecanismos de solubilização por uma grande variedade de microrganismos existentes
no solo. A aplicação de fertilizantes tem sido largamente utilizada, principalmente com
fosfatos solúveis em água. Porém a maior parte desses, até 90% transformam-se em
formas não disponíveis aos vegetais. Em vista disso, a quantidade de fosfatos solúveis
aplicados na agricultura é muita maior que as necessidades reais (NARLOCH, 2002). A
fonte principal dos fertilizantes fosfatados é a rocha fosfática que, devidamente
processada, gera os superfosfatos simples (16-20%) e triplos (42-50%). Os principais
intermediários básicos dos fertilizantes fosfatados são os ácidos sulfúrico e fosfórico.
Os principais produtores mundiais de rocha fosfática são: E.U.A, Marrocos, Rússia e
China, que respondem juntos por 78% da produção (RAPPEL et al, 1993). A produção
nacional dos fosfatos solúveis possui custos desfavoráveis em relação a estes países
devido a vários fatores como: a natureza das ocorrências mineralógicas de fosfatos no
Brasil; as rochas brasileiras são de origem ígnea, apresentam baixa concentração de
fósforo e elevada presença de elementos contaminantes. Essas características aumentam
os custos de exploração e de beneficiamento relativamente superiores aos dos E.U.A.,
cujas reservas mineralógicas, ao lado do Marrocos e da ex-URSS, são tidas como mais
propícias à exploração. Além disso, é necessária a importação dos ácidos citados
anteriormente para solubilização da rocha fosfática, e com isso, eleva ainda mais os
custos da produção nacional (RAPPEL et al, 1993). Vale a pena lembrar também, que
as jazidas citadas anteriormente, fazem parte dos recursos naturais não renováveis do
190
planeta, e que a pesquisa para o melhor aproveitamento do fósforo na Agricultura,
principalmente, é muito importante para que estes recursos não sejam esgotados
(desenvolvimento sustentável).
Figura 3: Equilíbrio deslocado para a fração de fósforo não lábil.
5) Disponibilização do fósforo por ação dos microrganismos
A passagem dos vegetais do ambiente aquático para o ambiente terrestre, em
eras geológicas passadas, exigiu adaptações que permitiram aos mesmos extrair do solo,
os elementos minerais indispensáveis a sua formação e metabolismo. Uma vez que estes
nutrientes no solo, ao contrário da água, encontram-se sobretudo em formas insolúveis,
as adaptações necessárias se deram sobretudo através de associações das plantas com os
microrganismos capazes de solubilizá-los ou fixá-los. Foi o que aconteceu através das
conhecidas simbioses entre plantas e fungos (micorrizas) ou entre raízes e bactérias
(rizóbios) ou bactérias fixadoras de nitrogênio. Além disso, devido ao enriquecimento
dos solos com diversas formas de carbono orgânico, surgiram organismos de caráter
decompositor ou saprófitos de vida livre, dentre eles, os disponibilizadores de fósforo
(BRANCO et al, 2001). Dentre os microrganismos disponibilizadores de fósforo,
encontram-se microrganismos solubilizadores de fósforo, mineralizadores de fósforo e
ainda, microrganismos capazes de mineralizar e solubilizar o fósforo. O termo
mineralização refere-se à capacidade que alguns microrganismos possuem de liberar
fósforo a partir de compostos fosfatados orgânicos; já o termo solubilização refere-se à
capacidade de liberar fósforo a partir de compostos fosfatados inorgânicos.
6. Micorrizas
Dentre a miríade de microrganismos que habitam a interface entre as raízes de
plantas e o solo, alguns fungos destacam-se, sobremaneira, ao penetrarem nas células
vivas da planta hospedeira sem causar danos e, ao mesmo tempo, estenderem-se além
191
da zona de depleção das raízes para estabelecer íntimo contato de suas hifas com os
agregados e a microbiota do solo. Essa associação mutualística, formada pelo fungo
com as raízes da planta hospedeira, é conhecida como micorrizas (do grego: myke =
fungo e rhiza = raiz). Assim, a planta fornece ao fungo carboidratos, obtidos através da
fotossíntese, e o fungo, através da rede de hifas externas, capta nutrientes imóveis do
solo e os transfere a planta hospedeira. Para que esta associação seja benéfica para
ambos é necessário uma baixa, mas suficiente quantia de fósforo disponível no solo. Se
a quantia de fósforo disponível foi muito baixa, a associação mutualística do fungo com
as raízes da planta pode se tornar uma associação de parasitismo, pois o fungo passa a
competir com a planta pelo nutriente. Quando o solo tem uma alta quantia de fósforo
disponível, a planta pode obter a quantia suficiente do nutriente, sem a precisar do
fungo, portanto, nessa situação, nem sempre ocorre a formação de micorrizas
(MIYASAKA et al; 2003). Basicamente, as micorrizas são agrupadas em dois grandes
grupos, conforme o aspecto morfológico e anatômico de colonização das raízes pelo
fungo: 1. Ectomicorrizas: caracterizadas por um denso manto micelial envolvendo as
raízes e invasão intercelular das células corticais da raiz pela hifa fúngica. Em geral as
espécies florestais possuem esse tipo de associação. As Ectomicorrizas podem ser
cultivadas em laboratório, crescendo em meios de cultura puros. 2. Endomicorrizas:
cujas hifas fúngicas formam uma rede externa no solo e crescem extensivamente no
interior das células do córtex radicular. A maioria das espécies vegetais formam esse
tipo de associação, em torno de 80%. As micorrizas do tipo Vesículo-arbuscular
(MVA), estão incluídas no grupo das endomicorrizas e, embora o número de espécies
seja pequeno em relação as ectomicorrizas, ocorrem em praticamente 4/5 das plantas
vasculares. A denominação arbuscular é proveniente das estruturas especializadas do
fungo, os arbúsculos (Figura 4), que participam intimamente da simbiose,
intracelularmente, funcionando como sítio de troca de minerais e carboidratos
(CARDOSO et al, 1992). O processo de colonização, propriamente dito, tem início na
superfície da raiz, com a penetração resultante da combinação de pressão mecânica e
degradação enzimática parcial da parede celular vegetal. A produção de enzimas
hidrolíticas como pectinases, celulases e hemicelulases liberadas pelos MVA(s) tem
sido documentada e pode ser essencial para o desenvolvimento da simbiose. A
colonização intrarradicular é limitada aos tecidos externos à endoderme, e se dá pelo
192
crescimento inter e intracelular das hifas. O crescimento intracelular inicial é
caracterizado pela formação de enovelamentos de hifas transcelulares e pela
invaginação
da
membrana
plasmática
vegetal,
de
modo
que
não
existe
comprometimento da integridade das células hospedeiras. Esse processo é acompanhado
também pela deposição de material semelhante à parede celular vegetal ao redor da hifa,
criando uma região apoplástica (interface) com características bioquímicas específicas.
Em algumas células corticais, hifas intracelulares se diferenciam em arbúsculos.
Figura 4: Aspecto geral de uma Micorriza Vesículo-arbuscular; as setas em rosa e
preto indicam respectivamente, as vesículas e arbusculos. Fonte:
http://www.biologia.edu.ar/fungi/micorrizas.htm.
Durante esse processo, a parede celular fúngica se torna amorfa, desaparecendo
as cadeias de quitina cristalina. Adicionalmente, intensa síntese de membrana
plasmática, fragmentação do vacúolo, aumento do volume de citoplasma, decréscimo no
número de amiloplastos, movimentação do núcleo, rearranjo do citoesqueleto e aumento
da atividade de transcrição gênica são também alterações observáveis durante o
desenvolvimento dos arbúsculos. Vários estudos têm demonstrado que a colonização
das raízes pelos fungos micorrízicos induz aumento da produtividade de diversas
culturas conduzidas em solos de baixa fertilidade. Essa resposta é normalmente
atribuída ao incremento na absorção de nutrientes de reduzida mobilidade no solo, tais
como: fósforo, zinco, cobre, cálcio e enxofre (COOKE, 1978). O fósforo é, sem dúvida,
o nutriente mais importante envolvido na resposta de crescimento das plantas
193
micorrizadas. O fungo atua como uma espécie de ponte para o fósforo existente no solo
e as raízes do hospedeiro. Além disso, o fungo absorve formas de fosfato solúveis, e
também imobiliza e transloca formas de fosfato insolúveis ou orgânicos, que são formas
não disponíveis para as plantas.
7) Microrganismos disponibilizadores de fósforo de vida livre
É conhecido, o fato de que: “Quanto mais ativa a microbiota do solo, maior a
disponibilidade de fósforo que se tem no mesmo”. Esta disponibilidade, além de ser
atribuída a micorrização das plantas, também é atribuída a uma grande variedade de
microrganismos disponibilizadores de fósforo (MDF). Dentre os MDF(s) de vida livre,
estão as bactérias e fungos, que têm sido frequentemente isolados. Os gêneros mais
frequentemente isolados são: Bactérias: Bacillus, Thiobacillus, Mycobacterium,
Micrococcus, Flavobacterium, Enterobacter, Arthrobacter, Alcaligenes, Pseudomonas,
Nitrobacter, Escherichia, Agrobacterium, Achromobacter, Erwinia, Brevibacterium.
Fungos: Aspergillus, Penicillium, Sclerotium, Rhizopus, Cândida, Oidiodendron,
Pseudogymnoascus, Trichoderma, Chaetomium, Fusidium, Fusarium, Stachybotrys,
Cunninghamella, Thielavia, Mucor, Coniothyrium (CARDOSO et al, 1992). Alguns
destes microrganismos podem viver em meios de cultura onde apenas a apatita ou outra
fonte de fósforo insolúvel é fornecida, assimilando o fósforo para o seu metabolismo
próprio e liberando o excesso como íons fosfatos. O isolamento dos MDF(s) tem como
principal objetivo, estudar a aplicação dos mesmos na agricultura, auxiliando a planta na
absorção de fosfatos não disponíveis contidos no solo.
Mecanismos de disponibilização do fósforo adotados pelo MDF(s)
Existem vários mecanismos exercidos pelos microrganismos sobre o meio,
contribuindo para a disponibilização do fósforo. Dentre esses mecanismos, destaca-se
uma atividade secretora específica, liberando substâncias que provocam a transformação
específica fosfatos presentes, em formas de assimilação fácil e imediata. Os
mecanismos de disponibilização de fósforo mais observados são: produção de ácidos
orgânicos, ácidos inorgânicos e enzimas. Vários autores têm observado a importância da
produção de ácidos ou de um abaixamento no pH no solo, para que seja possível reduzir
a fixação do fósforo pelas partículas de solo, aumentando a disponibilidade do
194
elemento. Alguns estudos realizados demonstram, a nítida relação existente entre o
aumento da concentração de fosfatos solúveis com o simultâneo aumento da produção
de ácidos, sendo eles orgânicos ou inorgânicos; o que permite concluir que, quanto
maior a presença desses ácidos, maior a quantidade de fosfatos solúveis (REDDY et al,
2002) (SHIBATA et al, 2003) (SINGH et al, 1998) (NARSIAN et al, 2000). Em relação
aos ácidos orgânicos, pode-se dizer que os mesmos são constituintes normais da maioria
dos solos agrícolas e desempenham o importante papel de facilitar a disponibilidade de
formas insolúveis dos nutrientes das plantas, sobretudo do fósforo (CORREIA, 1980).
Dentre a miríade de ácidos orgânicos existentes no solo, encontram-se: ácido cítrico,
lático, málico, oxálico, glicônico e outros formados no metabolismo intermediário de
organismos quimiorganotróficos, excretados pelas raízes de plantas superiores ou
inferiores, excretados por alguns tipos de fungos que fazem associação mutualística com
as plantas e finalmente lixiviados a partir da superfície de resíduos vegetais ou animais.
A produção desses ácidos pelos microrganismos é decorrência de bloqueios em diversos
pontos no ciclo de Krebs. O Fe+2 é o cofator metálico da enzima aconitase, responsável
pela conversão do citrato ao Ácido cis-aconítico no ciclo de Krebs. Assim, em solos
ácidos, que possuem uma grande quantidade de fosfatos de ferro, a liberação de ácidos
pode ser estimulada pela indisponibilidade do mesmo. Algumas espécies de plantas são
conhecidas por utilizar formas de fosfato não disponíveis, como as Lupins brancas, que
desenvolvem raízes proteóides em condições de baixa disponibilidade de fósforo. Essas
raízes excretam uma grande quantidade de ácido cítrico. Outro exemplo é o Amendoin,
que também é conhecido por excretar vários tipos de ácidos orgânicos de suas raízes
(SHIBATA et al, 2003). Além disso, muitos ácidos orgânicos, especialmente o cítrico,
glicônico, oxálico, lático e succínio possuem também, propriedade quelante sobre
cátions fixadores dos ânions fosfóricos. Desta forma, eles podem formar complexos
muito estáveis com Ca+2, Mg+2, Fe+3 e Al+3, admitindo que o mesmo suceda para evitar
a fixação dos fosfatos por esses cátions. (BRANCO et al, 2001)(CORREIA, 1980).
Vários agentes quelantes evidenciam que sua ação, na solubilização dos fosfatos, esta
relacionada a sua estrutura química, ou seja, os agentes quelantes com grupamentos de
ácidos carboxílicos e fenólicos são os responsáveis pela solubilização a fosfatos
insolúveis (NARSIAN et al, 2000). Ácidos inorgânicos fortes como: H2SO4, HNO2,
HNO3, formados a partir da oxidação de formas reduzidas de enxofre e nitrogênio, por
195
microrganismos quimiolitotróficos também auxiliam no processo de disponibilização do
fósforo. O mesmo acontece com os ácidos inorgânicos fracos como: H2CO3, formado a
partir de excreções radiculares de CO2 e do metabolismo respiratório dos
microrganismos. Assim, o CO2 reage com íons H+ contidos no solo para dar origem ao
H2CO3. O ácido formado permanece em equilíbrio com o CO2 como representado
através da reação: H2CO3
HCO3- + H+
Este mecanismo de disponibilização do fósforo baseia-se no excesso de CO2 no
meio. Em toda a atividade decompositora há uma produção de CO2 contribuindo para o
enriquecimento do HCO3- no solo. O HCO3- + H+ combina-se com o fosfato tricálcico,
insolúvel, formando fosfato dicálcico, através da reação: Ca3(PO4)2 + HCO3- + H+
Ca2(HPO4)2 + CaCO3
Finalmente o fosfato dicálcico reage novamente com o HCO3- + H+ formando
fosfato monocálcico, solúvel, através da reação: Ca2(HPO4)2 + HCO3- + H+
Ca(H2PO4)2 + CaCO3
Porém essas reações não podem ser demonstradas em laboratório, apenas na
presença de microrganismos (adaptado de BRANCO et al, 2001).
Participação das enzimas nos processos disponibilização do fósforo
Ao decomporem a matéria orgânica, os organismos podem liberar fósforo que
estava contido em moléculas orgânicas como os hexafosfatos de inositol, num processo
chamado Mineralização (CORREIA, 1980). Algumas enzimas do solo, como as
fosfatases (que incluem as Fitases, Nucleases e Fosfolipases), assumem significado
especial na conversão do fósforo em formas orgânicas a formas inorgânicas assimiláveis
pelas raízes das plantas (CARDOSO et al, 1992). As fitases agem no hexafosfato de
inositol, removendo fosfatos um a um, formando penta, tri, bi, monofosfato e finalmente
liberando o inositol. São produzidas por microrganismos de várias espécies:
Aspergillus, Penicillium, Rhizopus, Cunninghamella, Arthrobacter, Streptomyces,
Pseudomonas e Bacillus. Alguns microrganismos excretam as fitases, enquanto outros
as mantém intracelularmente. As nucleases despolimerizam as moléculas de DNA e
RNA. As fosfolipases liberam o fósforo, através de reações de hidrólise enzimática. As
raízes das plantas também produzem fosfatases que juntamente com as fosfatases
microbianas, atuam na mineralização da matéria orgânica e podem contribuir para a
196
nutrição das plantas (CARDOSO et al, 1992). As enzimas do solo também auxiliam nas
transformações, dos chamados produtos agroquímicos, muito utilizados na agricultura.
Apesar destes compostos não serem diretamente transformados pelas enzimas do solo, a
maioria deles são influenciados pelos organismos do solo (CORREIA, 1980).
Aplicação dos MDF(s) na agricultura
A aplicação de inoculantes de microrganismos do solo e da rizosfera têm se
intensificado nos últimos anos. Vários estudos utilizando inóculos de MDF(s) em solos
tratados com fertilizantes superfosfatos, com rochas fosfáticas e sem tratamento,
demonstraram que, os mesmos, podem ser substituídos total ou parcialmente pela
inoculação. As MVA(s) também têm sido muito utilizadas para esse propósito e vêm
demonstrando um enorme potencial biotecnológico. Alguns exemplos da aplicação
desses fungos na agricultura e no reflorestamento são apresentados na Tabela 1. Sua
exploração é viabilizada pelo aumento da taxa de micorrização das plantas, que pode ser
conseguido: a) pela inoculação com isolados fúngicos selecionados; b) por práticas de
manejo seletivo da população fúngica nativa dos solos agrícolas e; c) mais
recentemente, pela aplicação de compostos estimulantes da micorrização.
Tabela 1: Exemplos de culturas, fungos eficientes e efeito da inoculação no Brasil.
(SIQUEIRA et al, 2002)
Cultura
Fungos eficientes
Abacaxi
Glomus
clarum,
Efeitos da inoculação
Gigaspora Melhor
margarita e Glomus intraradices
Cafeeiro
Glomus
clarum,
de
mudas micropropagadas
Gigaspora Melhor
margarita e Glomus etunicatum
desenvolvimento
desenvolvimento
de
mudas, maior sobrevivência em
campo e maior produção.
Citros
Acaulospora morrowiase, Glomus Crescimento mais rápido de porta
clarum, G. etunicatum e Glomus enxertos e de mudas no campo.
intraradices
197
Leguminosas
Glomus
clarum
e
Glomus Favorecimento da nodulação, do
intraradices
acúmulo de N, da produção de
grãos e da tolerância ao déficit
hídrico.
Milho
Glomus
clarum
e
Glomus Nutrição
intraradices
Mamão
Entrophospora
Plantas
Glomus
melhor
crescimento e produção.
colombiana
Glomus etunicatum
Tomate
favorecida,
etunicatum,
e Melhor desenvolvimento inicial e
de nutrição de mudas
Glomus Crescimento estimulado e maior
clarum e Gigaspora margarita
eficiência do uso de P
Glomus fasciculatum
Essencial para o desenvolvimento
arbóreas:
de mudas de espécies de semente
reflorestamento
pequena e crescimento rápido.
e frutíferas
A inoculação garante efeitos benéficos, podendo ser efetuada no solo durante a
semeadura de plantas anuais e de pastagens, na repicagem de mudas de plantas
olerícolas, na formação de mudas de espécies arbustivas ou arbóreas com finalidades
agronômicas, florestais, de recuperação ambiental e de ornamentação. As respostas da
inoculação variam de 10% a 800% em aumento da biomassa vegetal, e são maiores,
mais consistentes e promissoras em plantas que passam por fase de formação de mudas.
No entanto, a aplicação desses fungos em larga escala é ainda muito limitada,
principalmente pela falta de inoculante aceito comercialmente. A principal razão para a
falta de inoculante é o caráter biotrófico obrigatório do fungo, que exige que sua
propagação seja feita em plantas multiplicadoras. São conhecidos vários sistemas para a
multiplicação de propágulos, em solo esterilizado, substratos inertes, sistemas
hidropônicos e aeropônicos, e produção de inoculantes. Em condições favoráveis
apropriadas, pode-se obter até 200.000 esporos de MVA(s) por litro de substrato em 4
meses, o que seria suficiente para inocular de 2.000 a 3.000 mudas. O estabelecimento
de padrões de qualidade de inoculantes, considerando-se aspectos de pureza e sanidade,
198
é essencial para o desenvolvimento comercial desses fungos. Pacotes tecnológicos para
aplicações diversas já foram desenvolvidos, como é o caso da inoculação do cafeeiro,
cuja viabilidade técnica já foi demonstrada no Brasil e sua aplicação é concretizada na
Colômbia, onde existem várias empresas produtoras de inoculantes. Mudas inoculadas
com esporos de fungos selecionados desenvolvem-se mais rapidamente no viveiro,
sobrevivem melhor quando transplantadas para o campo e produzem mais (SIQUEIRA
et al, 2002). Existem várias técnicas conhecidas para a produção de inoculantes;
podendo ser produzidos em fermentadores sólidos e líquidos, e serem aplicados em
fermentadores ou em solos de plantio, porém, uma técnica mais sofisticada e que tem
demonstrado
importantes
resultados
em
relação
aos
inoculantes
produzidos
normalmente, é a imobilização desses microrganismos em diferentes tipos de materiais
poliméricos. A imobilização de microrganismos, enzimas, animais e células de plantas
em uma variedade de materiais, tem sido muito investigado, devido às vantagens
apresentadas em relação às células livres para uma variedade de processos
biotecnológicos.
A imobilização dos microrganismos envolve a fixação ou encerramento dos
mesmos, em suportes sólidos. A principal vantagem dos microrganismos imobilizados
sobre os livres é o aumento do tempo de vida desses microrganismos em locais de
armazenamento, em condições de fermentação ou em solos de plantio. Assim,
dependendo do fungo que é imobilizado em alginato de cálcio, pode ser armazenado em
água por 4oC em até 6 meses com retenção de 95 a 100% de viabilidade (MAUPÉRIN
et al, 1987) (PLENCHETTE, 2003). Dentre os suportes mais utilizados estão o alginato
de cálcio, ágar e a espuma de poliuretano. A utilização de MDF(s), encapsulados em
alginato de cálcio, para obtenção de fosfatos solúveis vêm sendo extensivamente
estudado, mostrando-se uma atraente alternativa em relação a outros tipos de
inoculantes.
Produção dos MDF(s) encapsulados em alginato
Um procedimento a ser tomado para a produção dos encapsulados é a aquisição
de biomassa produzida num biorreator, por exemplo, que é retirada assepticamente,
sendo em seguida lavada com água destilada esterilizada e conservada em solução
salina. Após alguns dias o micélio é fragmentado durante alguns segundos no
199
liquidificador e a suspensão resultante é misturada com uma solução de alginato de
sódio. A mistura resultante é gotejada em uma solução de cloreto de cálcio, onde pode
ser visualizada a polimerização e consequentemente a formação das cápsulas, após
aproximadamente 50 minutos. Em seguida, as cápsulas podem ser armazenadas sob
refrigeração (ROSSI, 2001). Vale a pena lembrar que as cápsulas também podem ser
produzidas com esporos, vesículas e outras partes do fungo. Vários estudos têm
demonstrado as vantagens apresentadas pelos microrganismos imobilizados em relação
aos mesmos livres para uma variedade de aplicações. Existem muitos estudos sobre a
solubilização de fosfatos a partir de Rochas Fosfáticas (RF), por células livres e por
células imobilizadas em condições de fermentador. Estes estudos visam a possível
produção, em escala industrial de fosfatos solúveis, a partir da atividade microbiana, em
vez da atual tecnologia que utiliza ácidos minerais fortes, como citado anteriormente.
Os ácidos orgânicos produzidos pelos microrganismos solubilizadores de fósforo
(MSF), provocam o decréscimo de pH e o aumento da solubilização do fósforo. Como
exemplo, ilustra-se um estudo, utilizando células livres e encapsuladas de Yarowinia
lipolytica, em condições de fermentador. Os resultados obtidos ilustram a relação
existente entre a quantidade de ácido cítrico liberado e o fato da célula estar imobilizada
ou livre. Percebeu-se também, que as células, encapsuladas em três materiais diferentes
(alginato de cálcio, ágar e k-carrageenan), foram capazes de produzir ácido cítrico
durante períodos maiores, em relação às células livres (VASSILEVA et al, 2000). Em
fermentadores, os métodos de imobilização são particularmente importantes para
processos que utilizam fungos filamentosos, pois durante seu cultivo, os mesmos
demonstram um típico crescimento do micélio. As altas concentrações de biomassa
dificultam o fluxo do líquido e consequentemente, observa-se um decréscimo de
oxigênio livre e de nutrientes como carbono e nitrogênio. Assim, para amenizar este
problema, o uso desses microrganismos imobilizados tem sido empregado (VASSILEV
et al, 2001). O estudo de Vassilev e colaboradores (1997) ilustrou que a produção de
ácido cítrico por Aspergillus niger imobilizado em espuma de polietileno (EP) em um
fermentador, foi capaz de solubilizar até 82,5% de RF. A imobilização de fungos
filamentosos em EP produziu boas quantidades de ácido glicônico. O Penicillium
variable, imobilizado em EP, mostrou a produção de ácido glicônico concomitante ao
processo de solubilização de RF, conforme abordado no estudo de Fenice e
200
colaboradores (2000). Além da aplicação desses microrganismos em fermentadores,
várias pesquisas vêm sendo realizadas com esses microrganismos imobilizados em
solos de plantio. Por exemplo, células de Enterobacter sp foram encapsuladas em
alginato de cálcio e inoculadas em solos de plantio. Onde foi observado que, depois de
um determinado período, havia um maior número de células bacterianas no solo
inoculado com as células encapsuladas do que o solo inoculado com as células livres.
Esta observação foi mais pronunciada no tratamento com plantas micorrizas. Através
dos resultados obtidos, pode-se perceber que as células encapsuladas ficam protegidas
de diversos fatores bióticos e abióticos do meio, aumentando consequentemente o
tempo de vida das mesmas. Somente o alginato promove melhores condições de
armazenamento e sobrevivência do Pseudomonas striata e Bacillus polymixa.
As vantagens dos inoculantes encapsulados foram muito mais acentuadas no
tratamento com plantas micorrizadas, onde o total atingido de P, chegou a ser de 150%
maior que os controles (plantas não inoculadas). A desvantagem da utilização dos
microrganismos encapsulados é a limitação da atividade causada pelo reduzido fluxo de
oxigênio circulante dentro do material. No entanto, essas limitações podem ser
amenizadas ou até mesmo eliminadas no procedimento de preparação das cápsulas,
onde pode ser adicionado uma fonte de nutrientes, como o leite, aumentando assim, o
tempo de vida destes microrganismos dentro das cápsulas. Além disso, o nível de
atividade metabólica das cápsulas depende das diferentes condições físicas, químicas e
biológicas do solo; outro fator limitante do uso dessa técnica é o custo elevado que
possuem os suportes citados (VASSILEV et al, 2001).
Considerações finais
A aplicação dos microrganismos disponibilizadores de fósforo encapsulados em
alginato de cálcio, mostra-se uma interessante técnica principalmente pela alta atividade
metabólica e estabilidade em longos períodos de armazenamento dos inóculos, no
entanto, ainda são necessárias mais pesquisas visando a implementação de métodos
mais simples de imobilização e utilização de materiais mais baixo custo. Além disso,
muitas pesquisas ainda são necessárias para elucidar as consequências ecológicas da
introdução dos inóculos microbianos nos solos por longos períodos.
201
REFERÊNCIAS BIBLIOGRÁFICAS
1. BARROW, J.R., OSUNA, P. Phosphorus solubilization and uptake by dark
septate fungi in fourwing saltbush, Atriples canescens (Pursh) Nutt. Journal of
Arid Environments (2002) 51: 449-459.
2. BRANCO, Samuel Murgel; MURGEL, Paulo Henrique; CAVINATTO, Vilma
Maria. Compostagem: solubilização biológica de rocha fosfática na produção de
fertilizante organomineral. Engenharia Sanitária, v. 6, n. 3, p. 115-121, jul/set.
2001.
3. CARDOSO, Elke Jurandy Bran Nogueira. Microbiologia do solo, Campinas SP
Sociedade Brasileira de Ciências do solo, 1992.
4. CARNEIRO, M.A.C., SIQUEIRA, J.O., CURI, N.,MOREIRA, F.M.S. Efeitos
da inoculação de fungos micorrízicos arbusculares e da aplicação de fósforo no
estabelecimentos de forragens em solo degradado. Pesquisa agropecuária
brasileira, Brasília, v.34, n.9, p.1669-1677 set 1999.
5. COOKE, R. The Biology of Symbiotic Fungi. John Wiley & Sons Ltda 1978
Toronto.
6. CORREIA, A.A.D., Bioquímica nos solos, nas pastagens e forragens. Editora
Fundação Calouste Gulbenkian Lisboa 1980.
7. FENICE, M., SELBMAN, L., FEDERICI, F., VASSILEV, N. Application of
encapsulated Penicillium variabile P16 in solubilization of rock phosphate.
Bioresource Technology 73 (2000) 152-162.
8. FREDERICK, S. J. As plantas e os sais minerais, São Paulo, Editora Pedagógica
e Universitária LTDA, 1989, volume 33-Temas de biologia.
9. Hipertextos Del Área de la Biología. Disponível em
http://www.biologia.edu.ar/fungi/micorrizas.htm. Acesso em 12/04/04.
10. JOHN, Liana. Números refletem tendências desastrosas. Estadão, São Paulo,
2000. Disponível em
http://www.estadao.com.br/ext/ciencia/arquivo/eco/numeros.htm. Acesso em
15/04/2004.
202
11. KAPOOR, R., GIRI, B., MUKERJI, K.G. Improved growth and essential oil
yield and quality in Foeniculum vulgare mill on mycorrhizal inoculation
supplemented with P-fertilizer. Bioresource Technology 93 (2004) 307-311.
12. MATTA, F.M., LOUREIRO, M.E. Nutrição mineral de plantas. Disponível em
www.ufv.br/dbv/pgfvg/Bve%20270/pdf/Nutricaomin1.pdf . Acesso em
15/04/04.
13. MARCOS, Eduardo Paron; Siqueira, José Oswaldo., Curi, Nilton., Vale,
Fabiano Ribeiro do. Crescimento da Copaíba e Guatambú em resposta a fungo
micorrízico, superfosfato, nitrogênio e fumigação do solo.
14. www.dcf.ufla.br/Cerne/revistav2n2-1996/OLGUATA1.PDF
15. MAUPÉRIN, C.H., MORTIER, F., GARBAYE, J., TACON, L.E., CARR, F.
Viability of an ectomycorrhizal inoculum produced in a liquid medium and
entrapped in a calcium alginate gel. Canadian Journal Biology 65 (1987) 23262329.
16. MINISTÉRIO DA AGRICULTURA E DO ABASTECIMENTO-Comércio
exterior agrícola (On line). Disponível em www.agricultura.gov.br/Estatisticas/.
Acesso em 20/04/04.
17. MIYASAKA, S.C., HABTE, M., FRIDAY, J.B., JOHNSON, E.V. Manual on
Arbuscular Mycorrhizal Fungus Production and Inoculation Techniques. Soil
and Crop Management, July 2003, SCM 5, p.1-4.
18. NARLOCH, Charles. Interação microrganismos solubilizadores de fosfatos,
fungos ectomicorrízicos e mudas de Pinus taeda L. 2002. Dissertação (mestrado
em Biotecnologia) - Universidade Federal de Santa Catarina, UFSC,
Florianópolis, 2002.
19. NARSIAN, V., PATEL, H.H. Aspergillus aculeatus as rock phosphate
solubilizer. Soil Biology & Biochemistry. 32 (2000) 559-569.
20. PAUL, E.A., CLARCK, F.E. Soil Microbiology and Biochemistry. Academic
Press Limited. San Diego California 1988
21. PLENCHETTE, C., STRULLU, D. Long-term viability and infectivity of
203
intraradical forms of Glomus intraradices vesicles encapsulated in alginate
beads. Mycol. Res. 107 (2003) 614-616.
22. RAPPEL, E., LOIOLA, E. Estudo da competitividade da indústria brasileira
(indústria de fertilizantes), MINISTÉRIO DA CIÊNCIA E TECNOLOGIA,
1993. Disponível em www.mct.gov.br/publi/Compet/Default.htm . Acesso em
20/04/04.
23. REDDY, M. S., KUMAR, S., BABITA, K., REDDY., M.S. Biosolubilization of
poorly soluble rock phosphates by Aspergillus tubingensis and Aspergillus
niger. Bioresource Technology. 84 (2002) 187-189.
24. ROSSI, M. J. Produção de inoculante de fungo ectomicorrízico utilizando
fermentação no estado líquido em bioreator tipo Airlift. UFSC 2001.Eng
Química.
25. RUBIO, R., BORIE, F., SCHALCHLI, C., CASTILLO, C., AZCON, R.
Occurrence and effect of arbuscular mycorrhizal propagules in wheat as affected
by the source and amount of phosphorus fertilizer and fungal inoculation.
Applied Soil Ecology 23 (2003) 245-255.
26. SHIBATA, R., YANO, K. Phosphorus acquisition from non-labile sources in
peanut and pigeonpea with mycorrhizal interacion. Applied Soil Ecology 24
(2003) 133-141.
27. SINGH, C.P., AMBERGER, A. Organic acids and phosphorus solubilization in
straw composted with rock phosphate. Bioresource Technology 63 (1998) 1316.
28. SIQUERA, J.O., LAMBAIS, M.R., STURMER, S.L. Fungos micorrízicos
arbusculares - características, associação simbiótica e aplicação na agricultura.
Biotecnologia Ciência e Desenvolvimento Ano 4, n. 25 Mar/Abril 2002.
29. SIQUEIRA, J.O., SAGGIN-JÚNIOR, O.J., FLORES-AYLAS, W.W.,
GUIMARÃES, P.T.G. Arbuscular mycorrhizal inoculation and superphosphate
application influence plant development and yield of coffee in Brazil.
Mycorrhiza 1998 7:293-300
30. UNITED STATES. United States Census Bureau. U.s. Department Of
204
Commerce (Org.). World POPClock Projection. Disponível em:
<http://www.census.gov/population/popclockworld.html>. Acesso em: 15 set.
2012.
31. VASSILEVA, M., AZCON, R., BAREA, J.M., VASSILEV, N. Rock phosphate
solubilization by free and encapsulated cells of Yarowia lipolytica. Process
Biochemistry 35 (2000) 693-697.
32. VASSILEV, N., TORO, M., VASSILEVA, M., AZCON, R., BAREA, J.M.
Rock phosphate solubilization by immobilized cells of Enterobacter sp in
fermentation and soil conditions. Bioresource Technology 61 (1997) p.29-33
33. VASSILEV, N., VASSILEVA, M., FENICE, M., FEDERICI, F. Immobilized
cell technology applied in solubilization of insoluble inorganic (rock)
phosphates and P plant acquisition. Bioresource Technology 79 (2001) 263-271.
34. VASSILEV, N., VASSILEVA, M., AZCON, R. Solubilization of rock
phosphate by immobilized Aspergillus niger. Bioresource Technology 59
(1997) 1-4.