Universidade Federal Rural do Semi-Árido - UFERSA
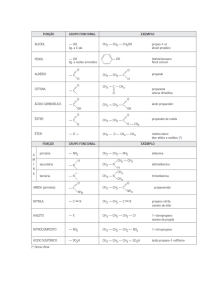
Isomeria Plana, Estrutural ou Constitucional
• Isômeros são compostos diferentes que apresentam a mesma
fórmula molecular.
• Isômeros constitucionais são isômeros que diferem na ordem em
que seus átomos estão conectados. Eles são ditos terem uma
conectividade diferente.
Exemplos de isômeros constitucionais
Fórmula Molecular
Isômeros Constitucionais
CH3
C4H10
e
CH3CH2CH2CH3
Butano
CH3CHCH3
Isobutano
Cl
C3H7Cl
C2H6O
e
CH3CH2CH2Cl
1-Cloropropano
CH3CH2OH
Etanol
CH3CHCH3
2-Cloropropano
e
CH3OCH3
Éter dimetílico
1
Prof. Ms. Zilvam Melo – Química Orgânica
Universidade Federal Rural do Semi-Árido - UFERSA
Os isômeros constitucionais podem ser subdivididos em:
a) Isomeria de Função;
b) Isomeria de Cadeia;
c) Isomeria de posição;
d) Isomeria de Compensação ou Metameria;
e) Isomeria Dinâmica ou Tautomeria.
a) Isomeria de Função
A diferença entre os isômeros está no grupo funcional.
Existem quatro casos mais comuns e importantes de isomeria de função:
1. Isomeria: éter-álcool – CnH2n+2O
Neste caso, sempre que for possível escrever a fórmula de um éter,
também será possível escrever a fórmula de um álcool, usando a mesma
fórmula molécular.
Exemplo: fórmula molecular C2H6O
H3 C
O
CH3
Metoximetano
H3 C
H2
C
OH
Etanol
2. Isomeria: cetona-aldeído – CnH2nO
Neste caso sempre que for possível escrever a fórmula de uma cetona,
também será possível escrever a fórmula de um aldeído, usando a mesma
fórmula molécular.
Exemplo: fórmula molecular C3H6O
2
Prof. Ms. Zilvam Melo – Química Orgânica
Universidade Federal Rural do Semi-Árido - UFERSA
H 3C
O
O
C
C
CH3
H 3C
C
H2
Propanona
H
Propanal
3. Isomeria: éster-ácido carboxílico – CnH2nO2
Neste caso sempre que for possível escrever a fórmula de um éster,
também será possível escrever a fórmula de um ácido carboxílico, usando
a mesma fórmula molécular.
Exemplo: fórmula molecular C2H4O2
O
H
O
C
H3 C
O
CH 3
Metanoato de metila
C
O
H
Ácido etanóico
4. Isomeria: fenol/álcool aromático-éter aromático – CnH2n-6O
Neste caso sempre que for possível escrever a fórmula de um fenol ou um
álcool aromático, também será possível escrever a fórmula de um éter
aromático, usando a mesma fórmula molécular.
3
Prof. Ms. Zilvam Melo – Química Orgânica
Universidade Federal Rural do Semi-Árido - UFERSA
Exemplo: fórmula molecular C7H8O
Álcool benzílico
Meta-metilf enol
H3C
H2
C
OH
Fenol
Metoxibenzeno
O
OH
Álcool
Éter
b) Isomeria de Cadeia
A diferença entre os isômeros está no tipo de cadeia carbônica.
Existem três casos principais de isomeria de cadeia:
1. Isomeria: Cadeia fechada-cadeia aberta – CnH2n
Neste caso sempre que for possível escrever a fórmula de um ciclano,
também será possível escrever a fórmula de um alceno.
Exemplo: fórmula molecular C3H6
H2
C
H2C
H2 C
CH2
Ciclopropano
C
H
CH3
Propeno
2. Isomeria: Cadeia ramificada-cadeia normal – CnH2n+2
Neste caso sempre que for possível escrever a fórmula de um composto de
cadeia ramificada, também será possível escrever a fórmula de um
composto de cadeia normal.
4
Prof. Ms. Zilvam Melo – Química Orgânica
CH3
Universidade Federal Rural do Semi-Árido - UFERSA
Exemplo: fórmula molecular C4H10
CH3
H3 C
C
H
H3C
CH3
H2
C
H2
C
CH3
Butano
Metilpropano
3. Isomeria: Cadeia heterogênea-cadeia homogênea
Ocorre sempre que for possível mudar a posição de um heteroátomo
tornando a cadeia homogênea sem alterar o grupo funcional – o que se dá
com as aminas e as amidas.
Exemplo: fórmula molecular C2H7N
H3 C
N
CH3
H2
C
H3C
NH2
H
Dimetilamina
Etilamina
c) Isomeria de Posição
A diferença entre os isômeros está na posição de um grupo funcional, de
uma insaturação ou de um substituinte.
Existem três casos principais de isomeria de posição:
•
Diferente Posição de um Grupo Funcional
Ocorre apenas com grupos funcionais ligados à cadeia homogênea, como
álcoois.
Exemplo: fórmula molecular C3H8O
5
Prof. Ms. Zilvam Melo – Química Orgânica
Universidade Federal Rural do Semi-Árido - UFERSA
OH
H2
C
H 3C
H2
C
OH
H 3C
C
H
Propan-1-ol
CH3
Propan-2-ol
• Diferente Posição de uma Insaturação
Ocorre apenas com compostos insaturados que não sofrem ressonância e
têm no mínimo 4 carbonos.
Exemplo: fórmula molecular C4H8
H2 C
H2
C
C
H
CH3
H3C
C
H
But-1-eno
C
H
CH3
But-2-eno
• Diferente na Posição de um Substituinte
Ocorre entre compostos cíclicos com no mínimo 5 átomos de carbonos ou
em compostos acíclicos com no mínimo 6 átomos de carbono.
Exemplo: fórmula molecular C5H10
H 3C
H
CH3
CH3
C
C
C
H
H
C
H
H
1,1-Dimetilciclopropano
C
H
H
C
CH3
H
1,2-Dimetilciclopropano
6
Prof. Ms. Zilvam Melo – Química Orgânica
Universidade Federal Rural do Semi-Árido - UFERSA
d) Isomeria de Compensação ou Metameria
A diferença entre os isômeros está apenas na posição de um
heteroátomo.
Existem quatro casos principais de isomeria de posição: entre éteres,
entre ésteres, entre aminas e entre amidas
•
Metameria entre Éteres
Ocorre éteres que possuem no mínimo 4 átomos de carbono.
Exemplo: fórmula molecular C4H10O
H3 C
H2
C
O
H2
C
H2
C
H3 C
CH3
Metoxipropano
H2
C
O
CH3
Etoxietano
• Metameria entre Ésteres
Ocorre com ésteres que possuem no mínimo 3 átomos de carbono.
Exemplo: fórmula molecular C3H6O2
O
O
H3C
H
C
O
CH3
Etanoato de metila
C
O
H2
C
CH3
Metanoato de etila
• Metameria entre Aminas
Ocorre aminas que possuem no mínimo 4 átomos de carbono.
7
Prof. Ms. Zilvam Melo – Química Orgânica
Universidade Federal Rural do Semi-Árido - UFERSA
Exemplo: fórmula molecular C4H11N
H3C
H
N
H2
C
H2
C
H2
C
H3 C
CH3
H
N
H2
C
CH 3
N-etiletanamina
N-metiletanamina
• Metameria entre Amidas
Ocorre amidas que possuem no mínimo 2 átomos de carbono.
Exemplo: fórmula molecular C3H7ON
O
O
H3 C
H
C
N
H
C
N
H
CH3
N-metiletanamida
H2
C
CH 3
N-Etilmetanamida
e) Isomeria Dinâmica ou tautomeria
Este tipo de isomeria ocorre quando dois compostos de mesma
fórmula molecular e grupos funcionais diferentes coexistem em equilíbrio
dinâmico no qual um deles está continuamente se transformando no outro
e vice-versa.
A tautomeria ocorre somente na fase líquida, em compostos cuja
molécula possui um elemento muito eletronegativo, como o oxigênio ou
nitrogênio, ligado ao mesmo tempo ao hidrogênio e a um carbono
insaturado (que possui ligação π) A alta eletronegatividade do oxigênio ou
do nitrogênio provoca a atração dos elétrons da ligação π do carbono, que
é uma ligação fraca e fácil de deslocar.
8
Prof. Ms. Zilvam Melo – Química Orgânica
Universidade Federal Rural do Semi-Árido - UFERSA
• Tautomeria Aldo-enólica (aldeído ՞ enol)
Ocorre entre aldeídos e enóis que possuem no mínimo 2 átomos de
carbono.
Exemplo: fórmula molecular C2H4O
H
H
O
OH
C
H
C
H
C
C
H
H
H
Etenol
Etanal
• Tautomeria Ceto-enólica (cetona ՞ enol)
Ocorre entre cetonas e enóis que possuem no mínimo 3 átomos de
carbono.
Exemplo: fórmula molecular C3H6O
O
OH
H 3C
C
CH 2
1-Propen-2-ol
H3C
C
CH3
Propanona
9
Prof. Ms. Zilvam Melo – Química Orgânica
Universidade Federal Rural do Semi-Árido - UFERSA
10
Prof. Ms. Zilvam Melo – Química Orgânica