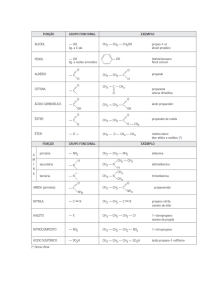
Universidade Federal Rural do Semi­Árido ­ UFERSA 1. Isomeria Moléculas que têm a mesma fórmula molecular, mas não são idênticas, são chamadas isômeros. Os isômeros dividem‐se em duas classes: isômeros constitucionais e Estereoisômeros. 1.1 Isômeros constitucionais Os isômeros constitucionais são isômeros que diferem na conectividade. Conectividade é a forma como os átomos das moléculas estão conectados. Por exemplo, o etanol e o éter dimetílico são idêntico são isômeros de constitucionais, pois têm a mesma formula molecular (C2H6O) no entanto os átomos em cada substância estão conectados de forma diferente. O oxigênio no etanol está ligado a um carbono e a um hidrogênio, enquanto que no éter dimetílico o oxigênio está diretamente a dois carbonos. Este fato, afeta diretamente as propriedades físicas dos compôs, pois o ponto de ebulição do etanol é 78,3 oC, enquanto que o do éter dimetílico é ‐24,9 oC. Isso se dá, pelo fato do isômero do etanol poder formar ligações de hidrogênio diferentemente do éter dimetílico. Na Tabela 1 estão listados alguns exemplos de isômeros constitucionais. Tabela 1: Exemplos de isômeros constitucionais. Fórmula Molecular Isômeros Constitucionais CH3
C4H10 CH3CH2CH2CH3
e
Butano
CH3CHCH3
Isobutano Cl
C3H7Cl CH3CH2CH2Cl
1‐Cloropropano
Prof. Ms. Zilvam Melo – Química Orgânica e
CH3CHCH3
2‐Cloropropano 1 Universidade Federal Rural do Semi­Árido ­ UFERSA e
CH3CH2OH
CH3OCH3
Éter dimetílico Etanol
C2H6O O
O
e
CH3CCH3
C3H6O CH3CH2CH
propanal dimetilcetona
Os isômeros constitucionais podem ser subdivididos em: a) Isomeria de Função; b) Isomeria de Cadeia; c) Isomeria de posição; d) Isomeria de Compensação ou Metameria; e) Isomeria Dinâmica ou Tautomeria. a) Isomeria de Função A diferença entre os isômeros está no grupo funcional. Existem quatro casos mais comuns e importantes de isomeria de função: •
Isomeria: éter­álcool – CnH2n+2O Neste caso, sempre que for possível escrever a fórmula de um éter, também será possível escrever a fórmula de um álcool, usando a mesma fórmula molécular. Exemplo: fórmula molecular C2H6O H3C
H2
C
OH
Etanol
Prof. Ms. Zilvam Melo – Química Orgânica H3 C
O
CH3
Metoximetano
2 Universidade Federal Rural do Semi­Árido ­ UFERSA •
Isomeria: aldeído­cetona – CnH2nO Neste caso sempre que for possível escrever a fórmula de uma cetona, também será possível escrever a fórmula de um aldeído, usando a mesma fórmula molécular. Exemplo: fórmula molecular C3H6O O
O
C
H3C
H2
C
H3C
CH3
C
H
Propanona
Propanal
•
Isomeria: ácido carboxílico­éster– CnH2nO2 Neste caso sempre que for possível escrever a fórmula de um éster, também será possível escrever a fórmula de um ácido carboxílico, usando a mesma fórmula molécular. Exemplo: fórmula molecular C2H4O2 O
H
O
C
H3 C
O
CH3
Metanoato de metila
C
O
Ácido etanóico
H
•
Isomeria: fenol­álcool aromático­éter aromático – CnH2n‐6O Neste caso sempre que for possível escrever a fórmula de um fenol ou um álcool aromático, também será possível escrever a fórmula de um éter aromático, usando a mesma fórmula molécular. Prof. Ms. Zilvam Melo – Química Orgânica 3 Universidade Federal Rural do Semi­Árido ­ UFERSA Exemplo: fórmula molecular C7H8O Álcool benzílico
m‐metilfenol
H3 C
H2
C
OH
Fenol
Metoxibenzeno
O
OH
Éter
Álcool
CH3
b) Isomeria de Cadeia A diferença entre os isômeros está no tipo de cadeia carbônica. Existem três casos principais de isomeria de cadeia: •
Isomeria: Cadeia fechada­cadeia aberta – CnH2n Neste caso sempre que for possível escrever a fórmula de um ciclano, também será possível escrever a fórmula de um alceno. Exemplo: fórmula molecular C3H6 H2
C
H2 C
CH2
H2 C
C
H
CH3
Propeno
Ciclopropano
•
Isomeria: Cadeia ramificada­cadeia normal – CnH2n+2 Neste caso sempre que for possível escrever a fórmula de um composto de cadeia ramificada, também será possível escrever a fórmula de um composto de cadeia normal. Exemplo: fórmula molecular C4H10 CH3
H3 C
C
CH3
H
Metilpropano
Prof. Ms. Zilvam Melo – Química Orgânica H3 C
H2
C
H2
C
Butano
CH3
4 Universidade Federal Rural do Semi­Árido ­ UFERSA •
Isomeria: Cadeia heterogênea­cadeia homogênea Ocorre sempre que for possível mudar a posição de um heteroátomo tornando a cadeia homogênea sem alterar o grupo funcional – o que se dá com as aminas e as amidas. Exemplo: fórmula molecular C2H7N H3C
N
CH3
H2
C
H3C
H
Dimetilamina
NH2
Etilamina
c) Isomeria de Posição A diferença entre os isômeros está na posição de um grupo funcional, de uma insaturação ou de um substituinte. Existem três casos principais de isomeria de posição: •
Diferente Posição de um Grupo Funcional Ocorre apenas com grupos funcionais ligados à cadeia homogênea, como álcoois. Exemplo: fórmula molecular C3H8O OH
H3C
H2
C
H2
C
H3C
OH
Propan‐1‐ol
C
H
CH3
Propan‐2‐ol
•
Diferente Posição de Insaturação Ocorre apenas com compostos insaturados que não sofrem ressonância e têm no mínimo 4 carbonos. Prof. Ms. Zilvam Melo – Química Orgânica 5 Universidade Federal Rural do Semi­Árido ­ UFERSA Exemplo: fórmula molecular C4H8 H2 C
H2
C
C
H
But‐1‐eno
CH3
H3 C
C
C
H
H
But‐2‐eno
CH3
•
Diferente Posição de um Grupo Substituinte Ocorre entre compostos cíclicos com no mínimo 5 átomos de carbonos ou em compostos acíclicos com no mínimo 6 átomos de carbono. Exemplo: fórmula molecular C5H10 H3C
H
CH3
C
C
C
H
H
CH3
C
H
H
C
C
H
H
1,1‐Dimetilciclopropano
CH3
H
1,2‐Dimetilciclopropano d) Isomeria de Compensação ou Metameria A diferença entre os isômeros está apenas na posição de um heteroátomo. Existem quatro casos principais de isomeria de posição: entre éteres, entre ésteres, entre aminas e entre amidas •
Metameria entre Éteres Ocorre éteres que possuem no mínimo 4 átomos de carbono. Exemplo: fórmula molecular C4H10O H3C
H2 H2
O
C
C
Metoxipropano
CH3
Prof. Ms. Zilvam Melo – Química Orgânica H3C
H2
C
H2
O
C
Etoxietano
CH3
6 Universidade Federal Rural do Semi­Árido ­ UFERSA •
Metameria entre Ésteres Ocorre com ésteres que possuem no mínimo 3 átomos de carbono. Exemplo: fórmula molecular C3H6O2 O
O
H3C
H
C
O
C
H2
C
O
CH3
Etanoato de metila
CH3
Metanoato de etila
•
Metameria entre Aminas Ocorre aminas que possuem no mínimo 4 átomos de carbono. Exemplo: fórmula molecular C4H11N H2
C
H
N
H3C
H2
C
H2
C
H3C
CH3
H2
C
H
N
CH3
N‐Etiletanamina
N‐Metilpropanamina
•
Metameria entre Amidas Ocorre amidas que possuem no mínimo 2 átomos de carbono. Exemplo: fórmula molecular C3H7ON O
O
H3 C
H
C
N
H
C
N
H
CH3
N‐metiletanamida
H2
C
CH3
N‐Etilmetanamida
Prof. Ms. Zilvam Melo – Química Orgânica 7 Universidade Federal Rural do Semi­Árido ­ UFERSA e) Tautomeria ou Isomeria Dinâmica Este tipo de isomeria ocorre quando dois compostos de mesma fórmula molecular e grupos funcionais diferentes coexistem em equilíbrio dinâmico no qual um deles está continuamente se transformando no outro e vice‐versa. A tautomeria ocorre somente na fase líquida, em compostos cuja molécula possui um elemento muito eletronegativo, como o oxigênio ou nitrogênio, ligado ao mesmo tempo ao hidrogênio e a um carbono insaturado (que possui ligação π) A alta eletronegatividade do oxigênio ou do nitrogênio provoca a atração dos elétrons da ligação π do carbono, que é uma ligação fraca e fácil de deslocar. •
Tautomeria Aldo­enólica (enol aldeído) Ocorre entre aldeídos e enóis que possuem no mínimo 2 átomos de carbono. Exemplo: fórmula molecular C2H4O H
C
H
C
H
H
Etenol
•
H
OH
C
O
C
H
H
Etanal
Tautomeria Ceto­enólica (enol cetona) Ocorre entre cetonas e enóis que possuem no mínimo 3 átomos de carbono. Exemplo: fórmula molecular C3H6O O
OH
H3 C
C
CH2
1‐Propen‐2‐ol
H3 C
C
CH3
Propanona
Prof. Ms. Zilvam Melo – Química Orgânica 8