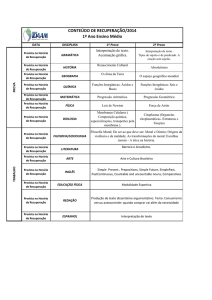
UNIVERSIDADE FEDERAL DO ACRE
ENGENHARIA AGRONÔMICA
PET - AGRONOMIA
Funções
Tutor : Prof. Dr. José de Ribamar Torres
Inorgânicas
Petiano :Victoram Costa
COSTA, V; COSTA, E. 2006
ÁCIDOS
CONCEITO
É toda espécie Química que Em ◊gua se
ioniza originando H+.
Ex:
Ex HCN
H CN
H NO2
Funções
Inorgânicas
H 2O
H 2O
H+ + CNH+ + NO2-
Obs:
Obs: ◊cidos com mais de 2 hidrogênios
ionizáveis liberam H+ por etapas .
COSTA, V; COSTA, E. 2006
ÁCIDOS
H2S por exemplo:
H HS
H 2O
H+ + HS-
Restante
negativo
H positivo
Em seguida fazemos o mesmo com o íon HS- :
H
Funções
H postivo
Inorgânicas
S-
H 2O
H+ + S2-
Restante outra carga negativa, adquirindo 2 cargas negativas.
COSTA, V; COSTA, E. 2006
ÁCIDOS
1) H2SO4 2H+ + SO422) H2CO3 2H+ + CO32 CLASSIFICAÇÃO DOS ÁCIDOS
Quanto ao
na molécula
número
de
elementos
. Binários
Funções
Inorgânicas
Ex: HCl ; H2S
. Ternários
Ex: HCl O4 e H2SO3
COSTA, V; COSTA, E. 2006
ÁCIDOS
. Quaternários
Ex: H4Fe(CN)6 e H3Fe(CN)6
Quanto a
molécula
presença
de Oxigênio na
. Oxiácidos Com oxigênio
Ex: H2SO4 e H2CO3
Funções
Inorgânicas
. Hidrácidos Sem Oxigênio
Ex: HCl ; H2S e HCN
COSTA, V; COSTA, E. 2006
ÁCIDOS
Quanto ao número de Hidrogênios
◊cidos (ionizáveis) na molécula
. monoácido
H 2O
H+ + Cl -
H 2O
2H+ + SO42-
Ex: H3 PO4 H2O
3H+ + PO43-
Ex: H Cl
. biácido
Ex: H2 SO4
Funções
Inorgânicas
. triácido
COSTA, V; COSTA, E. 2006
ÁCIDOS
. tetrácido
Outros exemplos:
HCl, HBr, HI, HCN, HNO3, HClO3,
Monoácidos H SO
2
3
Biácidos
H2S, H2SO4, H2CO3, H3PO3
Triácidos
H3AsO4, H3PO4
Tetrácidos
H4P2O7, H4As2O7
Funções
Inorgânicas
Obs:
Obs: Os hidrogênios da molécula nem sempre
são ionizáveis
COSTA, V; COSTA, E. 2006
ÁCIDOS
Veja o que ocorre com o H3PO3 e H2SO3:
H+ ionizáveis
O
H
O
P
O
H
H
H3PO3 2 H+ ionizáveis diácido
O
H+ ionizável
Funções
Inorgânicas
O
S
O
H
H
H2SO3 1 H+ ionizável monoácido
COSTA, V; COSTA, E. 2006
ÁCIDOS
Quanto a força
A força de um ácido está relacionado
com o grau de ionização (α).
α=
nº de moléculas ionizadas
x 100
nº de moléculas adicionadas
Classificam-se em:
Funções
Inorgânicas
. Ácidos fortes
Ex: HCl; HBr; HI
α > 50%
. Ácidos fracos
α < 5%
. Ácidos moderados 5% < α < 50%
Ex: HF; H3PO4
Ex: HCN; H2S
COSTA, V; COSTA, E. 2006
ÁCIDOS
NOMENCLATURA DOS ÁCIDOS
Hidrácidos
Ácido
Nome do elemento
+ ídrico
Ex: HCl Ácido clorídrico
HBr Ácido bromídrico
HCN Ácido cianídrico
Oxiácidos
Ácido
Funções
Inorgânicas
Nome do elemento
+
ico
oso
Ex: H3PO4 Ácido fosfórico
H3PO3 Ácido fosforoso
HNO3 Ácido nítrico
HNO2 Ácido nitroso COSTA, V; COSTA, E. 2006
ÁCIDOS
PRINCIPAIS ÁCIDOS
◊cido sulfúrico √ H2SO4
. É usado na fabricação de fertilizantes,
velas, explosivos, baterias de automóveis
etc.
◊cido clorídrico √ HCl
. É muito usado na limpeza de superfícies
metálicas, na indústria de papel, couros,
tintas, tecidos e em laboratórios.
Funções
Inorgânicas
◊cido nítrico √ HNO3
. É usado na fabricação de explosivos,
seda artificial, plásticos, tintas e
vernizes.
COSTA, V; COSTA, E. 2006
BASES
CONCEITO
. É toda espécie química que em ◊gua se
dissocia originando OH-.
Ex: NaOH
Ca(OH)2
H 2O
H 2O
Na+ + OHCa2+ + 2 OH-
CLASSIFICAÇÃO DAS BASES
Funções
Inorgânicas
Quanto ao número de OH. Monobases 1 OHEx: NaOH; KOH; NH4OH
COSTA, V; COSTA, E. 2006
BASES
. Dibases 2 OHEx: Ca(OH)2; Zn(OH)2; Fe(OH)2
. Tribases 3 OHEx: Al(OH)3; Fe(OH)3
Quanto a solubilidade em água
. Bases solúveis (metais alcalinos)
Ex:
Ex: KOH; NaOH; NH4OH
Funções
Inorgânicas
. Bases pouco solúveis
Ex: (metais alcalinos terrosos)
. Bases insolúveis (outros metais)
Ex: Fe(OH)3; Bi(OH)3
COSTA, V; COSTA, E. 2006
BASES
Quanto à força
. Base forte (metais alcalinos e alcalinos
terrosos).
Ex: NaOH; KOH; Ca(OH)2; Ba(OH)2
. Base fraca (as demais bases)
Ex: NH4OH; Fe(OH)3 e Ni(OH)3
FORMULAÇÃO DAS BASES
M(OH)y
Funções
Inorgânicas
Carga do cátion
Metal ou radical eletropositivo
NOMENCLATURA DAS BASES
Quando M tem Nox fixo
. Hidróxido de + nome do elemento.
COSTA, V; COSTA, E. 2006
BASES
Ex: KOH
Hidróxido de Potássio
NH4OH Hidróxido de Amônio
Ca(OH)2 Hidróxido de cálcio
Quando M tem Nox variável
. Hidróxido de + nome do elemento + Nox
em algarismo romano.
. Hidróxido de + nome do elemento + sufixo oso (nox menor) ou ico (maior).
Funções
Inorgânicas
Ex: CuOH Hidróxido de cobre I
ou
Hidróxido cuproso
COSTA, V; COSTA, E. 2006
BASES
Cu(OH)2 Hidróxido de cobre II
ou
Hidróxido cúprico
INDICADORES ÁCIDOÁCIDO-BASE
Indicador
Funções
Ácido
Tornassol
Rosado
Fenolftaleína
Incolor
Base
Azul
Vermelho
Alaranjado de metila Vermelho
Amarelo
Inorgânicas
COSTA, V; COSTA, E. 2006
BASES
PRINCIPAIS BASES
EMPREGADAS NA
QUÍMICA DO COTIDIANO
Hidróxido de Sódio - NaOH
. É usado no preparo de sabões, papel,
corantes e na limpeza doméstica.
Hidróxido de Cálcio - Ca(OH)2
Funções
Inorgânicas
. É obtido pela reação da cal virgem (CaO)
com água.
CaO + H2O
Cal virgem
Ca(OH)2
Cal apagada ou cal extinta
COSTA, V; COSTA, E. 2006
BASES
Hidróxido de Cálcio - Ca(OH)2
. É usado no preparo de argamassa e em
pinturas a cal.
Hidróxido de magnésio - Mg(OH)2
. É utilizado como antiácido e laxante.
Funções
Inorgânicas
COSTA, V; COSTA, E. 2006
BASES
EXERCÍCIO RESOLVIDO:
Dê o nome das seguintes Bases:
a) KOH
Hidróxido de Potássio
b) RbOH
Hidróxido de Rubídio
e) Fe(OH)2 Hidróxido Ferroso
ou
Hidróxido de Ferro II
Funções
Inorgânicas
f) Fe(OH)3 Hidróxido Férrico
ou
Hidróxido de Ferro III
COSTA, V; COSTA, E. 2006
SAIS
CONCEITO
Substância iônica que produz em
solução aquosa cátion diferente (H+) e ânion
diferente (OH-).
H2O
NaCl
Funções
Inorgânicas
Na+ + Cl-
K2SO4
H2O
2K+ + SO42-
CaCO3
H2O
Ca2+ + CO32-
FORMULAÇÃO DOS SAIS
Cátion
Ânion
[C]X+
[A]Y-
Sal
CYAX
COSTA, V; COSTA, E. 2006
SAIS
CLASSIFICAÇÃO DOS SAIS
Quanto a presença de oxigênio:
. Não oxigenados NaCl, KI ...
. Oxigenados
NaClO4, K2SO4...
Quanto ao número de elementos:
Funções
Inorgânicas
. Binários
NaCl, K2S...
. Ternários
K2SO4, Al2(SO4)3...
. Quaternários K4Fe(CN)6 ...
COSTA, V; COSTA, E. 2006
SAIS
Quanto a natureza dos íons:
. Sal Neutro ou Normal Neutralização total,
na fórmula não aparece H+ e nem OH-.
Ex: NaCl, KClO, MgCO3.
. Sal ácido ou hidrógeno-sal Neutralização
Parcial, sobram íons H+.
Ex: NaHCO3, KHSO4, KH2PO4.
Funções
Inorgânicas
. Sal básico ou hidroxi-sal Sobram íons OH-.
Ex: CaOHCl, Fe(OH)2CN.
. Sal hidratado Moléculas em proporção
definida no reticulo cristalino.
Ex: CuSO4.5 H2O (Sulfato de cobre II pentaidratado)
COSTA, V; COSTA, E. 2006
SAIS
NOMENCLATURA DOS SAIS
É obtida a partir da nomenclatura dos
ácidos trocando-se o sufixo.
Funções
Sufixo do Ácido
---ídrico
---oso
---ico
Sufixo do Ânion do Sal
---eto
---ito
---ato
Inorgânicas
COSTA, V; COSTA, E. 2006
SAIS
Sais não oxigenados:
Nome do ácido trocando-se ídrico por eto
+ de + nome do metal/radical eletropositivo.
Ex: NaCl Cloreto de sódio;
NH4Cl Cloreto de amônio.
OBS.: Nox variável, valor em algarismo
romano, após o nome do metal.
Funções
Inorgânicas
Ex: FeCl3 Cloreto de ferro III (Cloreto férrico);
FeS Sulfeto de ferro II (Sulfeto ferroso).
COSTA, V; COSTA, E. 2006
SAIS
Sais oxigenados:
Nome do ácido trocando-se oso ou ico
por ito ou ato (respectivamente) + de + nome do
metal/ radical eletropositivo.
Ex: NaNO3 Nitrato de sódio;
NaNO2 Nitrito de sódio;
CaSO4 Sulfato de cálcio.
ALGUMAS REAÇÕES DE SALIFICAÇÃO
Funções
Inorgânicas
H2SO4 + 2NaOH Na2SO4 (Sal Neutro)
Ácido
sulfúrico
Sulfato
de sódio
COSTA, V; COSTA, E. 2006
SAIS
Ex: Neutralização parcial.
. Sal ácido neutralização parcial do ácido.
H2SO4 + 1NaOH
Ácido
sulfúrico
NaHSO4 + H2O
Sulfato
ácido de
sódio
. Sal Básico neutralização parcial da base.
Funções
Inorgânicas
HCl + Ca(OH)2
Ácido
clorídrico
CaOHCl + H2O
Cloreto
básico de
cálcio
COSTA, V; COSTA, E. 2006
SAIS
PROPRIEDADE DOS SAIS
Solubilidade em água:
SAIS SOLÚVEIS
EXCEÇÕES
Nitratos (NO3-)
Cloratos (ClO3-)
Acetatos (CH3COO-)
Funções
Ag+
Cloretos (Cl)
Brometos (Br-)
Ag+ ; Pb2+ ;
(Hg2)2+ ; Hg2+
Sulfatos (SO42-)
Ca2+; Sr2+; Ba2+; Pb2+.
Inorgânicas
COSTA, V; COSTA, E. 2006
SAIS
SAIS INSOLÚVEIS
Funções
Inorgânicas
EXCEÇÕES
Fluoretos (F-)
Ag+; NH4+
Cátions da F1A
Sulfetos (S2-)
NH4+; cátions da
F1A e 2A
Sulfitos (SO32-)
Carbonatos (CO32-)
Cianetos (CN-)
Fosfatos (PO43-)
NH4+; cátions F1A
Condutividade elétrica:
. As soluções salinas são eletrolíticas.
COSTA, V; COSTA, E. 2006
SAIS
ALGUNS SAIS IMPORTANTES
Cloreto de sódio (NaCl):
. Componente do sal de cozinha;
. Obtido por evaporação da água do mar;
. Matéria prima para soda cáustica (NaOH).
Iodetos de sódio (NaI) e Potássio (KI):
. São obrigatórios por lei no sal de cozinha;
. Sua falta pode causar doença (bócio).
Funções
Inorgânicas
Fluoreto de sódio (NaF):
. Componente dos cremes dentais.
COSTA, V; COSTA, E. 2006
SAIS
Nitrato de sódio (NaNO3):
. Fabricação de fertilizantes (adubos);
. Salitre do Chile;
. Sua transformação em (KNO3) permite a
fabricação da pólvora negra.
Pólvora = KNO3 + Carvão + Enxofre
Carbonato de sódio (Na2CO3):
Funções
Inorgânicas
. Conhecido como barrilha ou soda;
. Principal aplicação, fabricação do vidro.
Barrilha + Calcário + Areia Vidro
COSTA, V; COSTA, E. 2006
SAIS
Bicarbonato de sódio (NaHCO3):
. Utilizado como antiácido estomacal;
. Fermento de pães e bolos;
. Extintores de incêndio tipo espuma.
Carbonato de cálcio (CaCO3):
. É encontrado na natureza (calcário e
mármore).
Funções
Inorgânicas
Sulfato de cálcio (CaSO4):
. O CaSO4 hidratado é utilizado como gesso,
na medicina e constr. Civil;
. O aquecimento brando do gesso produz o
giz escolar.
COSTA, V; COSTA, E. 2006
SAIS
Sulfato de magnésio (MgSO4):
. Comercializado com o nome de sal amargo;
. Aplicação medicinal com ação laxativa.
Sulfato de bário (BaSO4):
. É utilizado na medicina como contraste em
radiografia gastrintestinal.
Funções
Inorgânicas
COSTA, V; COSTA, E. 2006
ÓXIDOS
CONCEITO
. São compostos binários oxigenados.
Ex: Na2O; SO2; Fe2O3; CaO; Al2O3
. Os óxidos se dividem em dois grupos:
Óxidos moleculares
Ex: CO2; SO3; CO; Cl2O7
Funções
Inorgânicas
Óxidos iônicos
Ex: Na2O; CaO; FeO
COSTA, V; COSTA, E. 2006
ÓXIDOS
NOMENCLATURA DOS ÓXIDOS
Quando M tem Nox fixo.
. Óxido de + nome do elemento
Ex: K2O Óxido de Potássio
CaO Óxido de Cálcio
Funções
Al2O3 Óxido de Alumínio
Inorgânicas
COSTA, V; COSTA, E. 2006
ÓXIDOS
Quando M tem Nox variável
. Óxido de + nome do elemento + Nox
em Algarismos Romanos.
ou
Óxido de + nome do elemento + sufixo
ico (maior Nox) ou oso (menor)
Ex: Hg2O Óxido de mercúrio I
ou
Óxido mercuroso
Funções
Inorgânicas
HgO Óxido de mercúrio II
ou
Óxido mercúrico
COSTA, V; COSTA, E. 2006
ÓXIDOS
Outras formas de elementos com Nox variável
Mono, di ,tri...
Mono, di, tri... Óxido de ........................
.............................
Nome do elemento ligado ao oxigênio
Ex: SO2
Dióxido de (mono) Enxofre
Mn3O4 Tetróxido de trimanganês
P2O5
Funções
Pentóxido de difósforo
Cl2O3 Trióxido de dicloro
Inorgânicas
COSTA, V; COSTA, E. 2006
ÓXIDOS
CLASSIFICAÇÃO DOS ÓXIDOS
Óxidos Ácidos
. Reagem com água Ácidos
Ex: SO3 + H2O H2SO4
Funções
Inorgânicas
. Reagem com bases Sal + Água
Ex: SO3 + 2NaOH Na2SO4 + H2O
COSTA, V; COSTA, E. 2006
ÓXIDOS
ÓXIDOS BÁSICOS
. Reagem com água Bases
Ex: Na2O +H2O 2 NaOH
. Reagem com Ácidos Sal + Água
Ex: Na2O + 2 HCl 2 NaCl + H2O
ÓXIDOS ANFÓTEROS
. Reagem com Ácidos Sal + Água
Funções
Inorgânicas
Ex: ZnO + 2 HNO3 Zn(NO3)2 + H2O
. Reagem com Bases Sal + Água
Ex: ZnO + 2 NaOH Na2ZnO2 + H2O
COSTA, V; COSTA, E. 2006
ÓXIDOS
ÓXIDOS NEUTROS OU INDIFERENTES
Ex: N2O; NO; CO
ÓXIDOS DUPLOS OU MISTOS
. Dois óxidos do mesmo elemento
Ex: Fe3O4 (FeO + Fe2O3)
Pb2O3 (PbO + PbO2)
Funções
Inorgânicas
PERÓXIDOS
. Reagem com Água Base + Oxigênio
Ex: Na2O2 + 2 H2O 4 NaOH + O2
COSTA, V; COSTA, E. 2006
ÓXIDOS
. Reagem com Ácidos Sal + Água Oxigenada
Ex: Na2O2 + 2HNO3 2NaNO3 + H2O2
SUPERÓXIDOS
. Reagem com Água Base + Oxigênio
Ex: 2K2O4 + 2H2O 4KOH + 3O2
Funções
Inorgânicas
. Reagem com Ácidos Sal + Água
Oxigenada + Oxigênio
Ex: K2O4 + 2HNO3 2KNO3 + H2O2 + O2
COSTA, V; COSTA, E. 2006
ÓXIDOS
EXERCÍCIO RESOLVIDO:
1. Dê o nome dos seguintes Óxidos:
a) K2O
Óxido de potássio
b) Rb2O Óxido de Rubídio
c) BaO Óxido de Bário
d) Al2O3 Óxido de alumínio
Funções
Inorgânicas
2. Equacione as seguintes reações:
a) SO3 + 2 NaOH Na2SO4 + H2O
b) MgO +2HCl
MgCl2 + H2O
COSTA, V; COSTA, E. 2006
CONSIDERAÇÕES FINAIS
Indústria fabricação de adubos, sabões,
detergentes...
Agricultura calcário, gesso...
Preparo de soluções;
Reações químicas;
Funções
Inorgânicas
pH;
Medicina “contrastes” para raio X.
COSTA, V; COSTA, E. 2006
Funções
Inorgânicas
Erlailson Costa e Victoram Costa
[email protected]
COSTA, V; COSTA, E. 2006