Metabolismo e Endocrinologia
Teóricas: 2 e 4
Temas:
4.1. Estratégias de regulação do metabolismo.
4.2. Regulação do consumo energético. Principais hormonas reguladoras.
4.3. Vias metabólicas principais e a sua regulação.
4.4. O ciclo alimentado/jejum.
4.5. Diabetes mellitus.
Datas: 23.02.2011 e 16.03.2011
4.1. Estratégias de regulação do metabolismo
Praticamente todos os processos do nosso organismo são regulados por hormonas, sendo o sistema
neuroendócrino o responsável pelo controlo do metabolismo.
4.2. Regulação do consumo energético. Principais hormonas reguladoras.
Os níveis de glicose no sangue têm que ser mantidos em níveis restritos. A acção conjunta de
diversas hormonas, entre elas a insulina, glucagina, epinefrina e cortisol, regula a actividade do
fígado, músculo e tecido adiposo de modo a manter os níveis adequados de glicose no sangue em
situações de jejum ou pós-prandiais.
1
4.2.1. Principais hormonas reguladoras do consumo energético – Insulina
A insulina é secretada no pâncreas (ilhéus de Langerhans, células β) quando a concentração
sanguínea de glucose aumenta. Nesta situação, o metabolismo da glucose nas células β aumenta os
níveis intracelulares de ATP e leva ao fecho dos canais de potássio, ocorrendo despolarização. Em
resposta à variação do potencial, são abertos canais de cálcio controlados por voltagem e a sua
entrada na célula estimula a exocitose de vesículas de insulina que já se encontravam no meio
intracelular.
Uma vez libertada, a insulina liga-se aos receptores de insulina existentes na membrana celular,
activando-os. Esses receptores têm uma subunidade α, na qual se liga a hormona, e uma subunidade
β, onde é activada a tirosina cinase por autofosforilação. Esta enzima inicia uma cascata de
fosforilações activando ou inibindo diversas enzimas, entre as quais um grupo chamado substratos
do receptor de insulina (IRS), responsáveis pelas acções biológicas da insulina.
A insulina leva essencialmente ao armazenamento do excesso de glicose sob a forma de glicogénio e
triacilgliceróis. Para tal, contribuem diversos efeitos:
Estimulação do consumo de glicose pelo músculo e tecido adiposo e a sua conversão em
glicose-6-fosfato;
Estimulação da síntese de glicogénio no fígado e inibição da sua degradação, através da
activação da enzima glicogénio-sintetase e inibição da glicogénio fosforilase;
Estimulação da síntese de lípidos, também no fígado;
Estimulação da oxidação de glicose-6-fosfato a piruvato pela via da glicólise e da oxidação de
piruvato a acetil-CoA. O acetil-CoA pode ser oxidado para obtenção de energia ou utilizado
na síntese de lípidos e seu armazenamento sob a forma de triacilgliceróis.
Para além dos efeitos no metabolismo glicídico e lipídico, a insulina também intervém no
catabolismo proteico e na expressão genética através da:
Estimulação do transporte de aminoácidos para o meio intracelular;
2
Estimulação da tradução de mRNA, levando à síntese de proteínas;
Estimulação, ao fim de um longo período de tempo, de sequência de DNA específicas,
maioritariamente correspondentes a enzimas que intervenientes no armazenamento de
lípidos, glícidos e proteínas;
Inibição do catabolismo proteico.
A produção de insulina é regulada por um mecanismo de feedback negativo: o aumento dos níveis
de glucose no sangue leva à produção de insulina, que actua no sentido de baixar a concentração
desse açúcar. A redução da glicose é detectada pelas células β e a produção de insulina baixa. No
entanto, a glicemia não é único factor de regulação dos níveis de insulina, verificando-se que:
Alguns aminoácidos, nomeadamente arginina e lisina, potenciam o efeito da glucose na
estimulação da secreção de insulina. Evidencia-se assim o papel desta hormona no uso de aa
em excesso para a síntese proteica;
Certas hormonas gastrointestinais, como a gastrina, secretina, colecistoquininca e péptido
inibitório gástrico, actuam do mesmo modo que os aminoácidos, aumentando a sensibilidade
das células aos níveis de glucose;
O Sistema Nervoso Autónomo e outras hormonas, como glucagina, hormona do crescimento,
cortisol e até progesterona e estrogénio, estimulam directamente a secreção de insulina ou
potenciam o efeito da glucose. Quando uma destas hormonas é produzida em grandes
quantidades durante um longo período de tempo há risco de exaustão das células β e
consequente desenvolvimento de diabetes mellitus;
Epinefrina e somatostatina inibem a secreção.
4.2.2. Principais hormonas reguladoras do consumo energético – Glucagina
A glucagina também é produzida nos ilhéus de Langerhans, desta vez nas células α. Tem o efeito
contrário ao da insulina, sendo a sua produção estimulada quando os níveis de glucose se encontram
baixos. Entre os efeitos metabólicos desta hormona, que tendem a elevar a glicemia, podemos
destacar:
Estimulação da glicogenólise no fígado através da activação da glicogénio-fosforilase e
inactivação da glicogénio-sintetase;
3
Inibição da glicólise e estimulação da gliconeogénese no fígado, pela redução da
concentração de frutose-2,6-bifosfato, um inibidor alostérico da fructose 1,6-bifosfatase e
activador da fosfofrutocinase;
Inibição da enzima piruvato cinase e impedimento da conversão de fosfoenolpiruvato em
piruvato e a sua integração no ciclo de Krebs. A acumulação de fosfoenolpiruvato estimula
ainda a gliconeogénese.
Apesar de os efeitos metabólicos da glucagina serem mais acentuados no fígado, também se fazem
sentir no tecido adiposo, onde é estimulada a degradação de triacilgliceróis. Os ácidos gordos livres
são depois transportados para o fígado e outros tecidos e usados como forma de obter energia,
poupando assim a glicose para ser utilizado pelo cérebro.
Existem vários agentes reguladores da secreção de glucagina:
A glicemia é o principal factor que controla os níveis da hormona, verificando-se que uma
baixa concentração de glucose no sangue estimula a secreção;
Excesso de aminoácidos, principalmente alanina e arginina, a seguir a uma reacção proteica
estimula a secreção de glucagina e a rápida conversão dos aa em glucose. Neste caso, o
efeito da glucagina não se opõe ao da insulina, contribuindo ambas, embora por processos
diferentes, para baixar a quantidade de aminoácidos livres em circulação;
Epinefrina estimula a secreção;
Insulina e somatostatina inibem a secreção.
A activação de receptores de glucagina leva à activação da adenilato-ciclase que, por sua vez, activa
proteína-cinases. A fosforilação e, menos frequentemente, a desfosforilação de proteínas-alvo
constitui assim o principal método de actuação desta hormona.
Para além da insulina e glucagina, o cortisol e a epinefrina também desempenham um papel
importante na regulação do metabolismo energético.
O cortisol é produzido em situações de stress e actua no músculo, fígado e tecido adiposo de modo a
restaurar os níveis de glicose no sangue e/ou a aumentar as reservas de glicogénio, facilitando uma
resposta aguda a situações de fight-or-flight. Adicionalmente, estimula a lipólise no tecido adiposo e
o catabolismo proteico no músculo, utilizando ácidos gordos livres e aminoácidos como precursores
da gliconeogénese.
4
Em vez de regular a actividade de enzimas já existentes, o cortisol é uma hormona de efeito lento
que actua alterando o tipo e quantidade de certas enzimas. Já a epinefrina, apesar de também
resultar de uma resposta ao stress, actua rapidamente estimulando a secreção de glucagina e
inibindo a de insulina, impedindo assim o armazenamento de combustíveis energéticos e
promovendo a sua mobilização. De um geral, o modo de actuação da epinefrina é semelhante ao da
glucagina, mas os efeitos são mais intenso no músculo do que fígado, activando aí mecanismos de
degradação do glicogénio e triacilgliceróis.
5
4.3. Vias metabólicas principais e a sua regulação.
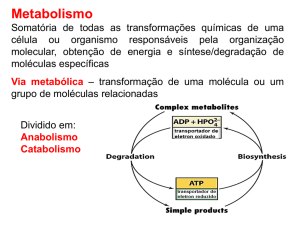
Entende-se por metabolismo o conjunto de todas as reacções
químicas que se dão dentro das células. Inclui:
Catabolismo: processos oxidativos e exergónicos nos quais
há libertação de energia pela degradação de produtos
complexos em produtos mais simples.
Ex: glicogenólise produz glicose a partir de glicogénio;
Anabolismo: processos redutivos endergónicos que
requerem o uso de energia para formar produtos complexos
a partir de moléculas mais simples.
Ex: glicogénese armazena excesso de glicose sob a forma de
glicogénio. Lipogénese armazena glicose e aminoácidos sob
a forma de lípidos.
A maioria dos processos metabólicos inclui uma série de reacções e está organizada em vias
metabólicas reguladas por enzimas. As enzimas intervenientes podem encontrar-se isolados, em
complexos multienzimáticos ou formar sistemas associados a membranas. A localização de todo o
complexo numa zona específica da célula, como uma região da membrana, permite que o processo
seja mais eficiente.
Uma via metabólica tem início num substrato específico e termina num determinado produto.
Durante todo o processo dão-se vários passos, cada um catalisado por uma enzima específica, e os
produtos de uma reacção tornam-se substratos das seguintes, pelo que se designam intermediários.
O facto de as vias estarem divididas em várias reacções permite não só que se obtenham produtos
que de forma espontânea não seria possível (acoplamento de reacções termodinamicamente
favoráveis a processos desfavoráveis), como também que se regule o calor/energia libertado e se
mantenha a temperatura da célula dentro de valores fisiológicos.
Embora as vias anabólicas e catabólicas de degradação e síntese dos mesmos compostos sejam
semelhantes, é necessário que apresentem alguns passos diferentes. Só assim se obtêm mecanismos
de regulação que permitem favorecer uma das vias e inibir a outra, e também só deste modo é que
ambas as vias podem ocorrer em simultâneo e de forma espontânea, já que se não existisse qualquer
diferença entre elas as leis do equilíbrio termodinâmico ditariam que as vias apenas se dessem num
sentido.
Enquanto as vias catabólicas convergem para poucos produtos finais as vias anabólicas divergem
para a síntese de muitas biomoléculas diferentes. Por exemplo, o catabolismo de lípidos, glícidos e
proteínas origina um intermediário comum - acetil-CoA, que é utilizado na respiração celular. Este
intermediário, por processos anabólicos, pode depois dar origem às mais variadas moléculas, desde
fosfolípidos a triglicéridos, hormonas esteróides e vitaminas.
6
Os principais passos de regulação
surgem com enzimas que só
catalisam reacções num sentido e
são activadas/desactivadas por
fosforilação/desfosforilação.
Regulação do metabolismo do
glicogénio
Regulação da
glicólise e
gliconeogénese
Regulação da
desidrogenase do
piruvato
Regulação do ciclo do
citrato
7
4.3.1. Metabolismo do glicogénio e sua regulação
A glicose em excesso é convertida em polímeros, nomeadamente glicogénio e lípidos (forma mais
abundante), tornando possível o armazenamento de grandes quantidades de glicose sem alterar
significativamente o equilíbrio osmótico das células.
O glicogénio é um polímero de glucose ramificado que se encontra essencialmente no fígado, onde é
utilizado como um reservatório de glicose para repor os seus níveis no sangue quando esta não é
disponibilizada pela dieta (ex, em jejum), e no músculo esquelético, onde funciona como uma fonte
rápida de obter a energia necessária à contracção muscular.
Devido à elevada ramificação do glicogénio, a sua degradação pode iniciar-se em diversas “pontas
soltas” e constitui assim uma forma rápida de obtenção de glicose. Para além disso, a ramificação
aumenta a densidade do composto e favorece a economia de espaço.
Os mecanismos de síntese (glicogénese) e degradação (glicogenólise) do glicogénio no fígado e
músculo esquelético são essencialmente os mesmos, variando apenas nalguns aspectos das enzimas
catalisadoras, o que se reflecte nos diferentes papeis desempenhados pelo glicogénio nesses órgãos.
O processo de glicogénese, síntese de glicogénio a partir de monómeros de glicose, tem início com a
glicose-6-fosfato. Esta pode ser obtida directamente a partir de glicose livre por acção de
hexocinases e com gasto de um ATP, ou pode seguir um caminho mais longo, sendo primeiro
transformada em lactato nos eritrócitos e de seguida levada para o fígado onde é convertida, na
gluconeogénese, em glicose-6-fosfato.
A glicose-6-fosfato é então convertida em glicose-1-fosfato por acção da enzima fosfoglicomutase, e
sob esta forma já só pode ser utilizada no metabolismo do glicogénio. Seguidamente dá-se o passo
mais importante da glicogénese: glicose-1-fosfato reage com UTP (uracilo trifosfato) e origina UDPglicose (uridina-difosfato-glucose, UDPG), por acção de glicose-1-fosfato uridil transferase. As
moléculas de UDP-glicose são então directamente utilizadas na síntese do polímero glicogénio, num
processo catalizado por glicogénio sintetase.
Para restaurar o UTP e o bifosfato PPi utiliza-se ATP e água:
Substrato
Glicose
Glicose-6-fosfato
Produto
Glicose-6-fosfato
Glicose-1-fosfato
Glicose-1-fosfato + UTP
UDP-glicose + PPi
PPi + H20
UDP-Glicose
2 Pi
Glicogénio
UDP + ATP
UTP + ADP
Balanço final
Glicogénio
Enzima
Hexocinase
Fosfoglicomutase
Glicose-1-fosfato uridil
transferase
-1 ATP
-1 UTP
Glicogénio sintetase
-1 ATP
+1 UTP
-1 ATP
8
A equação global da glicogénese é:
A glicogenólise, processo pelo qual glicogénio é degradado em glucose, é distinta da glicogénese. No
extremo não redutor da cada ramificação do glicogénio pode actuar a enzima glicogénio fosforilase e
dar origem a resíduos de glicose-1-fosfato que são convertidos em glicose-6-fosfato pela
fosfoglicomutase, enzima que também catalisa a reacção inversa que se dá na glicogénese. No
músculo esquelético, a glicose-6-fosfato entra na via da glicólise de modo a fornecer a energia
necessária à contracção muscular. No fígado o glicogénio é degradado de modo a repor os níveis de
glicose no sangue, pelo que a glicose-6-fosfato tem que ser desfosforilada antes de abandonar as
células. Isto é conseguido pela acção da enzima glicose-6-fosfatase, que apenas se encontra no
fígado e rins.
Substrato
Glicogénio
Produto
Glicose-1-fosfato
Enzima
Glicogénio fosforilase
Glicose-1-fosfato
Glicose-6-fosfato
Fosfoglicomutase
Glicose-6-fosfato
Glicose
Glicose-6-fosfatase
No músculo esquelético é
utilizada na glicólise.
Conversão ocorre apenas no
fígado e permite a reposição da
glicose sanguínea.
A equação global da glicogenólise é:
As diferenças entre a síntese e degradação de glicogénio facilitam a regulação dos dois processos. O
único ponto comum entre as duas vias é a interconversão de glicose-1-fosfato em glicose-6-fosfato,
verificando-se que a presença de UTP favorece a glicogénese pois desloca o equilíbrio da reacção no
sentido da formação de glicose-1-fosfato.
A utilização de UTP em vez de ATP confere uma regulação mais específica da glicogénese sem
interferências indesejadas, uma vez que o ATP actua em inúmeras vias, e a presença de glicose-6fosfato na célula activa a via de síntese do glicogénio.
9
No músculo, a glicogenólise é activada pela presença de Ca2+ e AMP e é inibida pela glucose-6-fosfato
e ATP. Glucagina e epinefrina activam a enzima glicogénio fosforilase e promovem a glicogenólise,
enquanto a insulina estimula a glicogénese.
4.3.2. Glicólise e gliconeogénese e sua regulação
Glicólise
A glicólise é o processo no qual uma molécula de glicose é degrada, através de 10 reacções
catalisadas enzimaticamente, e forma 2 moléculas de ácido pirúvico, um composto de 3 carbonos. É
comum a todos os organismos, não utiliza oxigénio e dá-se no citoplasma.
Pode dividir-se em 3 fases:
Fase 1 (fase de activação): fosforilação da glicose com consumo de 2 ATP;
o Reacção 1: fosforilação da glicose em glicose-6-fosfato com gasto de 1 ATP. Enzima
interveniente: hexoquinase (ou glicoquinase);
o Reacção 2: isomerização da glicose-6-fosfato em frutose-6-fosfato. Enzima
interveniente: fosfohexose isomerase;
o Reacção 3: fosforilação da frutose-6-fosfato em frutose-1,6-bifosfato com gasto de 1
ATP. Enzima interveniente: fosfofrutocinase-1 sujeita a regulação alostérica;
Fase 2 (fase de clivagem): formação de 2 moléculas de gliceraldeído-3-fosfato;
o Reacção 4: cisão da frutose-1,6-bifosfato em gliceraldeído-3-fosfato e no seu isómero
di-hidroxiacetona-fosfato. Enzima interveniente: aldose;
o Reacção 5: isomerização de di-hidroxiacetona-fosfato em gliceraldeído-3-fosfato.
Enzima interveniente: triose-fosfato isomerase;
10
Os dois produtos da cisão são interconvertíveis e estão em equilíbrio químico,
equilíbrio este que vai sendo deslocado no sentido do gliceraldeído-3-fosfato uma
vez que a glicólise prossegue por este composto. Assim, por cada molécula de
glicose, formam-se duas moléculas de gliceraldeído-3-fosfato;
Fase 3: oxidação de cada gliceraldeído-3-fosfato (GAP) em ácido pirúvico e formação, no
total, de 4 ATP e 2 NADH+H+. As reacções seguintes referem-se a cada molécula de
gliceraldeído-3-fosfato;
o Reacção 6: oxidação e fosforilação do gliceraldeído-3-fosfato em ácido 1,3difosfoglicérico com redução de NAD a NADH + H+. Enzima interveniente:
gliceraldeído-3-fosfato desidrogenase;
o Reacção 7: conversão do 1,3-difosfoglicerato em 3-fosfoglicerato com síntese de 1
ATP. Enzima interveniente: fosfoglicerato-cinase;
o Reacção 8: isomerização do ácido 3-difosfoglicérico em ácido 2-fosfoglicérico. Enzima
interveniente: fosfoglicerato-mutase;
o Reacção 9: desidratação do ácido 2-fosfoglicérico em fosfoenolpiruvato. Enzima
interveniente: enolase;
o Reacção 10: conversão de fosfoenolpiruvato em piruvato (ácido pirúvico) com síntese
de 1 ATP. Enzima interveniente: piruvato-cinase;
1
2
3
Substrato
Glucose
Glucose-6-fosfato
Frutose-6-fosfato
4
Frutose-1,6-bifosfato
5
di-hidroxiacetona-fosfato
6
(2) Gliceraldeído-3-fosfato
7
8
9
10
(2) 1,3-bifosfoglicerato
(2) 3-fosfoglicerato
(2) 2-fosfoglicerato
(2) Fosfoenolpiruvato
Balanço Final:
Produto
Glucose-6-fosfato
Fructose-6-fosfato
Frutose-1,6-bifosfato
Gliceraldeído-3fosfato +
di-hidroxiacetonafosfato
Gliceraldeído-3fosfato
(2) 1,3bifosfoglicerato
(2) 3-fosfoglicerato
(2) 2-fosfoglicerato
(2) Fosfoenolpirtuvato
(2) Piruvato
2 Piruvato
Enzima
Hexoquinase
Fosfohexose isomerase
Fosfofrutocinase-1
ATP
-1
0
-1
NADH
0
0
0
Aldose
0
0
triose-fosfato isomerase
0
0
0
2x1
2x1
0
0
2x1
2
0
0
0
0
2
gliceraldeído-3-fosfato
desidrogenase
fosfoglicerato-cinase
fosfoglicerato-mutase
Enolase
Piruvato-cinase
11
12
A equação global da glicólise é:
O produto final da glicólise é o ácido pirúvico, ou piruvato, que vai depois ser utilizado na respiração
celular: em condições anaeróbicas (ausência de oxigénio) ocorre fermentação. Há vários tipos de
fermentação, cada um com produtos finais diferentes, mas em todos os casos o balanço final de ATP
é sempre de 2 moléculas; em condições aeróbias o piruvato é convertido em acetil-CoA para que
possa integrar o Ciclo de Krebs e permitir a síntese de maiores quantidades de ATP (cada volta do
ciclo contribui para a síntese de 10 ATP).
Uma vez que a quantidade de NAD+ presente nas células é muito reduzida, o NADH formado no
passo 6 tem de voltar a ser oxidado. Esta oxidação pode ser efectuada de quatro formas: em
anaerobiose, redução do ácido pirúvico a ácido láctico – fermentação láctica; transformação do
ácido pirúvico em etanol – fermentação alcoólica; ou redução da di-hidroxiacetona-fosfato a
glicerol. Esta última via exige que esteja a decorrer a oxidação de outras moléculas de glicose
(glicólise) na célula, para utilizar a di-hidroxiacetona-fosfato que assim não formará gliceraldeído-3fosfato não dando seguimento ao processo; em aerobiose a oxidação é feita pelo sistema
transportador de electrões (STE) que se situa na mitocôndria;
(Nota: O glicerol formado pela redução da di-hidroxiacetona-fosfato é uma das ligações principais
entre os metabolismos glucídico e lipídico.)
Os intermediário fosforilados dos diversos passos da glicólise têm 3 funções principais:
As membranas plasmáticas, de um modo geral, não têm transportadores para açúcares
fosforilados pelo que os intermediários que contêm grupos fosfatos são retidos no interior
das células sem necessidade de gastar energia, apesar do grande gradiente de concentrações
que existe entre os meios intra e extra-celulares;
Constituem grupos de união ou reconhecimento na formação de complexos enzimasubstrato;
Possibilitam a conservação de energia, indispensável à formação de ATP.
Gliconeogénese
A gliconeogénese, ou neoglucogénese, é via metabólica que conduz à síntese de glicose a partir de
ácido pirúvico ou outros compostos de 3 ou 4 carbonos, como lactato, ácidos gordos e até alguns
aminoácidos (ex. alanina). Ocorre principalmente no fígado e no córtex renal, embora em menor
extensão, e dá-se em organitos celulares diferentes da glicólise.
Durante o exercício físico intenso verifica-se frequentemente a acumulação de lactato nos músculos,
devido à realização de fermentação láctica para rápida obtenção de energia. Como esta molécula é
muito solúvel entra em circulação e é transportada até ao fígado, onde vai ser utilizada na
gliconeogénese. O lactato é então regenerado em glicose (este processo tem um custo energético
mas o balanço final, com a disponibilização de glicose, é positivo) e entra de novo em circulação,
13
podendo ser utilizada no músculo para a reposição dos níveis de glicogénio durante o repouso. A
este ciclo, glicose-lactato-glicose, dá-se o nome de Ciclo de Cori.
Em jejum pode ocorrer gliconeogénese a partir de aminoácidos, como a alanina. No fígado, estes são
convertidos em piruvato, que é utilizado na síntese de glicose, e é libertada amónia, que é excretada
sob a forma de ureia.
Apesar de a maioria das reacções da gliconeogénese serem inversas às da glicólise, algumas, que por
razões de ordem termodinâmica não são reversíveis, variam. Nesses casos, as reacções são
catalisadas por enzimas diferentes e constituem os principais pontos de regulação das duas vias.
Os passos alterados são:
(Reacção 10 da glicólise) fosforilação de piruvato em fosfoenolpiruvado (PEP).
Piruvato é transportado do citoplasma para a mitocôndria ou é aí gerado a partir de alanina
(por uma reacção de transaminação). O piruvato é então convertido em oxaloacetato por
acção da enzima piruvato carboxilase e com recurso a 2 ATP e a CO2. O oxoacelato, que
também pode provir do ciclo de Krebs, tem que ser reduzido a malato para poder ser
transportado de novo para o citoplasma (essa conversão é feita pela enzima malato
desidrogenase) onde vai ser finalmente convertido em fosfoenolpiruvato pela PEP
carboxicinase, com recurso a 2 GTP (guanina trifosfato).
14
Quando o lactato é o principal precursor da glicose na gliconeogénese é comum ocorrer a
sua conversão em piruvato, pela lactato desidrogenase e com redução de NAD+, ainda no
citoplasma. Já na mitocôndria, o piruvato é convertido em oxaloacetato e este, por sua vez, é
logo transformado em PEP por acção da PEP carboxicinase mitocondrial e com libertação de
CO2.
A última via tem a vantagem de não ser necessário o transporte de NADH para fora da
mitocôndria. Contudo, a importância de cada via depende tanto da disponibilidade de lactato
como da necessidade de NADH por parte da célula.
(Reacção 3) desfosforilação da frutose-1,6-fosfato em frutose-6-fosfato;
(Reacção 1) desfosforilação da glicose-6-fosfato em glicose.
Não há formação de ATP, dá-se apenas uma reacção de hidrólise.
A regulação da neoglucogénese está relacionada com a regulação da glicólise:
Quando a glicólise está em funcionamento, a gliconeogénese não está a realizar-se;
Quando o estado energético da célula é elevado a glicólise deve ser inibida e o piruvato,
entre outros, deve ser utilizado para a síntese e armazenamento de glucose;
Quando o estado energético da célula é baixo a glucose deve ser rapidamente degradada de
modo a fornecer energia;
Os passos regulados da glicólise são os mesmos passos que são regulados na gliconeogénese;
Seguem-se alguns exemplos mais específicos do mecanismo de regulação da gliconeogénese:
Glucagina, hormona que leva à fosforilação de enzimas e induz a sua síntese, estimula a
gliconeogénese;
15
O processo depende da disponibilidade de substrato, nomeadamente da presença de
aminoácidos glicogénicos devido a níveis diminuídos de insulina;
A enzima piruvato carboxilase é activada alostericamente pela presença de acetil-CoA. AcetilCoA está relacionado com o metabolismo dos lípidos e é um indicador de que a célula tem
fontes de energia disponíveis sob a forma de outros substratos que não a glicose, como
ácidos gordos;
AMP estimula vias que oxidam nutrientes fornecendo energia às células;
4.3.3. Regulação da desidrogenase do piruvato
O complexo enzimático piruvato-desidrogenase (PDH), responsável pela conversão do piruvato em
acetil-CoA, é regulado alostericamente, verificando-se a sua inibição quando existem ácidos gordos e
acetil-CoA disponíveis e quando os rácios [ATP]/[ADP] e [NADH]/[NAD+] são elevados. Por outro lado,
o PDH é activado em situações de carência energética por parte a célula, nas quais concentrações de
metabolitos como AMP, CoA e NAD+ se encontram elevadas.
O complexo está ainda sob a acção de mecanismos de regulação covalente, sendo inibido pela
fosforilação reversível de um dos seus resíduos de serina quando [ATP] é elevada e sendo, caso
contrário, activado por desfosforilação.
4.3.4. Ciclo do citrato (ciclo de Krebs) e sua regulação
O ciclo de Krebs, ou ciclo do ácido cítrico, dá-se na matriz mitocondrial e consiste na oxidação de
acetil-CoA a CO2 com libertação de energia sob a forma de electrões, que é armazenada em NADH e
FADH2, moléculas transportadoras de electrões.
A acetil-CoA é o produto de diversas vias metabólicas mas, como vimos anteriormente, não é um
produto final da glicólise. Para que o ácido pirúvico possa integrar o ciclo de Krebs é necessário um
passo preparatório em que o piruvato é convertido em acetil-CoA por acção do complexo piruvatodesidrogenase.
16
Na respiração aeróbia, após a etapa da glicólise o ácido pirúvico entra nas mitocôndrias e, ao nível da
matriz mitocondrial, sofre 3 reacções que culminam na formação de acetil-CoA:
1. Descarboxilação: é removido um carbono ao ácido pirúvico. Forma-se acetaldeído e dióxido
de carbono;
2. Oxidação: são removidos dois H ao acetaldeído. Forma-se ácido acético e reduz-se NAD+ a
NADH+H+;
3. Formação de acetil-CoA: o ácido acético combina-se com uma coenzima A e forma-se
acetilcoenzima A.
O acetil-CoA vai agora integrar o Ciclo de Krebs, que tem 8 passos:
1. Formação de citrato: condensação de acetil-CoA com o ácido oxaloacético. Há transferência
do grupo acetilo e libertação da coenzima A. Enzima interveniente: citrato sintetase;
2. Formação de ácido isocítrico pela transferência do grupo OH da posição 3 para a posição 4.
Enzima interveniente: aconitase;
3. Oxidação do isocitrato a ácido α-cetoglutárico com libertação de NADH ou NADPH e CO2.
Enzima interveniente: isocitrato desidrogenase;
4. Oxidação do ácido α-cetoglutárico a succinil-CoA. Libertação de CO2 e produção do cofactor
NADH. Enzima interveniente: complexo α-cetoglutarato desidrogenase;
5. Hidrólise de succinil-CoA a ácido succínico com síntese de ATP. Enzima interveniente:
succinil-CoA sintetase;
6. Oxidação de succinato a ácido fumárico com libertação de FADH2. Enzima interveniente:
succinato desidrogenase;
7. Hidratação do ácido fumárico a ácido málico. Enzima interveniente: fumarase;
8. Oxidação do ácido malático a ácido oxaloacético. Enzima interveniente: malato
desidrogenase.
1
2
3
Substrato
Acetil-CoA + Oxaloacetato
Citrato
Isocitrato
Produto
Citrato
Isocitrato
α-cetoglutarato + CO2
4
α-cetoglutarato
Succinil-CoA + CO2
5
6
7
8
Succinil-CoA
Succinato
Fumarato
Malato
Succinato
Fumarato
Malato
Oxaloacetato
Enzima
Citrato sintetase
Aconitase
Isocitrato desidrogenase
Complexo α-cetoglutarato
desidrogenase
Succinil-CoA sintetase
Succinato desidrogenase
Fumarase
Malato desidrogenase
1 NADH
1 NADH
1 ATP
1 FADH2
1 NADH
17
Balanço Final:
3 NADH + 1 FADH2 + 1 ATP + 2 CO2
Cada acetil-CoA contribui para a produção de 10 ATP:
É de notar que cada molécula de glicose permite a formação de duas moléculas de acetil-CoA.
Balanço no final do Ciclo de Krebs
Glicólise
Obtenção de acetil-CoA
Ciclo de Krebs
Por molécula de glicose
ATP NADH+H+ FADH2
2
2
2
2
6
2
4
10
2
CO2
2
4
6
Cada molécula de glicose contribui assim para a produção de 32 ATP:
18
A regulação do ciclo de Krebs dá-se a diversos níveis:
o Conversão de piruvato a acetil-CoA pelo complexo piruvato-desidrogenase (PDH);
o Entrada de acetil-CoA no ciclo através da reacção catalisada pela citrato sintetase. Este passo
depende da disponibilidade dos substratos oxaloacetato e acetil-CoA, cuja concentração
varia de acordo com o estado metabólico das células. Verifica-se ainda que a
disponibilidade do produto citrato, de ATP, NADH e de succinil-CoA atrasa o ciclo e que
ADP, activador alostérico da enzima, reverte esse efeito;
o A isocitrato desidrogenase é inibida na presença de ATP e activada por ADP e Ca2+. De modo
semelhante, o complexo α-cetoglutarato desidrogenase é activado por Ca2+, libertado no
músculo durante a contracção. A sua inibição dá-se pelos produtos succinil-CaA e NADH.
19
4.3.5. Regulação do metabolismo de TAG (triacilgliceróis) e ácidos gordos
O nível de ácidos gordos livres na corrente sanguínea é regulado por hormonas e reflecte o balanço
entre a hidrólise e a síntese de triacilgliceróis. Quando a mobilização de AG é necessária para
produzir energia, epinefrina e glucagina estimulam a libertação de triacilgliceróis das células adiposas
e a sua hidrólise. Simultaneamente, estas hormonas diminuem o ritmo da glicólise e aumentam o da
gliconeogénese no fígado, providenciando glicose aos tecidos, especialmente ao cérebro. Os ácidos
gordos livres são transportados para inúmeros tecidos, onde são oxidados, e para o fígado, onde são
reciclados à sua forma de reserva, os triacilgliceróis, regressando depois ao tecido adiposo, mesmo
durante períodos de fome.
20
4.3.6. Outras vias metabólicas
Via dos fostatos de pentose (via das fosfopentoses ou das hexoses monofosfato)
A via das fosfopentoses é um caminho aeróbio alternativo à glicólise para a glicose-6-fosfato, e é
responsável pela degradação de mais de 30% desta molécula no fígado e nas células adiposas. Esta
via oxidativa tem como substrato inicial a glicose-6-fosfato, o NADP+ como aceitador de electrões e,
como produtos, NADPH e ribose-5-fosfato, uma pentose utilizada na síntese de ácidos nucleicos.
Esta via é especialmente importante porque permite a formação de pentoses, utilizadas na síntese
de ácidos nucleicos; e a produção de NADPH, o transportador de electrões utilizado na biossíntese
de lípidos e outras substâncias. Este transportador é ainda responsável não só por manter um
ambiente intra-celular redutor e prevenir os efeitos prejudiciais do oxigénio radicalar (cancerígeno,
reage com o DNA), mas também pelas reacções de oxidação-redução necessárias á polihidroxilação
de substâncias a serem excretadas pelo sistema p450 (a moléculas insolúveis são adicionados grupos
OH, tornando-as assim solúveis e capazes de serem excretadas pelo sistema urinário. É o principal
método de excreção de medicamentos).
Outra importância do NADPH tem que ver com o sistema imunitário: não temos um sistema muito
específico de eliminação de microorganismos, pelo que, quando se forma uma vesícula fagocítica,
desencadeia-se uma “guerra química”, ou seja, acidifica-se todo o conteúdo e depois envia-se
oxigénio, que vai ficar radicalar devido à acção do NADPH, reagindo depois com tudo o que
encontrar, eliminando então o microorganismo. O NADPH intervém ainda na formação de óxido
nítrico, que intervém numa série de processos importantes.
A via das pentoses-fosfato possibilita ainda a produção de energia independentemente do ciclo de
Krebs (NADPH pode entrar directamente na cadeia transportadora de electrões), constituindo assim
um caminho alternativo para obtenção de energia metabólica quando existem problemas com os
sistemas enzimáticos deste ciclo. No entanto, a produção de ATP não é o objectivo principal desta via
e geralmente só ocorre quando os níveis de ATP são muito baixos, uma vez que a glicólise consome
inicialmente está molécula a via das fosfopentoses não.
Tecidos em rápido crescimento ou que tenham uma elevada actividade biossintética de ácidos
gordos, colesterol ou hormonas esteróides necessitam dos ácidos nucleicos e do poder redutor
providenciados pela via das fosfopentoses, pelo que uma maior quantidade de glicose-6-fosfato é
desvia para esta via em relação a outros tecidos.
Esta via corresponde a um ciclo e compreende uma série de reacções maioritariamente reversíveis e
pode dividir-se em duas fases:
Fase oxidante: glucose-6-fosfato é oxidada a ribose-5-fosfato com formação de NADPH;
1. Oxidação da glucose-6-fosfato a 6-fosfoglucono-δ-lactona com redução de 1 NADP+.
Enzima interveniente: glucose-6-fosfato-desidrogenase;
2. Hidrólise da 6-fosfoglucono-δ-lactona a 6-fosfogluconato (ácido-6-fosfoglucónico).
Há consumo de uma molécula de água. Enzima interveniente: lactona;
3. Descarboxilação do 6-fosfogluconato a ribulose-5-fosfato com formação de uma
molécula de NADPH e libertação de um CO2. Enzima interveniente: 6fosfogluconato-desidrogenase;
21
Fase não oxidante: reciclagem de 6 moléculas de ribulose-5-fosfato a 5 moléculas de glicose6-fosfato;
1. Epimerização (um tipo de isomerização) da ribulose-5-fosfato a xilulose-5-fosfato. Enzima
interveniente: ribulose-5-fosfato-epimerase;
Isomerização de ribulose-5-fosfato a ribose-5-fosfato. Enzima interveniente:
fosfopentose-isomerase. (Esta reacção nem sempre ocorre).
2. Transcetolisação (transferência de grupos com 2 átomos de carbono) de xilulose-5-fosfato
(5C) e ribulose-5-fosfato (5C) a gliceraldeído-3-fosfato (3C) e sedo-heptulose-7-fosfato
(7C). Enzima interveniente: transcetolase;
3. Transaldolisação (transferência de grupos com 3 carbonos) de gliceraldeído-3-fosfato (3C)
e sedo-heptulose-7-fosfato (7C) a eritrose-4-fosfato (4C) e frutose-6-fosfato (6C). Enzima
interveniente: transaldose;
4. Transcetolisação de xilulose-5-fosfato (5C) e eritrose-4-fosfato (4C) a gliceraldeído-3fosfato (3C) e frutose-6-fosfato (6C). Enzima interveniente: transcetolase;
As reacções 2 a 4 ocorrem em duplicado.
5. Conversão de 2 gliceraldeído-3-fosfato (3C) em frutose-6-fosfato (6C). Enzimas
intervenientes: aldose e frutose-1,6-difosfatase;
O gliceraldeído-3-fosfato também pode reagir fora do ciclo e formar piruvato.
6. Isomerização de 6 frutose-6-fosfato (6C) em 5 glucose-6-fosfato (6C). Enzima
interveniente: fosfo-hexose-isomerase.
A equação global da via das fosfopentoses é:
Substrato
Fase Oxidante
Produto
Enzima
NADPH
(6) glucose-6-fosfato
(6) 6-fosfoglucono-δlactona
glucose-6-fosfatodesidrogenase
6x1
(6) 6-fosfoglucono-δlactona - H20
(6) 6-fosfogluconato
Lactona
(6) 6-fosfogluconato
(6) ribulose-5-fosfato +
CO2
fosfogluconatodesidrogenase
6x1
Fase não oxidante
ribulose-5-fosfato
(2) Ribulose-5-fosfato +
xilulose-5-fosfato
ribose-5-fosfato
fosfopentose-isomerase
(2) gliceraldeído-3-fosfato Transcetolase
+ sedo-heptulose-7fosfato
(2) gliceraldeído-3-fosfato (2) eritrose-4-fosfato +
Transaldolase
+ sedo-heptulose-7frutose-6-fosfato
fosfato
(2) xilulose-5-fosfato +
(2) gliceraldeído-3-fosfato Transcetolase
eritrose-4-fosfato
+ frutose-6-fosfato
(2) gliceraldeído-3-fosfato frutose-6-fosfato
aldose e frutose-1,622
(6) frutose-6-fosfato
Balanço final
(5) glucose-6-fosfato
(5) glucose-6-fosfato
difosfatase
fosfo-hexose-isomerase
12
A regulação da via das fosfopentoses está intrinsecamente ligada ao ritmo de síntese de lípidos e
proteínas:
Se a síntese de proteínas predomina sobre a dos lípidos o organismo requer maior
quantidade de ribose-5-fosfato do que de NADPH pelo que é privilegiada a fase não oxidante
da via. Frutose-6-fosfato e gliceraldeído-3-fosfato provenientes da glicólise são
transformados em ribose-5-fosfato sem formação de NADPH;
Quando a necessidade de consumo de glicose é baixa, nomeadamente quando a razão
[ATP]/[ADP] é elevada, a enzima fosfofrutocianase-1 da glicólise é inibida e a biossíntese de
lípidos ganha relevância, tornando-se necessário ter uma maior quantidade de NADPH
disponível para converter acetil-CoA em cadeias de ácidos gordos. Deste modo, a fase
oxidante da via, onde se produz NADPH, é favorecida (principalmente no fígado), ajudando
ainda à degradação do excesso de glicose.
Catabolismo de Aminoácidos e Ciclo da Ureia
Os aminoácidos têm como principal função a síntese proteica, podendo ainda sofrer processos
oxidativos e ser utilizados como fonte de energia. A degradação de aminoácidos dá-se quando se
verifica uma das condições metabólicas seguintes:
23
Durante a síntese e degradação proteica normais os aminoácidos provenientes da
degradação que não são necessários para a síntese de novas proteínas sofrem degradação
oxidativa;
Numa dieta rica em proteínas são ingeridos mais aminoácidos do que os necessários à
síntese proteica. Os aa excedentes são degradados;
Durante períodos de fome ou de diabetes descontrolados, quando o organismo entra em
carência energética por não existirem hidratos de carbono disponíveis ou estes não estarem
a ser utilizados correctamente, a degradação de aminoácidos é utilizada como forma de
obter energia metabólica.
A degradação oxidativa de aminoácidos ocorre maioritariamente no fígado (também se pode dar no
músculo) e leva à formação de amónia, que é excretada pelo ciclo da ureia, e de vários
intermediários, conforme o aminoácido degradado, das principais vias metabólicas. Como todos os
aa têm um grupo amina, o passo inicial da degradação é comum a todas as moléculas. Esse passo
consiste na remoção do grupo α-amina e ocorre geralmente em duas etapas:
1. Transaminação: o grupo α-amina de um aminoácido é transferido para o carbono-α do αcetoglutarato, numa reacção catalisada pela enzima aminotransferase. O esqueleto de
carbono do aa dá origem a um α-cetoácido (que usualmente é um intermediário numa outra
via metabólica) e o α-cetoglutarato forma glutamato, ou ácido glutâmico. Esta reacção dá-se
no citosol dos hepatócitos.
Nota: a um aminoácido sem o grupo amina chama-se cetoácido.
Exemplo de reacções de transaminação:
2. Desaminação oxidativa: depois de transportado para o interior da mitocôndria, a enzima
glutamato desidrogenase remove o grupo amina ao glutamato, restaurando o αcetoglutarato e libertando amónia. Esta reacção dá-se com a redução de NAD+/NADP+ a
NADH/NADPH e o sentido directo é favorecido devido à rápida eliminação da amónia.
Nota: a glutamanto desidrogenase é a única enzima que utiliza NAD+ e NADP+
indiferentemente.
24
Os esqueletos de carbono dos aminoácidos são convertidos em intermediários metabólicos e, de
acordo com o ciclo que esse intermediário vai integrar, os aa podem ser classificados em:
Aminoácidos cetogénicos: dão origem a intermediários de corpos cetónicos;
Aminoácidos glucogénicos: dão origem a intermediários na formação de glicose.
É de salientar que um mesmo aa pode ser simultaneamente cetogénico e glucogénico, como é o caso
da tirosina e da fenilalanina.
A degradação de aminoácidos aromáticos, como a fenilalanina e a tirosina, origina a formação de
fumarato e acetoacetato. Na primeira fase de degradação da fenilalanina, este aminoácido é
transformado em tirosina e estes seguem de seguida uma via de oxidação comum. Quando a
conversão é deficiente desenvolvem-se níveis elevados de fenilalanina no sangue, uma condição
denominada fenilcetonúria. A acumulação deste aa ou dos seus metabolitos pode comprometer o
normal desenvolvimento do cérebro e causar danos cerebrais irreversíveis e subsequente retardação
mental. Estes danos manifestam-se cedo, pelo que é necessário um tratamento logo após o
nascimento. O tratamento aplicado baseia-se geralmente num controlo rigorosa da dieta alimentar
de modo a que apenas sejam consumidas quantidades suficientes de fenilalanina e tirosina para
satisfazer a síntese proteica.
Para além de intermediários metabólicos, a degradação de aminoácidos também origina NH3.
O excesso de amónia é tóxico para os tecidos, podendo levar a danos cerebrais irreversíveis e morte.
É por isso necessária uma estreita regulação dos seus níveis no sangue, que é conseguida pela
sequestração de amónia na mitocôndria a seguir à desaminação, pela excreção do seu excesso e pela
sua conversão em compostos não tóxicos.
A amónia pode ser excretada directamente na forma NH4+ (muitos animais aquáticos), na forma de
ácido úrico (aves e repteis) ou na forma de ureia, como é o caso do Homem.
O ciclo da ureia, também chamada ureogénese, decorre exclusivamente no fígado e permite a
conversão de amónia em ureia, um composto não tóxico que é posteriormente enviado aos rins pela
circulação sanguínea e excretado na urina.
25
Na matriz mitocondrial, a amónia é transformada em fosfato de carbamoilo numa reacção
irreversível dependente de 2 ATP, catalisada pela enzima fosfato de carbamoilo-sintetase I (CSPI) e
que utiliza o CO2, sob a forma de HCO3-, proveniente da respiração celular.
O fosfato de carbamoilo integra o ciclo da ureia, que consiste em 4 passos:
1. Transferência do grupo carbamoilo (H2NCO) do fosfato de carbamoilo à ornitina para formar
citrulina. Esta reacção é catalisada pela orinitina-transcarbamilase e dela resulta a libertação
de um fosfato inorgânico. Transportadores específicos asseguram a passagem da citrulina da
mitocôndria para o citosol;
2. Condensação da citrulina com aspartato (formado na mitocôndria por transaminação e
transportado para o citosol) de forma a dar arginiosuccinato, ou ácido arginosuccínico. A
enzima interveniente é a arginosuccinato-sintetase e há intervenção de ATP e posterior
hidrólise do pirofosfato, de onde resulta AMP;
3. Clivagem do arginiosuccinato em arginina e fumarato, por acção da arginosuccinase.
Posteriormente, o fumarato entra na mitocôndria e integra o ciclo do ácido cítrico. Este é o
único passo reversível de todo o ciclo da ureia.
Nota: na deficiência da enzima arginosuccinase, a suplementação da deita alimentar com
arginina possibilita a formação de ornitina e a sua reacção com carbamoilo fosfato. No
entanto, deste modo dificulta-se em parte a excreção do excesso de amónia pois não se
forma o intermediário fumarato;
4. Clivagem da arginina em ureia e ornitina pela enzima arginase. A ornitina é transportada
para o interior da mitocôndria onde pode dar inicio a um novo ciclo.
Substrato
Fosfato de Carbamoilo + Ornitina
Citrulina + Aspartato + ATP
Arginiosuccinato
Arginina
Produto
Citrulina + Pi
Arginiosuccinato + AMP
Arginina + Fumarato
Ureia + Ornitina
Enzima
Orinitina-ranscarbamilase
Arginosuccinato-sintetase
Arginosuccinase
Arginase
O ciclo da ureia, por si só, constitui um elevado gasto de energia apesar de ser a principal via de
excreção da amónia - por molécula de amónia são gastos 2 ATP na formação de fosfato de
carbamoilo e 1 ATP no ciclo. A diminuição deste custo energético faz-se através da interligação com
o ciclo de Krebs, que assegura a produção de NADH e sua utilização para produção de ATP por
fosforilação oxidativa.
26
O fumarato produzido pela clivagem da arginina e malato (no citosol, pode dar-se a conversão de
fumarato em malato) podem ser transportados para o interior da mitocôndria e integrar o ciclo do
Krebs, do qual são intermediários. Adicionalmente, o oxaloacetato pode reagir com glutamato, numa
reacção de transaminação, e originar aspartato que é transportado para o citosol e vai integrar o
ciclo da ureia. A este conjunto de reacções interligadas dá-se o nome de bomba de aspartatoargininosuccinato.
Defeitos metabólicos no ciclo da ureia levam ao bloqueio desta via, elevando a quantidade de
amónia no organismo. Tal pode ser combatido através da limitação da ingestão de proteínas,
suplementação alimentar de produtos que permitam a sua excreção (benzoato ou fenilbutirato) e de
intermediários do ciclo da ureia.
Em situações de exercício prolongado ou em jejum, para além do fígado, o músculo pode degradar
aminoácidos como forma de obter energia. Porém, não expressa as enzimas do ciclo da ureia e,
portanto, não procede à eliminação da amónia. Para evitar os efeitos adversos da toxicidade desta
substância, o músculo recorre ao ciclo da alanina-glucose.
No ciclo da alanina-glucose o glutamato formado na degradação de aa reage com piruvato
proveniente da glicólise e, por transaminação, origina alanina e α-cetoglutarato. A alanina é
transportada pela corrente sanguínea até ao fígado onde, no citosol dos hepatócitos, reage de novo
com a alanino-transferase e forma piruvato e glutamato. O glutamato entra nas mitocôndrias e
integra a ciclo da ureia, enquanto o piruvato é aproveitado para a gluconeogénese, possibilitando a
síntese de glicose que vai ser levada até ao músculo e aproveitada para a produção de ATP e de
piruvato, reiniciando o ciclo. Deste modo, elimina-se a amónia em excesso e o gasto energético
necessário à gluconeogénese é suportado inteiramente pelo fígado, garantindo-se que todo o ATP
disponível no músculo é aproveitado para a contracção.
Para além da alanina, existe um outro transportador de azoto importante para a destoxificação da
amónia produzida nos tecidos extra-hepáticos. Esse transportador é a glutamina e forma-se a partir
de glutamato por acção da glutamina-sintetase. Para além de poder ser levado para o fígado onde vai
27
integrar o ciclo da ureia, este transportador pode ser enviado para o rim, onde a amónia é
directamente excretada pela urina.
4.4. Ciclo Alimentado/Jejum
No decorrer de uma alimentação normal um indivíduo passa por fases de jejum, durante as quais não
ingere alimentos, e por fases alimentadas, a seguir à ingestão de alimentados. A sequência entre
estas fases dá origem ao ciclo alimentado/jejum, ao longo do qual a natureza das respostas
metabólicas do organismo vai variando: durante a fase alimentada (absortiva ou pós-prandial)
predominam os efeitos da insulina. Já na fase de jejum (ou prandial), é principalmente a glucagina
que controla o metabolismo energético.
28
O período alimentado caracteriza-se por diversos factos, entre os quais:
− Aumenta a fosforilação da glicose a glicose-6-fosfato, no fígado, estimulando a glicólise, a
glicogénese e a via das fosfopentoses (fornece NADPH para a síntese de lípidos);
− Aumenta o transporte de glicose para o interior dos adipócitos (transportadores são insulinodependentes) e a síntese de ácidos gordos. Juntamente com os trazidos pelas quilomicras e
VLDL’s, os AG são utilizados na síntese de triacilgliceróis;
− São sintetizadas proteínas previamente degradadas no músculo durante o jejum;
− Glicose entra no músculo (transportadores são insulino-dependentes) e é utilizada para a
obtenção de energia e síntese de glicogénio;
− Durante este período, de todos os combustíveis energéticos em circulação, apenas a glicose
atravessa a barreira hemato-encefálica e fornece energia ao cérebro.
29
Durante o período de jejum predomina a hormona glucagina sobre a insulina e as prioridades do
organismo são a manutenção da glicemia para utilização pelos tecidos que não dependem de
insulina, o fornecimento de substratos energéticos alternativos aos tecidos insulino-dependentes e a
manutenção da homeostasia energética do sistema nervoso central. Para atingir estes fins recorre-se
a várias reservas energéticas:
− Glicogénio hepático e muscular, em pequenas quantidades, a partir do qual se obtém glicose
após glicogenólise;
− Triacilglicerol do tecido adiposo, em grande quantidade, para utilização como ácidos gordos
livres, ou após β-oxidação e síntese de corpos cetónicos no fígado;
− Proteínas, principalmente musculares, para utilização dos aminoácidos como substrato da
gliconeogénese hepática.
A homeostase da glicose durante o jejum pode ser dividida em 5 fases:
− Fase I: até 3-4h de jejum
o Glicose exógena (proveniente da alimentação) é utilizada por todos os tecidos;
o A glicemia vai baixando e pode ser mobilizado glicogénio hepático;
o Praticamente não se verifica a lipogénese.
− Fase II, jejum imediato: 3-10h
o Glicemia já desceu um pouco;
o Secreção de insulina diminui e a de glucagina aumenta;
o Glicogenólise e, seguidamente, gliconeogénese hepáticas fornecem glicose aos
tecidos que dela dependem;
o Há diminuição do consumo de glicose pelos tecidos insulino-dependentes;
30
−
−
−
o Triacilgliceróis armazenados nos adipócitos são mobilizados e degradados de forma a
fornecer ácidos gordos para consumo energético e precursores para a produção de
corpos cetónicos.
Fase III, fome precoce: 10-24h
o A gliconeogénese hepática substitui gradualmente a glicogenólise como modo de
manter a glicemia;
o Aumentam a proteólise, no músculo, e a lipólise, no tecido adiposo. Os ciclos de cori
e da alanina ganham importância;
o Ácidos gordos passam a ser utilizados como fonte de energia em muitos tecidos.
Fase IV, fome intermédia: 1-24 dias
o A elevada taxa a que ocorre a gliconeogénese “esgota” o oxaloacetato e o ciclo de
Krebs deixa de consumir acetil-CoA. Começam a formar-se corpos cetónicos;
o Ao fim de alguns dias os níveis de corpos cetónicos aumentam significativamente e
estes compostos começam a ser utilizados pelo músculo cardíaco, músculo
esquelético e cérebro;
o Continua a ocorre lipólise.
Fase V, fome prolongada: mais de 24 dias
o Os corpos cetónicos adquirem uma maior importância enquanto metabolito
energético, sendo agora a principal fonte de energia utilizada pelos tecidos, incluindo
o cérebro;
o Verifica-se inibição do ciclo da ureia e a excreção de azoto pelos rins, sob a forma de
amónia;
o O carbono remanescente é utilizado na gliconeogénese renal.
31
4.5. Diabetes Mellitus
Diabetes Mellitus é uma síndrome metabólica caracterizada por uma deficiência na secreção ou
acção da insulina. Distinguem-se dois tipos de diabetes mellitus:
− Diabetes tipo I ou insulino-dependente (IDDM): causado por uma doença auto-imune ou
infecciosa, afecta o pâncreas e destrói as células β, comprometendo a secreção de insulina.
Surge em idade precoce, tem uma progressão bastante rápida e requer o controlo e
administração diários de insulina.
− Diabetes tipo II ou não-insulino-dependente (NIDDM): surge tipicamente em indivíduos
adultos e obesos e é mais comum que a diabetes tipo I. É causada por uma crescente
resistência à insulina (sensibilidade aos efeitos metabólicos da insulina diminuída) e
caracteriza-se por uma concentração crescente desta hormona no plasma hiperinsulinemia. A resistência à insulina leva à redução do metabolismo de hidratos de
carbono e ao aumento dos níveis de glicose no sangue, estimulando um aumento
compensatório da secreção da hormona.
32
A diabetes tipo II pode ser assintomática ou apresentar sintomas comuns à diabetes tipo I:
Glicemia elevada: a falta de insulina diminui a captação de glicose pelos tecidos periféricos.
Este facto aliado à gliconeogénese hepática aumentada provoca um aumento da
concentração sanguínea de glucose. Consequentemente, o excesso de glicose vai ser
excretado pela urina e a presença deste açúcar no líquido filtrado reduz a absorção de água
nos túbulos renais. A urina resultante é abundante (poliúria) e doce (daí mellitus).
Usualmente ocorre desidratação, levando a uma crescente sensação de sede (polidipsia);
Utilização crescente de ácidos gordos para obtenção de energia e formação de colesterol
pelo fígado: a mobilização maciça de ácidos gordos e a substituição do metabolismo glicídico
pelo lipídico leva a um aumento acentuado da produção de corpos cetónicos e a uma
consequente acidez metabólica. Devido à formação dos corpos cetónicos, o hálito de um
doente com diabetes tem um odor característico a maçã.
A utilização excessiva de gorduras pelo fígado durante um longo período de tempo leva
ainda à produção de grandes quantidades de colesterol e à sua deposição nas paredes
arteriais, podendo causar arteriosclerose e outras lesões vasculares;
Esgotamento das proteínas: a impossibilidade de a maioria das células metabolizarem glicose
leva-as a recorrerem às reservas proteicas e o doente perde peso rapidamente apesar de ter
muito apetite (polifagia).
33