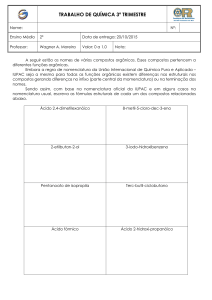
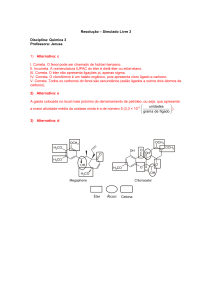
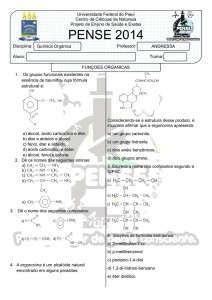
Sinopse das funções
orgânicas
Éteres
Aula 8- E.M
1
1- Definição
Éteres são compostos orgânicos em que o
oxigênio está diretamente ligado a dois
átomos de carbono.
Por exemplo:
CH3 – O – CH3
2
1- Definição
A fórmula geral dos éteres é:
R – O – R’ ou;
Ar – O – Ar’ ou;
Ar – O – R;
Os
dois grupos podem
diferentes entre si.
ser
iguais
ou
3
1- Definição
Os éteres são também denominados “óxidos
orgânicos”.
Podem ser considerados como derivados da
água (H – O – H), pela substituição dos dois
hidrogênios por grupos orgânicos.
4
1- Definição
Temos então:
Substituição de um
Único hidrogênio
H–O–H
Substituição dos
Dois hidrogênios
R- O - H (Álcool)
R- O - R (Éter)
5
1- Definição
Os éteres podem ser classificados em:
Simétricos (R – O – R) ou assimétricos (R –
O – R’);
Alifáticos (R – O – R), aromáticos (Ar – O –
Ar) ou mistos (Ar – O – R).
6
1- Definição
Há também éteres cíclicos, que são então
compostos heterocíclicos, nos quais
oxigênio é o heteroátomo; por exemplo:
o
CH2
H2C
O
Óxido de Etileno ou
epóxi- etano
7
2- Nomenclatura dos Éteres
Éteres
simples
são
frequentemente
designados por nomes radicofuncionais
comuns – Nomenclatura Radicofuncional.
O nome é formado citando-se, em ordem
alfabética, os nomes dos dois grupos ligados
ao oxigênio, seguidos pela palavra éter.
Não se utiliza hífem entre os nomes dos
grupos.
8
2- Nomenclatura dos Éteres
CH3OCH2CH3
Etil metil éter
-O-
CH3CH2OCH2CH3
Dietil éter
Ciclopentil fenil éter
- O - CH2CH2CH3
Cicloexil propil éter
9
2- Nomenclatura dos Éteres
Também pode-se ter o nome do composto
procedido pela palavra éter, seguida do
nome dos grupos, e ao nome do segundo
grupo é acrescida a terminação (sufixo) ílico.
10
2- Nomenclatura dos Éteres
Exemplos:
CH3OCH2CH3
Éter etil metílico
CH3CH2OCH2CH3
Éter dietílico
11
2- Nomenclatura dos Éteres
Exemplo:
CH3
C6H5OC
CH3
CH3
Éter terc- butil fenílico
12
2- Nomenclatura dos Éteres
Entretanto, os nomes substitutivos da IUPAC
deveriam
ser
usados
para
éteres
complicados e para compostos com mais de
uma ligação de éter.
13
2- Nomenclatura dos Éteres
Para citação do grupo principal, são usadas,
dentre outras, as seguintes regras:
Em compostos cíclicos, o que tiver o maior
anel individual é citado como grupo principal.
Preferido a
14
2- Nomenclatura dos Éteres
Em anéis de mesmo tamanho, a prioridade é
dada ou menos hidrogenado.
Preferido a
Preferido a
15
2- Nomenclatura dos Éteres
Em grupos acíclicos, a prioridade é
estabelecida de acordo com as regras
utilizadas para escolher a cadeia principal
dos alcanos, alquenos e alquinos.
16
2- Nomenclatura dos Éteres
Exemplos:
OCH3
CH3CHCH2CH2CH3
Metoxibenzeno
OCH3
2- Metoxipentano
O
CH3OCH2CH2OCH3
1,2- Dimetoxietano
(Ciclopentiloxi)cicloexano
17
2- Nomenclatura dos Éteres
CH3CHCH2CH2CHOCH2CH2CH3
CH3
CH3
(1,4-dimetil pentil) propril éter
18
2- Nomenclatura dos Éteres
Éteres Cíclicos
Éteres cíclicos podem ser nomeados de
diversas maneiras. Em um dos sistemas de
nomenclatura utiliza-se o prefixo epoxi (como
no sistema de nomenclatura substitutiva),
precedido dos números de átomos de
carbono aos quais se encontra ligado e
seguido do nome do composto de origem.
Nesse caso, o prefixo epoxi é considerado
substituinte e citado em ordem alfabética.
19
2- Nomenclatura dos Éteres
metoxiciclopentano
1,4-epoxipentano
2-metil-3-metoxifurano
1,3-epoxibutano
20
3- Propriedades Físicas dos Éteres
As propriedades físicas de alguns éteres são
dadas na tabela (entregue impressa).
Os éteres possuem pontos de ebulição que
são de alguma forma comparáveis aos dos
hidrocarbonetos de mesmo peso molecular.
21
3- Propriedades Físicas dos Éteres
Por exemplo, o ponto de ebulição do éter
dietílico (PM = 74) é 34,6 ºC; do pentano
(PM= 72) é 36 ºC.
Os éteres, contudo, podem formar ligações
hidrogênio com a água;
22
3- Propriedades Físicas dos Éteres
Os éteres, portanto, possuem solubilidade na
água comparável com à dos álcoois de
mesmo peso molecular e que são muito
diferentes
das
solubilidades
dos
hidrocarbonetos.
23
3- Propriedades Físicas dos Éteres
O éter dietílico e o 1-butanol, por exemplo,
possuem a mesma solubilidade na água,
aproximadamente 6,5g/100g de água a 25ºC,
temperatura ambiente;
O pentano, ao contrário, é praticamente
insolúvel na água.
Como ocorre em outras classes de
compostos orgânicos, a solubilidade dos
éteres em água diminui com o aumento do
número de átomos de carbonos.
24
4- Éter Dietílico
Fórmula molecular C4H10O e fórmula
estrutural CH3CH2-O-CH2CH3
O éter dietílico é um líquido incolor, de ponto de
ebulição muito baixo, altamente inflamável;
Deve- se ter muito cuidado quando se usa o éter
dietílico em laboratório, pois chamas nuas ou
centelhas de um interruptor de luz podem
provocar combustão explosiva das misturas do
éter dietílico e o ar (volátil).
25
4- Éter Dietílico
O éter dietílico foi empregado pela primeira
vez como um anestésico cirúgico nos E.U.A,
em 1846.
Logo depois, o éter dietílico foi introduzido
num hospital de Boston.
O anestésico moderno mais usado é o
halotano (CF3CHBrCl). Ao contrário do éter
dietílico, o halotano não é inflamável.
26
5 - MTBE
O tert-butil metil éter, conhecido como MTBE, é
um aditivo adicionado a gasolina para aumentar
a octanagem e melhorar a eficiência da
combustão, reduzindo a emissão, pelos
automóveis, do poluente monóxido de carbono
(CO).
Nos Estados Unidos, uma lei de 1990,
estabeleceu que toda gasolina deveria conter no
mínimo 2,7% (em massa) de oxigênio, o que
corresponde à adição de 15% (v/v) de MTBE a
esse combustível.
27
5 - MTBE
O diisopropil éter e o etanol podem ser utilizados em substituição
ao MTBE.
MTBE é inflamável e incolor líquido
volátil que é miscível com água. MTBE
tem um cheiro mentolado uma vaga
lembrança do éter etílico , levando a
sabor e odor desagradável na água.
28