A presença dos éteres em nossas vidas
A nomenclatura oficial IUPAC dos éteres
segue algumas regra
Os éteres são compostos orgânicos cujo grupo funcional é caracterizado
pela presença de um átomo de oxigênio (O) ligado a dois radicais
orgânicos.
Grupo menor + óxi – grupo maior
O éter mais conhecido é o éter comum, ou etóxietano ou ainda éter dietílico. Ele
é encontrado em farmácia e hospitais. É um líquido muito volátil, com ponto de
ebulição em torno de 35°C, muito inflamável, incolor e com odor característico.
Pode ser utilizado como solvente de graxas, óleos, resinas e tintas.
Passou a ser usado, como anestésico por inalação, em 1842.
Provocava grande mal estar nos pacientes após a anestesia e foi então
substituído por outros anestésicos.
Pintura da primeira demonstração de cirurgia com anestesia com éter, nos EUA, em 1842.
NOMENCLATURA DOS ÉTERES
A nomenclatura dos éteres pode ser feita de duas formas, sendo que na mais
reconhecida escreve-se a cadeia menor seguida de “oxi” e depois a cadeia
maior com o sufixo.
1ª maneira:
Os éteres são compostos orgânicos cujo grupo
funcional é caracterizado pela presença de um
átomo de oxigênio (O) ligado a dois radicais
orgânicos.
2ª maneira:
Consideram-se os dois grupos ligados ao oxigênio como
substituintes, sendo indicados por ordem de complexidade com
o sufixo ico, ou seja, segue a seguinte regra:
éter + 1º grupo + 2º grupo + ico
Os éteres são substâncias orgânicas cujas cadeias carbônicas apresentam o átomo
de oxigênio como heteroátomo,ou seja, apresentam o seguinte seguimento:
Entre esses compostos, o que se destaca é o de estrutura mais simples:
o etoxietano, também conhecido como éter comum, éter etílico ou éter
sulfúrico. Ele foi muito utilizado em cirurgias como anestésico por inalação
a partir de 1842.
Porém, ele passou a ser substituído com o tempo porque é muito volátil e
inflamável, levando ao risco de explosões durante a cirurgia, além de ser
tóxico, causar irritação no trato respiratório e mal-estar ao paciente.
Atualmente, ele é mais utilizado como solvente apolar em laboratórios e
indústrias, principalmente na extração de óleos, gorduras, essências,
perfumes, entre outros compostos de fontes vegetais e animais.
Outro éter importante é o metil-t-butil-éter (metóxi-terciobutano), mais
conhecido pela sigla MTBE, usado como antidetonante na gasolina,
aumentando a sua resistência à compressão e aumentando a sua octanagem.
O Conselho Nacional do Petróleo (CNP) autorizou a Petrobrás a aditivar a
gasolina usando o composto MTBE até 7% em volume para aumentar o
índice de octanagem. Sua fórmula está representada abaixo, ele é um
líquido incolor, de ponto de fusão igual a -110ºC e ponto de ebulição igual a
55ºC.
A obtenção do MTBE se dá por meio da reação
entre o metanol com metilpropeno, na presença
de um catalisador:
Outros solventes utilizados nas indústrias químicas são as resinas de modelagem
do tipo epóxi, que são éteres também.
Os compostos do grupo éter estão presentes também em muitos produtos
naturais, como o eugenol, presente no cravo-da-índia, a vanilina, principal
componente da essência ou aroma de baunilha e que está presente nas
vagens secas da orquídea Vanilla planifolia, e a hipofilantina, principal
componente dochá de quebra-pedra.
Esse chá é muito utilizado para dissolver cálculos renais, promovendo a
desobstrução do uretera. Sua ação diurética facilita a excreção do ácido
úrico. Mas, cuidado! Mulheres grávidas ou em período de lactação não
devem tomar esse chá.
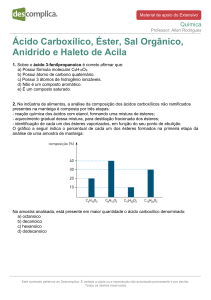
Propriedades físicas e químicas.
Os éteres são compostos de odor agradável, insolúveis em água mas
solúveis em diversos solventes orgânicos. À temperatura ambiente
podem ser sólidos, líquidos ou gasosos, dependendo do tamanho da
cadeia carbônica. A densidade é menor que 1. Os pontos de ebulição
dos termos inferiores são mais baixos que os dos álcoois
correspondentes.
Os éteres são substâncias neutras e quimicamente quase inertes, pois
todos os átomos de hidrogênio estão ligados a átomos de carbono, o
que torna sua capacidade de reação muito limitada. Dessa propriedade
deriva sua ampla aplicação como solvente.
Propriedades físicas e químicas.
Devido à existência de pares de elétrons isolados no átomo de
oxigênio, esses compostos comportam-se como bases de Lewis,
capazes, portanto, de reagir com alguns tipos de ácidos, dando
origem a sais de oxônio.
Podem ser dissolvidos em ácido sulfúrico a O°C, ao contrário
dos halogenetos de alquila e dos alcanos.
A temperaturas mais elevadas, o ácido sulfúrico pode provocar
o rompimento dos éteres.
Éter etílico
O éter etílico também se usa como anestésico, assim como o éter
metilpropílico e vinílico. Exerce eficiente ação paralisante sobre o sistema
nervoso. Permite farta oxigenação, mas tem o inconveniente de irritar as
vias respiratórias e os rins. Eleva a tensão intercraniana e, utilizado por
inalação, tem ação narcótica.
Os Ésteres são compostos orgânicos que
apresentam fórmula geral:
Manteiga: derivada de ésteres.
Os Ésteres se caracterizam pelo grupo funcional:
Observação: R e R1 são radicais orgânicos, grupos CH3.
Etanoato de metila ou acetato de metila.
Observe que os elementos Oxigênio estão ligados a Carbono.
Características físicas dos Ésteres
Os ésteres podem se apresentar como líquidos ou sólidos, dependendo da quantidade
de carbonos e das condições ambientes.
Ésteres de baixa massa molecular são líquidos incolores e, à medida que se aumenta
a massa molecular, eles vão se tornando mais viscosos e gordurosos até tomarem a
forma sólida (aspecto de cera).
Solubilidade em água
Os ésteres são compostos insolúveis em água, no entanto são solúveis em álcool,
éter e clorofórmio. Quanto ao ponto de ebulição (P.E.), a falta de pontes de
hidrogênio na estrutura dos ésteres faz com que tenham o P.E. menor que
álcoois e ácidos de mesma massa molecular.
Utilização dos Ésteres
Os ésteres são muito utilizados na Indústria alimentícia como aromatizantes
artificiais, eles imitam o cheiro e gosto de frutas, os principais são:
Metanoato de etila (aroma artificial de groselha), Antranilato de metila (sabor
artificial de uva), Etanoato de butila (essência que dá o sabor de maçã verde),
Acetato de pentila (aroma artificial de banana), Butanoato de etila (aroma de
abacaxi), Acetato de propila (sabor artificial de pera).
A manteiga, aquela usada no pão, é classificada como éster (derivado da
mistura dos ácidos linoleico e oleico).
Muitos ésteres, como o etanoato de butila (essência de maça verde), são usados como
flavorizantes em balas e doces
Veja os nomes de alguns desses ésteres:
•Etanoato de butila: essência de maçã verde;
•Etanoato de propila: essência de pera;
•Etanoato de isopentila: essência de banana;
•Butanoato de butila: essência de morango;
•Etanoato de etila: essência de maçã;
•Butanoato de etila: essência de abacaxi;
•Etanoato de octila: essência de laranja
Flavorizantes
Os flavorizantes são substâncias que atribuem ou
intensificam o aroma e o sabor de bebidas ou
alimentos produzidos industrialmente.
Essa palavra tem origem
inglesa, flavor significa“aroma” e “sabor” ao mesmo
tempo.
As balas são exemplos de produtos industrializados
que recebem diferentes tipos de flavorizantes
Ao produzir alimentos artificiais como doces, balas, chicletes, refrigerantes,
sucos, balas, sorvetes, biscoitos, bolachas, entre outros, as indústrias
adicionam certos aditivos alimentares para conferir aroma e sabor. Esses
aditivos podem ser naturais, sendo extraídos de frutos, folhas etc. No
entanto, o uso dos flavorizantes é mais vantajoso para eles, pois esses
compostos químicos são mais baratos e os aromas naturais mais
delicados são formados por misturas muito complexas e difíceis de
serem extraídas.
Existem vários compostos sintéticos que atuam
como flavorizantes, mas os ésteres
orgânicos são um grupo funcional que se
destaca. Os ésteres são compostos obtidos por
meio da substituição do hidrogênio do grupo
OH de um ácido carboxílico por um radical
orgânico:
EXERCÍCIOS
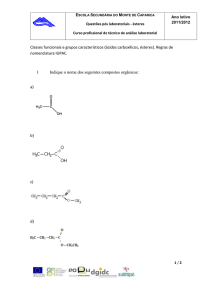
1) O composto
a)3 carbonos primários, 2 secundários e 1 terciário.
b)1 hidrogênio ligado ao carbono terciário.
c)Cadeia acíclica, ramificada, saturada e homogênea.
d)Cadeia alifática, ramificada, saturada e heterogênea.
e)O grupo funcional (– O –) que caracteriza um álcool.
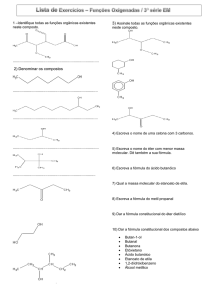
2) Forneça os nomes dos éteres que apresentam as seguintes fórmulas:
1=D
2