1
Disciplina: Química Geral
Docente Responsável: Profa. Dra. Luciana Maria Saran
Assunto: Ácidos e Bases de Lewis/ Óxidos/ Sais: classificação
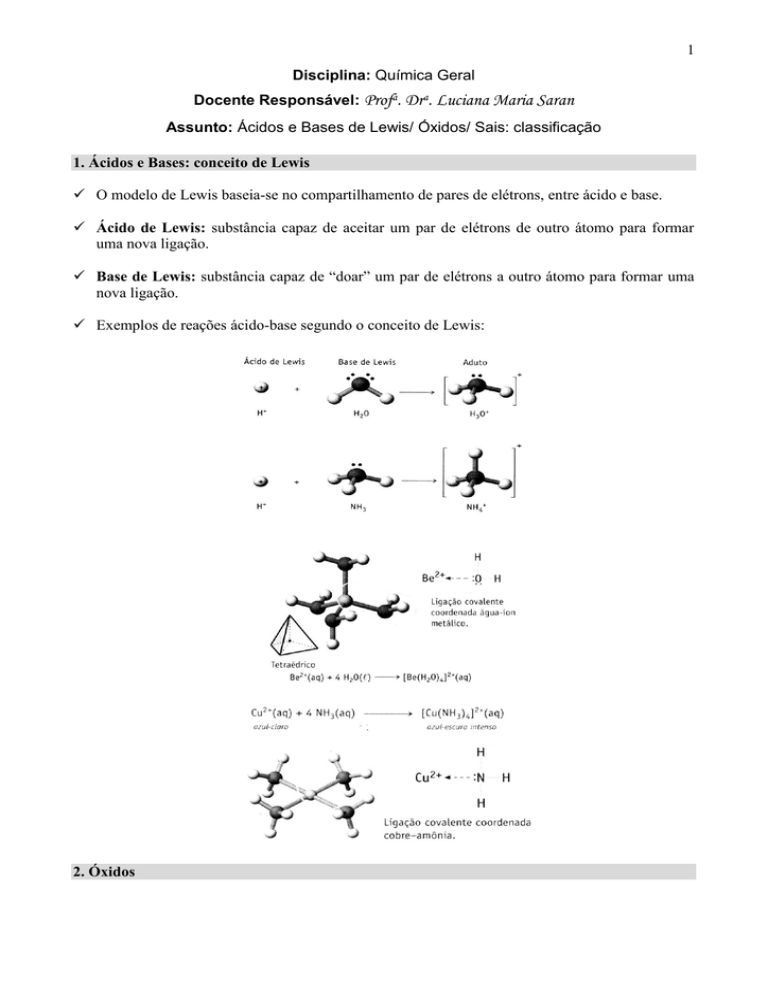
1. Ácidos e Bases: conceito de Lewis
O modelo de Lewis baseia-se no compartilhamento de pares de elétrons, entre ácido e base.
Ácido de Lewis: substância capaz de aceitar um par de elétrons de outro átomo para formar
uma nova ligação.
Base de Lewis: substância capaz de “doar” um par de elétrons a outro átomo para formar uma
nova ligação.
Exemplos de reações ácido-base segundo o conceito de Lewis:
2. Óxidos
2
De uma maneira geral os óxidos são compostos químicos formados pelo oxigênio e um outro
elemento. São classificados como óxidos moleculares ou como óxidos iônicos. Estes, ainda
podem ser classificados em óxidos ácidos, básicos, neutros ou anfóteros.
Os óxidos moleculares apresentam o elemento químico oxigênio ligado com outro não-metal ou
com um semi-metal. São exemplos, de óxidos moleculares: o monóxido de nitrogênio, NO; o
dióxido de nitrogênio, NO2; o monóxido de carbono, CO e o dióxido de carbono, CO2, entre
outros.
Os óxidos iônicos apresentam o elemento químico oxigênio ligado com um metal. São
exemplos, de óxidos iônicos: o óxido de sódio, Na2O; o óxido de alumínio, Al2O3; o óxido de
cobre (II), CuO; o óxido de ferro (II), FeO e o óxido de ferro (III), Fe2O3, entre outros.
Os óxidos ácidos ou anidridos resultam da desidratação de ácidos e são capazes de reagir com
água formando um ácido. Exemplos: SO3, CO2 e N2O5, entre outros, conforme ilustra a
Figura 1, a seguir.
Figura 1: Exemplos de óxidos ácidos ou anidridos.
Comportamento dos óxidos ácidos em meio aquoso:
SO3(g) + H2O(l) H2SO4(aq)
CO2(g) + H2O(l) H2CO3(aq)
N2O5(l) + H2O(l) 2HNO3(aq)
Os óxidos ácidos reagem com bases produzindo sal e água, conforme ilustram os exemplos a
seguir.
Os óxidos básicos resultam da desidratação dos respectivos hidróxidos e são capazes de reagir
com água formando uma base. Exemplos: CaO e Na2O, entre outros, conforme ilustra a
Figura 2, a seguir.
3
Figura 2: Exemplos de óxidos básicos.
Comportamento dos óxidos básicos em meio aquoso:
CaO(g) + H2O(l) Ca(OH)2(aq)
Na2O(g) + H2O(l) 2NaOH(aq)
Os óxidos básicos reagem com ácidos produzindo sal e água, conforme ilustram os exemplos a
seguir.
Os óxidos neutros são aqueles que não reagem com água, nem com ácidos e nem com bases.
Exemplos: CO, NO e N2O
A maioria dos elementos metálicos do grupo principal forma óxidos básicos e a maioria dos
elementos não metálicos forma óxidos ácidos. Os elementos perto da fronteira diagonal entre os
metais e os não metais, ou seja, Be, B, Al, Ga, Ge, Sn, Sb, Pb, Bi e Po, formam óxidos
anfóteros. Tais óxidos comportam-se como ácidos, quando entram em contato com bases e
como bases, ao entrarem em contato com ácidos.
3. Sais
Conforme discutido, em aula, a reação entre um ácido e uma base produz um composto iônico
denominado sal. Embora a reação entre um ácido e uma base seja denominada “neutralização”,
a solução do sal resultante não é necessariamente neutra.
A solução de um sal apresentará pH diferente de 7 se os íons presentes na sua composição
sofrerem hidrólise, ou seja, reagirem com água produzindo H3O+ e/ou OH-.
Os sais que formam soluções ácidas têm um cátion capaz de reagir com a água aumentando a
concentração de íons H3O+. Exemplos: NH4Cl e AlCl3, entre outros. A Tabela 1 apresenta o
comportamento de alguns cátions em meio aquoso.
Tabela 1: Caráter de cátions comuns em meio aquoso.
4
CARÁTER
ÁCIDO
ácidos conjugados de bases fracas
cátions de metais pequenos e com carga
elevada
NEUTRO
cátions dos Grupos 1 e 2
cátions de metal com carga +1
BÁSICO
EXEMPLOS
íon amônio, NH4+
íon metilamínio, CH3NH3+
íon anilínio, C6H5NH3+
Fe3+ como Fe(H2O)63+
Cr3+ como Cr(H2O)63+
Al3+ como Al(H2O)63+
Fe2+ como Fe(H2O)62+
Cu2+ como Cu(H2O)62+
Ni2+ como Ni(H2O)62+
Li+, Na+, K+, Mg2+, Ca2+
Ag+
nenhum
Os sais que formam soluções básicas têm um ânion capaz de reagir com a água aumentado a
concentração de íons OH-. Exemplos: CH3COONa e KCN, entre outros. A Tabela 2 apresenta o
comportamento de alguns ânions em meio aquoso.
Tabela 2: Caráter de ânions comuns em meio aquoso.
CARÁTER
ÁCIDO
comportamento raro
NEUTRO
bases conjugadas de ácidos fortes
BÁSICO
bases conjugadas de ácidos fracos
EXEMPLOS
HSO4-, H2PO4-
Cl-, Br-, I-, NO3-, ClO4-
F-, O2-, OH-, S2-, CN-,
CO32-, PO43-, NO2-, CH3CO2-,
outros carboxilatos
Em resumo, se o sal for formado por:
a) um cátion e um ânion que não reagem com água, espera-se que a solução aquosa do sal
exiba pH = 7;
b) um ânion que reage com água, produzindo OH- e um cátion que não reage com água, a
solução do sal apresentará pH > 7;
5
c) um cátion que reage com água, produzindo H3O+ e um ânion que não reage com água, a
solução do sal apresentará pH < 7;
d) um cátion e um ânion que reagem com água, haverá produção de H3O+ e OH-, e neste caso,
dependendo das quantidades relativas destas espécies, a solução do sal poderá ser ácida,
básica ou neutra.