FILÓSOFO EMPÉDOCLES
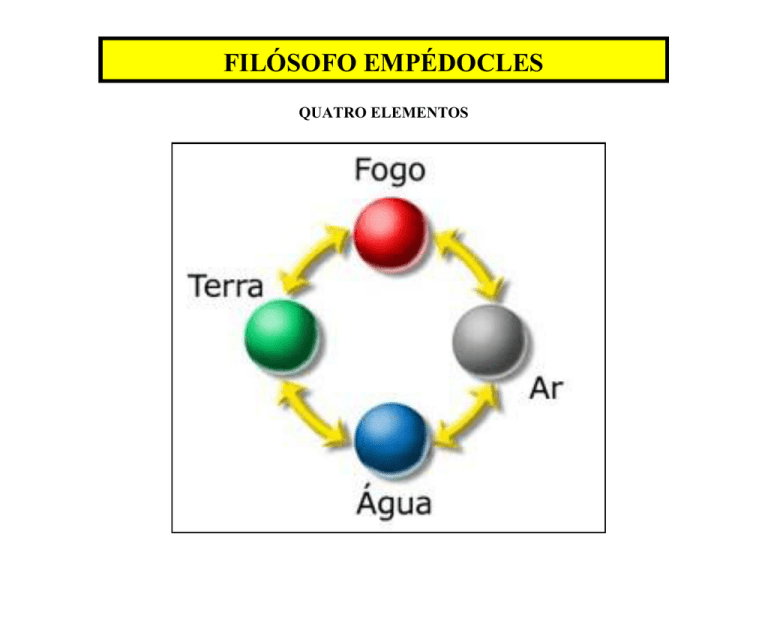
QUATRO ELEMENTOS
QUATRO ELEMENTOS
SÍMBOLOS
FILÓSOFO ARISTÓTELES
QUALIDADES
JOHN DALTON
FUNDADOR DA TEORIA ATÔMICA MODERNA
MODELO ATÔMICO DE DALTON ( 1808 )
MODELO BOLA DE BILHAR
TEORIA ATÔMICA DE DALTON
POSTULADOS DE DALTON
ÁTOMOS DE DALTON
ÁTOMOS DE ELEMENTOS DIFERENTES POSSUEM PROPRIEDADES DIFERENTES
REAÇÃO QUÍMICA
SEPARAÇÃO E UNIÃO DE ÁTOMOS
TUBO DE RAIOS CATÓDICOS
FEIXE DE ELÉTRONS
▲Thomson estudava a condução de eletricidade em gases a baixas pressões
▲A diferença de potencial elétrico causou movimento ordenado do gás
▲Quando o potencial era elevado, formava-se um feixe luminoso
▲Esse feixe luminoso era oriundo do cátodo ( pólo negativo )
▲Thomson notou que os raios eram desviados por um campo elétrico e magnético
▲Pelo sentido do desvio, Thomson percebeu que eram partículas negativas
▲Os raios tinham o mesmo comportamento, independente do gás dentro da ampola
▲Ele concluiu que este comportamento devia ser um componente de toda a matéria
▲Thomson propôs um modelo de átomo com partículas ( átomo descontínuo )
▲Imaginava-se o átomo eletricamente neutro
MODELO ATÔMICO DE THOMSON ( 1897 )
MODELO PUDIM DE PASSAS
▲Átomos com cargas elétricas
▲Esfera maciça e positiva
▲Cargas negativas distribuídas uniformemente na superfície
▲Quantidade de cargas positivas e negativas é igual
CONTRIBUIÇÃO DE THOMSON
O ÁTOMO É CONSTITUÍDO POR PARTÍCULAS SUBATÔMICAS
EXPERIMENTO DE RUTHERFORD
USO DE FENÔMENOS RADIOATIVOS NO ESTUDO DA ESTRUTURA ATÔMICA
▲Rutherford utilizou na experimentação uma amostra de polônio.
▲Promoveu um bombardeamento com partículas positivas denominadas alfa
▲Essas emissões chocavam-se com uma fina lâminas de ouro ( 10-5 cm )
▲Visualizou o percurso das emissões com um anteparo a base de sulfeto de zinco
▲O sulfeto de zinco é uma substância fosforescente
▲O sulfeto de zinco emite luz de transição lenta ao receber radiação
EXPERIMENTO DE RUTHERFORD
OBSERVAÇÕES E CONCLUSÕES
▲Rutherford notou que a maioria das partículas alfa atravessava a lâmina
▲Algumas partículas alfa se desviavam
▲Muito poucas partículas ricocheteavam ( uma em vinte mil )
▲Presença de núcleo positivo e de uma eletrosfera
▲Raio do átomo é 10.000 a 100.000 vezes maior do que o raio do núcleo
O ÁTOMO DE RUTHERFORD ( 1911 )
MODELO SISTEMA SOLAR /// MODELO PLANETÁRIO /// MODELO NUCLEADO
▲Existência de núcleo e eletrosfera
▲A eletrosfera contém os elétrons
▲Núcleo diminuto e positivo
▲Núcleo concentra toda a massa do átomo
CARACTERÍSTICAS ATÔMICAS
NULIDADE ELÉTRICA E ELEVADA DENSIDADE NUCLEAR
Natureza
Valor Relativo
Massa Relativa
Próton
Positiva
+1
1
Nêutron
Nula
0
1
Elétron
Negativa
-1
1/1836
REPRESENTAÇÃO
CONVENÇÃO INTERNACIONAL
OBSERVAÇÕES
DENOMINAÇÕES UTILIZADAS
Z
A
Número Atômico
Número de Prótons
Carga Nuclear
Número de Massa
Composição Nuclear
Núcleon
ÂNION
ÍON NEGATIVO /// ÁTOMO QUE RECEBE ELÉTRONS /// CARÁTER AMETÁLICO
CÁTION
ÍON POSITIVO /// ÁTOMO QUE PERDE ELÉTRONS /// CARÁTER METÁLICO
QUESTÃO 24
CADERNO DE EXERCÍCIOS /// PÁGINA 08
Um cátion X2+ tem o mesmo número de elétrons ( isoeletrônicos ) que um ânion Y3- .
Sendo ZX e ZY os respectivos números atômicos, podemos afirmar que:
a) ZX - ZY = 5
b) ZY - ZX = 5
c) ZX - ZY = 1
d) ZY - ZX = 1
e) ZX = ZY
QUESTÃO 41
CADERNO DE EXERCÍCIOS /// PÁGINA 10
( Fei ) Num exercício escolar, um professor pediu a cada aluno que imaginasse um
átomo que tivesse o número atômico igual ao seu número de chamada, e o número de
nêutrons 2 unidades a mais que o número de prótons. O aluno número 15 se
esqueceu de somar 2 para obter o número de nêutrons e, conseqüentemente, dois
alunos imaginaram átomos isóbaros, ou seja, com o mesmo número de massa.
Determine os números de chamada dos alunos com quem esse fato ocorreu.
QUESTÃO EXTRA 01
CARACTERIZAÇÃO DO ÁTOMO
( Mackenzie ) Calcule a soma dos prótons, elétrons e nêutrons do átomo W ( Z = 2x 2 e A = 4x ) , que possui 22 nêutrons.
QUESTÃO EXTRA 02
CARACTERIZAÇÃO DO ÁTOMO
( Cesgranrio ) O átomo Q tem 36 nêutrons e é isóbaro do átomo R . Considerando
que R2+ é isoeletrônico ( mesmo número de elétrons ) do átomo Q , identifique o
número de nêutrons do átomo R .
GABARITO
AULAS 01 + 02
● Questão 24
● Questão 41
● Questão Extra 01
● Questão Extra 02
Alternativa [A]
Alunos 14 e 15
Soma = p + e + n = 58
Nêutrons = 34












