Enviado por
luizfisico2004
ex-termodinamica-quimica

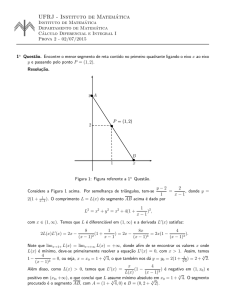
Questões de termodin^ amica quı́mica Luiz Henrique de Melo dos Santos Figura 1: Questões de termodinâmica. Q.1 Para resolver esta questão, usamos a expressão que relaciona a diferença de pressão no tubo e na bolha: 2𝑆 , (1) 𝑅 𝑁 onde S é a tensão superficial, em 𝑚 e 𝑅 é o raio do tubo. Dados da questão: 𝑇 = 20°𝐶 = 293𝐾, 𝑅𝑡𝑢𝑏𝑜 = 0,51𝑚𝑚 𝑁 e ∆𝑝 = 211𝑃 𝑎 = 211 𝑚2 . Assim, temos: ∆𝑝 = 𝑆= 𝑁 ∆𝑝𝑅 = 5,38.10−2 , 2 𝑚 𝑆 = 5,38.10−2 (2) 𝑁 . 𝑚 Obs. Como houve ambiguidade no fornecimento do raio do tubo, calculamos a tensão superficial conside𝑁 rando isso, chegando a 𝑆 = 2,69.10−2 . 𝑚 Q.2 Nesse problema, deve-se considerar que há um equilı́brio entre duas fases, garantido, pela diferença de 𝑀 pressão, que deve ser encontrada. No equilı́brio, tem-se que 𝑛1 𝜕𝐺 𝜕𝑝 = 𝜌 |𝑇 , onde 𝑛 é o número de mols, 𝑀 é a massa molar da substância e 𝜌 é a densidade, em que 𝑘𝑔 𝑚3 . Considerando a sugestão dada, à saber, 𝐺 = 1 𝜕𝐺𝑏 𝜕𝐺𝑣 𝑀 𝑀 ( |𝑇 − |𝑇 ) = − , 𝑛 𝜕𝑝 𝜕𝑝 𝜌𝑏 𝜌𝑣 𝑀 𝜌 𝑝, temos (3) após alguma álgebra, chegamos a, ∆𝐺𝜌𝑏 𝜌𝑣 . (4) 𝑀 (𝜌𝑏 − 𝜌𝑣 ) Onde os subscritos b e v, referem-se, respectivamente, às fases branca e vermelha do fósforo. Usando os dados fornecidos,temos, ∆𝑝 = ∆𝑝 = 12,01.2,300.1,823 = 340 𝑘𝑃 𝑎. 0,031(2.300 − 1.823) 1 (5) ∆𝑝 = 340 𝑘𝑃 𝑎 . Q.3 Nessa questão, usamos a expressão da energia livre de Gibbs em função da temperatura e da pressão, 𝐺(𝑇,𝑝) = 𝐺0 (𝑇 ) + 𝑅𝑇 ln(𝑝/𝑝0 ), (6) com 𝐺0 (𝑇 ) é a energia livre de Gibbs padrão, R é a constante de Clapeyron dos gases perfeitos. Invertendo a equação 6, temos que, (︀ ∆𝐺 )︀ . 𝑝 = 𝑝0 exp − 𝑅𝑇 Substituı́ndo os dados fornecidos e levando em conta que 𝑝0 (373) = 101 𝑘𝑃 𝑎, temos, (7) (︀ ∆𝐺 )︀ (︀ (−228.599 + 237.178) )︀ 𝑝 = 𝑝0 exp − = 101 exp − , 𝑅𝑇 8.314.298,15 (8) (︀ ∆𝐺 )︀ (︀ 8579 )︀ 𝑝 = 𝑝0 exp − = 101 exp − = 3.17 𝑘𝑃 𝑎. 𝑅𝑇 2977,63 (9) 𝑝 = 3.17 𝑘𝑃 𝑎 . Q.4 a) Nesse item, usa-se a equação de Clapeyron, ∫︁ 𝑝 𝑝0 𝑑𝑝 = 𝑝 ∫︁ 𝑇 ∆𝐻𝑣 𝑑𝑇 , 𝑅 𝑇2 𝑇0 (10) onde ∆𝐻𝑣 é a entalpia de vaporização, que deve ser encontrada. A integração resulta em, ln (︁ 𝑝 )︁ ∆𝐻𝑣 (︁ 1 1 )︁ =− − . 𝑝0 𝑅 𝑇 𝑇0 (11) Na questão especı́fica, tem-se a entalpia, ∆𝐻𝑣 = −𝑅 (︁ 𝑝𝑣 (𝑇2 ) 𝑝𝑣 (𝑇1 ) 1 1 𝑇2 − 𝑇1 [︁ ln )︁ ]︁ . (12) Substituı́ndo os dados do problema na equação 12 acima, chega-se a ∆𝐻𝑣 = −8.314 )︁ (︁ 5332.80 1333.20 1 1 392.3 − 358.8 [︁ ln ∆𝐻𝑣 = 48,5 ]︁ = 48,5 𝑘𝐽 . 𝑚𝑜𝑙 (13) 𝑘𝐽 . 𝑚𝑜𝑙 Usando, novamente, a equação 11, teremos, 𝑇𝑒𝑏 = Δ𝐻𝑣 𝑇0 ∆𝐻𝑣 , − 𝑅 ln( 𝑝𝑝𝑒𝑏0 ) (14) com os subscritos eb estão relacionados à ebulição. Utilizando os dados anteriores e a entalpia de vaporização obtida, tem-se 𝑇𝑒𝑏 = 48500 358.8 48500 = 488,94𝐾. 101 − 8.314𝑅 ln( 1.3331 ) Portanto, 2 (15) 𝑇𝑒𝑏 = 488,94 𝐾 . Podemos obter a entropia da vaporização, ∆𝑆𝑣 = Δ𝐻𝑣 𝑇𝑒𝑏 = 99.20 ∆𝑆𝑣 = 99.20 𝐽 𝑚𝑜𝑙.𝐾 Portanto, 𝐽 . 𝑚𝑜𝑙.𝐾 b) Usando, mais uma vez, a equação de Clapeyron, tem-se, ln (︁ 𝑝 )︁ ∆𝐻 (︁ 1 1 )︁ 𝑣 . = − 𝑝0 𝑅 𝑇0 𝑇 (16) Aqui, usaremos os seguitnes dados: 𝑇0 = 80 °𝐶 = 353𝐾, 𝑇 = 85.8 °𝐶 = 358.95 𝐾 e 𝑝0 = 10 𝑡𝑜𝑟𝑟 = 1333.20 𝑃 𝑎. Portanto, 𝑝 = 1020 𝑃 𝑎 . c) Supondo que 𝑇𝑓 = 𝑇𝑡𝑟𝑖𝑝𝑙𝑜 , então (𝑇 = 353.15 𝐾; 𝑝 = 1020 𝑃 𝑎), faz parte da curva de equilı́brio entre o sólido e o gás. Como a pressão de vapor do śolido é 𝑝0 = 1 𝑎𝑡𝑚 = 101 𝑘𝑃 𝑎 e 𝑇 = 325.75 𝐾, por Clapeyron, a entalpia de sublimação é dada por, 𝑇 𝑇0 ln ∆𝐻𝑠𝑢𝑏 = (︁ 𝑝 𝑝0 )︁ = 71 𝑇 − 𝑇0 ∆𝐻𝑠𝑢𝑏 = 71 𝑘𝐽 𝑚𝑜𝑙 (17) 𝑘𝐽 . 𝑚𝑜𝑙 Como, ∆𝐻𝑠𝑢𝑏 = ∆𝐻𝑓 + ∆𝐻𝑣 , tem-se, portanto que, ∆𝐻𝑓 = ∆𝐻𝑠 − ∆𝐻𝑣 , e, ∆𝐻𝑓 = 22.50 𝑘𝐽 . 𝑚𝑜𝑙 d) Usando a 15, temos que, (︁ 𝑝 )︀ 1 𝑅 1 , = + ln 𝑇0 𝑇 ∆𝐻𝑠𝑢𝑏 𝑝0 (18) aqui, usaremos, 𝑝0 = 10−5 𝑎𝑡𝑚 = 1.01 𝑃 𝑎, e, conclui-se que, 𝑇0 = 226.4 𝐾, para que haja pressões de vapor abaixo de 10−5 𝑎𝑡𝑚, as temperaturas devem ser tal que, 𝑇0 < 226.4 𝐾 . Q.7 Considerando o vapor de água como um gás ideal, podemos usar a equação dos gases perfeitos, 𝑝𝑉 = 𝑛𝑅𝑇 (19) 𝑎𝑡𝑚.𝑙 𝐽 onde 𝑝 é a pressão do gás, 𝑉 o seu volume, 𝑛 o número de mols, 𝑅 = 0.082 𝑚𝑜𝑙.𝐾 = 8.314 𝑚𝑜𝑙.𝐾 a constante dos gases ideiais. 𝑝 Dados da questão: 𝑇 = 100 °𝐶 = 373 𝐾, 𝑝 = 1 𝑎𝑡𝑚, e, considerando que, 𝑐 = 𝑉𝑛 , Tem-se, 𝑐 = 𝑅𝑇 = 0.12 𝑚𝑜𝑙 𝑙 . 𝑐 = 0.12 3 𝑚𝑜𝑙 . 𝑙