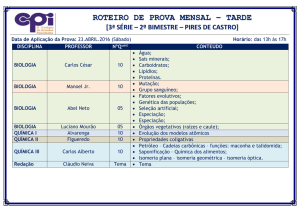
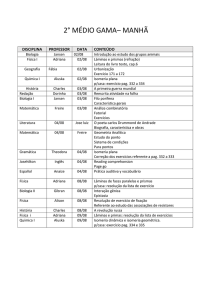
Enviado por
common.user4675
resumo quim organica

A palavra “isomeria” deriva do grego (iso= mesmo; meros= parte). Portanto, trata-se de um fenômeno químico no qual diferentes compostos são formados por um mesmo conjunto de átomos (daí “ mesmas partes”), ou seja, apresentam a mesma fórmula molecular, porém suas fórmulas estruturais são diferentes. Há vários tipos de isomeria, que são classificadas baseadas justamente na diferença que há na fórmula estrutural dos isômeros. Vejamos: Isomeria de cadeia (ou esqueletal) A fórmula molecular é a mesma para os compostos, obviamente, por isso são isômeros, a única diferença será quanto à sua cadeia carbônica, que poderá ter uma ou mais classificações diferentes. Exemplos: 2-metil-propano Fórmula Molecular: (cadeia ramificada) pent-1-eno Fórmula Molecular: (cadeia aberta e insaturada) C5H10 ciclopentano Fórmula Molecular: (cadeia fechada e saturada) C5H10 Isomeria de posição (posicional) A isomeria de posição ocorre quando a única diferença entre os isômeros é a posição, ou de uma insaturação, ou de uma ramificação, ou de um grupo funcional. but-1-eno Fórmula Molecular: insaturação no carbono 1 C4H8 C4H10 butano Fórmula Molecular: C4H10 (cadeia normal) ——————————————— ——————– but-2-eno Fórmula Molecular: C4H8 insaturação no carbono 2 ——————————————— ———— 2-metil-pentano Fórmula Molecular: ramificação no carbono 2 Metameria (ou isomeria de compensação) Esse tipo de isomeria ocorre quando a única diferença entre os isômeros é a posição do heteroátomo na cadeia carbônica. Ocorre geralmente em éteres, ésteres, amidas e aminas. Exemplos: C6H14 metoxibutano Fórmula Molecular: C5H12O 3-metil-pentano Fórmula Molecular: C6H14 ramificação no carbono 3 ——————————————— ————————– propan-1-ol Fórmula Molecular: C3H8O grupo funcional (hidroxila) no carbono 1 propan-2-ol Fórmula Molecular: C3H8O grupo funcional (hidroxila) no carbono 2 etoxipropano Fórmula Molecular: C5H12O ______________________________ _________ Note que no metoxibutano, o heteroátomo (oxigênio) está na posição 2, enquanto no etoxipropano, ele está na posição 3. metilpropilamina Fórmula Molecular: C4H11N dietilamina Fórmula Molecular: C4H11N ——————————————— ——————Na metilpropilamina, o heteroátomo (nitrogênio) está na posição 2, já na dietilamina, ele está na posição 3, bem no centro da cadeia. Obs. 1: A mudança de posição do heteroátomo sempre causa um aumento de um dos lados da cadeia e o encurtamento do outro, por isso a metameria também é chamada de isomeria de compensação (pois a falta de carbonos de um lado da cadeia é compensada pelo acréscimo de carbonos na outra extremidade). Obs. 2: Atualmente os livros didáticos estão trazendo uma tendência nova de considerar a metameria como um dos casos de isomeria posicional. Isomeria de função (funcional) Há isomeria funcional quando a única diferença entre os isômeros é a função orgânica a qual pertencem. Os casos mais comuns de isomeria são entre: álcoois e éteres; ácidos carboxílicos e ésteres; aldeídos e ceto nas. Vejamos: ácido butanoico Fórmula Molecular: C4H8O2 propanoato de metila Fórmula Molecular: C4H8O2 ——————————————— ————————————Isomeria funcional entre um ácido carboxílico (ácido butanoico) e um éster (propanoato de metila). butan-1-ol Fórmula Molecular: C4H10O etoxietano Fórmula Molecular: C4H10O Isomeria funcional entre um álcool (butan-1-ol) e um éter (etoxietano). propanal Fórmula Molecular: C3H6O propanona Fórmula Molecular: C3H6O ——————————————— —————— Isomeria funcional entre um aldeído (propanal) e uma cetona (propanona). Tautomeria ( ou isomeria constitucional dinâmica) Esse tipo de isomeria ocorre entre: enol e cetona; enol e aldeído. O que ocorre é que há um equilíbrio dinâmico entre os isômeros, já que um composto se transforma no outro de maneira contínua. Isso se dá por uma diferença de eletronegatividade entre átomos. Vejamos: