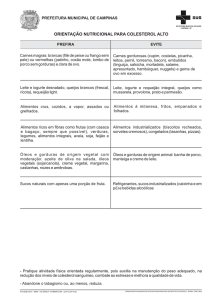
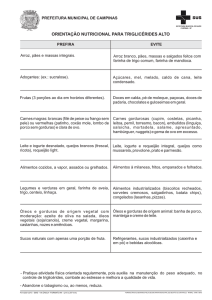
FACULDADE DE CIÊNCIAS AGRÁRIAS E VETERINÁRIAS, FCAV – UNESP
Jaboticabal
CURSO: Ciências Biológicas
DISCIPLINA: Química Orgânica
DOCENTE RESPONSÁVEL: Profa. Dra. Luciana Maria Saran
AULA PRÁTICA No 3: Reação de Saponificação
1. INTRODUÇÃO
Na presente aula prática, será efetuada a obtenção de um sabão pela reação de
saponificação de gordura animal. Trata-se de uma reação de hidrólise alcalina de ésteres.
As gorduras, os óleos e as graxas pertencem à classe de materiais orgânicos denominados
lipídeos. Essas substâncias são encontradas em plantas e animais e são os principais constituintes de
suas células armazenadoras, constituindo-se numa das mais importantes reservas alimentares desses
organismos. Embora o organismo humano sintetize lipídeos, as principais fontes de gorduras e
óleos na nossa dieta são os laticínios (creme de leite e manteiga), gorduras animais (toucinho,
bacon, etc.), gorduras vegetais sólidas (margarina) e gorduras vegetais líquidas (óleos de soja,
milho, amendoim, etc.). Além de sua importância como alimento, os lipídeos são utilizados na
manufatura de sabões, detergentes sintéticos e também na fabricação de glicerol (glicerina ou
propano-1,2,3-triol), óleos secantes, tintas e vernizes.
As gorduras animais e óleos vegetais são insolúveis em água, mas reagem lentamente com
soluções alcalinas (NaOH ou KOH) em ebulição, levando à formação de produtos solúveis em
água, os sabões. Tal reação é conhecida como reação de saponificação, que é a conversão de um
éster em um sal de ácido carboxílico e um álcool, conforme ilustra a equação química a seguir:
O
O
║
║
R2 – C – O – R1 + NaOH → R2 – C – ONa + R1OH
Éster
Sal de
Álcool
Ácido Carboxílico
No caso específico dos lipídeos constituintes de óleos e gorduras, a reação é dada pela
seguinte equação química:
OH
│
Glicerídeo + 3NaOH → HO - CH2CHCH2 – OH + 3RCOONa
Glicerol
Sal de
Ácido Carboxílico
Portanto, os óleos e gorduras são, na verdade, ésteres formados a partir da reação entre o
glicerol e ácidos carboxílicos (C-11 até C-17). Esses triésteres do glicerol são também conhecidos
como triglicerídeos, nos quais os três grupos OH do glicerol estão esterificados com o mesmo ácido
carboxílico.
Nos triglicerídeos mistos, o glicerol pode estar esterificado com dois ou três ácidos
diferentes. As graxas diferem dos óleos e das gorduras por não serem ésteres de glicerol.
Um sabão tem a fórmula geral RCOONa, em que R é uma cadeia carbônica contendo de 12
a 18 átomos de carbono. A característica estrutural mais importante de um sabão é que uma das
extremidades é altamente polar (iônica), enquanto a outra é apolar. Portanto, a extremidade polar
confere solubilidade em água (hidrofílica) e a extremidade apolar é insolúvel em água (hidrofóbica
ou lipofílica).
2. PROCEDIMENTO EXPERIMENTAL
2.1. Obtenção do Sabão
Em um erlenmeyer de 250 mL pese cerca de 5 gramas do material orgânico a ser utilizado e
acrescente ao mesmo 10,0 mL de glicerina e 1,20 g de hidróxido de potássio. Adapte um
termômetro, de forma que o bulbo do mesmo toque a mistura contida no Erlenmeyer.
Aqueça CUIDADOSAMENTE o frasco com um bico de gás, mantendo a temperatura em
torno de 150-160ºC, durante aproximadamente 30 minutos. Ao final desse tempo o
sistemadeve apresentar apenas uma fase. Interrompa o aquecimento e deixe a mistura
reacional resfriar lentamente.
Em seguida, adicione ao frasco cerca de 100 mL de uma solução saturada de NaCl, agitando
o material com um bastão de vidro.
Filtre a vácuo o precipitado formado, utilizando a própria solução filtrada para transferir
parte do precipitado que tenha ficado no Erlenmeyer
Após a filtração da mistura, a mangueira de vácuo deverá ser desconectada do funil e um
certo volume de solução saturada de NaCl deverá ser adicionado para cobrir o precipitado
no funil. A seguir, a mangueira de vácuo deverá ser reconectada ao funil, para que seja
realizada a sucção da solução de lavagem. Essa operação deverá ser realizada pelo menos
mais duas vezes.
Em seguida, espalhe o sabão obtido em papel-toalha, procurando secá-lo o máximo e
determine a massa obtida.
2.2. Testes de Qualidade
•
O primeiro teste de qualidade deverá ser realizado dissolvendo-se aproximadamente 0,5 g
do sabão em 50 mL de água destilada. Em seguida, separe três tubos de ensaio e coloque em
cada um cerca de 5 mL do colóide resultante da dissolução do sabão.
No tubo 1: adicione 2 mL de solução diluída de HCl;
No tubo 2: adicione 2 mL de uma solução que contenha íons magnésio ou cálcio;
No tubo 3: adicione 2 gotas de solução de fenolftaleína.
•
O segundo teste de qualidade deverá ser realizado adicionando-se cerca de 5 gotas de um
material líquido oleoso a um tubo de ensaio contendo 2 mL de água destilada. Agite o
sistema e deixe-o em repouso. A seguir, adicione ao tubo cerca de 5 mL do colóide de sabão
preparado inicialmente, agite o sistema e deixe-o em repouso.
•
Anote todos os resultados obtidos nesses conjuntos de testes.
•
O terceiro e último teste deverá ser realizado lavando-se as mãos com uma porção do sabão
obtido. Observe o cheiro, oleosidade, irritação ou não na mão e quantidade de espuma
formada.
3. QUESTÕES PARA FIXAÇÃO DE CONCEITOS
1. O que é um ácido graxo? Quais as diferenças entre ácidos graxos saturados e insaturados?
2. Qual a diferença entre uma gordura e um óleo?
3. Desenhe a estrutura do composto formado pela reação de uma molécula de glicerol com:
a) três moléculas de ácido palmítico; b) com uma molécula de ácido esteárico, uma de ácido
palmítico e uma de ácido oléico.
4. Quais os produtos formados quando uma gordura é saponificada?
5. Compare os termos hidrofóbico e hidrofílico.
6. Qual a diferença entre um ácido graxo insaturado e um poliinsaturado?
7. Como um ácido insaturado pode ser transformado em saturado? Que uso se faz deste
processo?
8. Compare sabões e detergentes com base em sua estrutura e em suas reações quando usados
em água dura.
9. Explique por que se adicionou solução de NaCl à mistura reacional e por que tal solução foi
usada na lavagem do sabão durante a etapa de filtração.
10. Escreva as equações químicas representativas das reações relativas aos testes de qualidade.
11. Como um sabão consegue remover as sujeiras?
12. O que é colóide?
4. REFERÊNCIAS
• BARBOSA, L. C. de. Introdução à Química Orgânica. São Paulo:Prentice Hall, 2004. 311 p.
• MARQUES, J. A.; BORGES, C. P. F. Práticas de Química Orgânica. Campinas, SP:Editora
Átomo, 2007. 222 p.
• UCKO, A. D. Química para as Ciências da Saúde: uma introdução à química geral, orgânica
e biológica. São Paulo:Manole, 1992. 646 p