CURSO E COLÉGIO
ESPECÍFICO
AULÃO TEMÁTICO
ÁGUA
2015
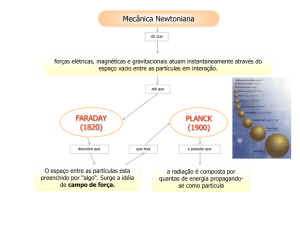
Propriedades Físicas
- A água pode ser encontrada na natureza em três
estados físicos: sólido (gelo), líquido, e gasoso (vapor
de água).
- No estado líquido é transparente, assumindo a cor
azul esverdeada em lugares profundos.
- Suas moléculas são interligadas por Ligações de
Hidrogênio.
- Possui uma densidade máxima de 1 g/cm3 a 4 °C e seu
calor específico é de 1 cal/°C. No estado sólido, sua
densidade diminui até 0,92 g/cm3.
- Suas temperaturas de fusão e ebulição à pressão de
uma atmosfera são de 0 e 100 °C, respectivamente.
Ela é um composto estável que não se decompõe em
seus elementos até 1.300 °C.
-Capacidade
térmica: quando se aquece um copo de
papel com água dentro, pode-se notar que o papel
não queima e a temperatura da água aumenta. Isso
acontece porque a água é capaz de absorver o calor
do papel. Essa propriedade é conhecida como
capacidade térmica.
-Solvente universal: a água é capaz de quebrar
substâncias como açúcar ou sal, por exemplo, em
partes tão pequenas que não conseguimos mais
enxergá-las. Essa capacidade de dissolver as
substâncias faz a água ser considerada um solvente
universal.
-Transporte: a água tem a propriedade de
transportar líquidos e partículas de substâncias.
Essa capacidade de transportar substâncias é vital
nos
seres
vivos,
pois
o
sangue,
feito
aproximadamente de 60% de água, transporta para
diferentes partes do corpo gases (como oxigênio, gás
carbônico), hormônios, nutrientes e produtos da
excreção.
-Tensão superficial: Por causa das características
físicas e químicas da água forma-se uma tensão
superficial. É uma força capaz de manter a água
unida, ou coesa, como se uma capa a cobrisse.
Objetos leves, como folhas e alguns insetos, não
conseguem romper essa camada. Por essa razão,
não afundam, e às vezes nem se molham.
O tratamento de água no Brasil.
• Adiciona-se coagulantes químicos como óxido
de cálcio (CaO2) e sulfato de alumínio (Al2SO4) que
promovem a aglutinação das partículas em
suspenção, facilitando sua disposição sobre a forma
de flocos.
A seguir, ocorre o processo de filtração que é a retenção de
partículas sólidas por meio de membranas ou leitos porosos.
As estações de Tratamento de Água (ETAs) utilizam filtros de
carvão ativado, areia e cascalho. Consiste em livrar a água das
partículas que não foram eliminadas nas etapas anteriores.
*
Sistema de tratamento completo.
Fica a questão de que os seres humanos poluem a água, e que
essa poluição não é proporcional as estações de tratamento no
Brasil e no mundo, ou seja as pessoas poluem mais a água do que à
tratam, em um futuro bastante próximo quem dirá se teremos água
potável para beber ou não, e as doenças causadas por ela? Seria
um caos.
Essa aula mostrou que é possível sim tratar a água, e é sim um
processo bastante viável, e que conseguiria tratar 100% da água
doce disponível no Brasil e no mundo, mas para isso precisamos do
principal que é ter consciência em gastar, sempre economizar como
puder, e esperar que a politica do nosso país e nossos cidadãos
tenham mais um pouco de organização e atenção para esse
assunto, antes que seja tarde demais.
Propriedades Químicas
-Fórmula molecular:H2O
-Tabela periódica: família e período
-Hidrogênio e ametal: Ligação covalente
-Molécula polar
-Solvente universal
-O arranjo destes átomos no espaço, com disposição
não linear das ligações (pontes de hidrogênio)
estabelece zonas positivas e negativas na molécula que
assim forma um ângulo de 104,5°, garantindo
propriedades intrínsecas e fundamentais a vida.
- Reage com os metais alcalinos (Li, Na, K, Rb e
Cs) formando uma base e desprendendo
hidrogênio:
Na + H2O → NaOH + H2.
- Reage com alguns óxidos metálicos para formar
hidróxidos, como por exemplo:
CaO + H2O → Ca(OH)2 (água de cal)
e com os não-metálicos para formar ácidos,
SO2 + H2O → H2SO3
(Um dos compostos formados na chuva ácida).