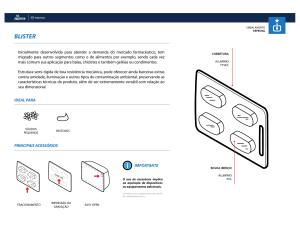
Centro Universitário Anchieta
Química Inorgânica II - Prof. Vanderlei I. Paula
Lista de Exercícios 1 – turma 2015 - Gabarito
Grupo 13/III-A
1) Descreva as reações de obtenção do elemento Boro a partir de:
a) bórax (Na2B4O7.4H2O);
Resposta:
b) BCl3
Resposta:
2 BCl3 + H2 2 B + 6 HCl
2) Explique com suas palavras o processo Bayer para obtenção da alumina pura a
partir do minério bauxita.
Resposta: O processo Bayer recebe esse nome em homenagem ao seu inventor Karl
Josef Bayer e desde 1888 é o principal processo industrial de produção mundial
de alumina (óxido de alumínio), Al2O3. No processo Bayer, a bauxita que contém
impurezas (~50%) é lavada com uma solução quente de hidróxido de sódio, NaOH, à
175°C (alta pressão para atingir temperatura maior que ebulição da água). A bauxita é
transformada em hidróxido de alumínio, Al(OH)3, que na presença de grande excesso
de base se dissolve via formação de aluminato de sódio de acordo com a equação
química:
Al2O3 + 2 OH- + 3 H2O → 2 [Al(OH)4]Os outros componentes da bauxita insolúveis são filtrados como impurezas sólidas.
Depois, a solução de hidróxido é resfriada, e o hidróxido de alumínio dissolvido
precipita-se em um sólido branco. Quando então aquecido a 1050°C, o hidróxido de
alumínio se decompõe em alumina, liberando vapor de água no processo conforme a
equação química:
2 Al(OH)3 → Al2O3 + 3 H2O
3) Descreva o processo Hall-Heroult para obtenção do alumínio a partir da alumina.
Qual o papel da criolita? (Sugestão: pg. 642 Atkins; pg. 1069 Russel).
Resposta: O processo de Hall-Heroult consiste no aprimoramento do processo
refinação da bauxita via alteração na constituição da mistura que é submetida à
descarga elétrica. Leva-se a bauxita já refinada a um forno elétrico aplicando-se uma
temperatura de 1050ºC, que sequencialmente é adicionado um fundente, a criolita, que
permite o abaixamento da temperatura de fusão do óxido de alumínio de 2000°C para
próximo de 1100°C. O óxido de alumínio fundido é condutor elétrico assim é possível
à execução da eletrólise para obtenção do alumínio metálico.
[email protected]
www.aquitemquimica.com.br
Centro Universitário Anchieta
Química Inorgânica II - Prof. Vanderlei I. Paula
Lista de Exercícios 1 – turma 2015 - Gabarito
4) Faça um resumo sobre hibridização, no resumo, inclua as hibridizações sp, sp2 e
sp3, monte um esquema indicando os subníveis, ângulos gerados por cada
hibridização. Por final faça um desenho dos orbitais híbridos.
Resposta: A teoria da ligação de valência permite entender resumidamente que as
ligações químicas são formadas pelo acoplamento entre orbitais. O acoplamento
ocorre até o máximo de dois elétrons por orbital (regra de Hund). Os orbitais são
representações matemáticas da densidade eletrônica, assim é possível entender que há
mudanças quando ocorre o acoplamento (ligação) entre os orbitais e também permite
pensar que os orbitais podem ser misturados (híbrido). A hibridização sp3 trata-se de
uma mistura do orbital s e dos três orbitais p, nesse caso em particular houve uma
mistura de quatro orbitais e irão ser gerados quatros novos orbitais híbridos sp3.
Interessante notar que os orbitais antes da hibridização podem ter energias diferentes e
após a hibridização todos os orbitais envolvidos no processo possuem a mesma
energia. A hibridização sp2 deixa um orbital p e a hibridização sp deixa dois orbitais p
fora do processo, podendo serem utilizados para ligações pi ().
Exemplo:
1 orbital s + 3 orbitais p 4 orbitais sp3
Unused p orbital
F
B
F
F
[email protected]
www.aquitemquimica.com.br
Centro Universitário Anchieta
Química Inorgânica II - Prof. Vanderlei I. Paula
Lista de Exercícios 1 – turma 2015 - Gabarito
5) Qual a diferença estrutural entre o etano e o diborano? O significa o termo “ligação
policentrada”? (Sugestão: pg. 198 Lee; pg. 646 Atkins).
Resposta: A diferença estrutural pode ser analisada na figura abaixo, o etano possui
ligações simples envolvendo dois elétrons em cada ligação conforme é conhecido
comumente pela teoria de ligação de valência (TLV). Já o diborano possui uma
ligação interessante entre B-H-B, pois nessa ligação há disponível dois elétrons em
três orbitais. A presença de três núcleos com dois elétrons, conhecido como ligação
3c, 2e; é denominada ligação em ponte no caso de hidrogênio e a ligação está
deslocalizada entre os três núcleos B-H-B, assim policentrada.
6) Qual a definição de ácido e base pela teoria de Bronsted? Dê três exemplos.
Resposta: A teoria ácido/base de Brönsted-Lowry é também conhecida como teoria
protônica. Ácido é uma substância capaz de ceder um próton a uma espécie química,
enquanto base é uma substância capaz de receber um próton.
A definição de Bronsted-Lowry é mais abrangente que a de Arrhenius, principalmente
pelo fato de nem todas as substâncias que se comportam como bases liberarem uma
hidroxila OH-, como é o caso da amônia (NH3). Além disso, a definição protônica não
condiciona a definição de ácidos e básicos à dissolução em meio aquoso.
Exemplo 1: HCl + H2O Cl- + H3O+
O HCl atua como ácido, pois doa H+, já a molécula de água atua como uma base,
pois recebe H+. A reação está representada em equilíbrio, veja a dupla seta (), assim
o cloreto formado (Cl-) é uma base, pois recebe H+ do ácido H3O+.
Exemplo 2: A piridina atua como base de Brönsted, pois recebe H+ do ácido
bromídrico.
Exemplo 3: NH3 + H2O NH4+ +OHA molécula de amônia atua como uma base de Brönsted, pois aceita H+ da molécula
de água, sendo a água um ácido de Brönsted nesse caso.
7) Qual a definição de ácido e base pela teoria de Lewis? Dê três exemplos.
Resposta: A teoria de ácido e base de Lewis envolve a transferência de um par de
elétrons, sendo a base toda a espécie capaz de doar um par de elétrons e o ácido a
espécie química correspondente a aceitação de um par de elétrons. A junção do ácido
é base é conhecido como aduto ácido-base ou complexo.
[email protected]
www.aquitemquimica.com.br
Centro Universitário Anchieta
Química Inorgânica II - Prof. Vanderlei I. Paula
Lista de Exercícios 1 – turma 2015 - Gabarito
+2
Exemplo 1: 1 Fe + 6 :NH3 [Fe(NH3)6]+2
Se uma solução de ferro(II) é colocada na presença de uma solução de amônia, o íon
de ferro(II) aceita um par de elétron da molécula de amônia, dessa forma o íon ferro
atua como ácido de Lewis e a molécula de amônia atua como uma base de Lewis. O
aduto formado (complexo) está representado por [Fe(NH3)6]+2 do qual há seis
moléculas de amônia doando um par de elétron para o ferro.
Exemplo 2: 2 Al2S3 + 3 :O2 2 Al2O3 + 6 :S
Geralmente todos os cátions atuam como ácido de Lewis. O átomo de alumínio no
sulfeto de alumínio (Al2S3) comporta como ácido de Lewis e o oxigênio e enxofre
atuam como base de Lewis. Na reação acima envolve a troca da base Lewis
coordenada ao átomo de alumínio.
Exemplo 3: H+ + :OH- H2O
O íon hidrônio (H+) atua como ácido de Lewis, enquanto o íon hidroxila (:OH-) atua
como base de Lewis, doando um par de elétrons.
8) Qual é a estrutura molecular exibida pelos trihaletos de boro? Por que os trihaletos
do grupo III são considerados ácidos de Lewis? (Sugestão: pg. 645 Atkins; pg. 1081
Russel).
Resposta: Os trihaletos de boro BX3 apresentam geometria molecular trigonal plana e
apresentam na forma monomérica. Nem todos os haletos do grupo III são
monoméricos, por exemplo, os haletos de alumínio podem apresentar como dímeros.
Os trihaletos do grupo III possuem um orbital p vazio e consequentemente podem
utilizar esse orbital para o recebimento de um par de elétrons (ácido de Lewis). Na
figura abaixo está representado o orbital p vazio do fluoreto de boro.
Unused p orbital
F
B
F
F
9) De que maneira os trihaletos de boro ou mesmo o diborano podem promover
sínteses orgânicas? (Sugestão: pg. 196 Lee; pg. 1081 Russel).
Resposta: Os trihaletos de boro são utilizados em várias sínteses orgânicas,
principalmente em reações que haja necessidade de ácidos de Lewis ou agentes
redutores como o caso para o diborano ou boroidretos como demostrado na figura
abaixo.
[email protected]
www.aquitemquimica.com.br
Centro Universitário Anchieta
Química Inorgânica II - Prof. Vanderlei I. Paula
Lista de Exercícios 1 – turma 2015 - Gabarito
Os compostos de podem gerar vários outros compostos como apresentado na figura
abaixo:
10) Explique a força relativa como ácidos de Lewis na série: BBr3 > BCl3 BH3 >
B(CH3)3.
Resposta: A força de acidez de Lewis está diretamente relacionada com a capacidade
aceptora de elétrons pela espécie química, seria de esperar que compostos bem
deficientes de elétrons tenham boa capacidade de aceitação de elétrons. A sequência
da acidez dos haletos de boro: BF3<BCl3<BI3 é bem interessante, pois esperar-se-ia
que o BF3 fosse o melhor ácido de Lewis, pois os átomos de flúor deixam o boro bem
deficiente de elétrons pela ligação sigma (simples). A acidez se mostra inversa pelo
fato que o flúor possui orbital p preenchidos e estão próximos e tem tamanho relativo
para o acoplamento bem efetivo, dessa forma o orbital p vazio do boro passam a
serem ocupados. Já para o triiodeto de boro o orbitais p preenchidos estão mais
afastados do orbital p vazio do boro e não possuem um tamanho relativo para um bom
acoplamento. A sequencia de acidez apresentada no exercício pode ser pensada pelo
mesmo princípio: BBr3 > BCl3 BH3 > B(CH3)3.
11) Como faria para demonstrar experimentalmente que o alumínio é anfótero?
Apresente as reações químicas.
Resposta: O alumínio reage com ácido e base por isso à denominação de anfótero.
reação 1: 2 Al + 2 NaOH + 2 H2O 2 Na[Al(OH)4] + H2
reação 2: 2 Al + 3 H2SO4 Al2(SO4)3 + 3 H2
A reação 1 o alumínio reage com um base, dessa forma está atuando como um ácido
de Brönsted. Na reação 2 o alumínio reage com um ácido, assim atua como uma base
de Brönsted. Como o alumínio atua como ácido ou base de acordo com o meio, é
denominado anfótero.
[email protected]
www.aquitemquimica.com.br
Centro Universitário Anchieta
Química Inorgânica II - Prof. Vanderlei I. Paula
Lista de Exercícios 1 – turma 2015 - Gabarito
12) O que significa aluminotermia? Qual sua importância industrial?
Resposta: Aluminotermina significa reações que promovem o aproveitamento do
intenso poder calorífico gerado pelo processo químico de oxidação do alumínio com o
intuito de obtenção de metais. Em outras palavras, o processo aluminotérmico
consiste na redução dos óxidos metálicos a partir do alumínio para a obtenção dos
respectivos metais. A importância industrial está no fato da facilidade de geração de
calor na promoção de soldas envolvendo ferro e no processo de obtenção de cromo
metálico.
Exemplo:
2 Al + Cr2O3 → Al2O3 + 2 Cr
2 Al + Fe2O3 → Al2O3 + 2 Fe
13) Cite as principais características dos compostos de boro.
Resposta: As principais características dos compostos de boro está centrada na sua
deficiência de elétrons, assim podendo seus compostos atuarem como ácido de Lewis.
O bórax (Na2[B4O5(OH)4] 8H2O) é utilizado na fabricação de vidros de borosilicato,
surfactante, obtenção de boro elementar, retardante de chama, preservativo de
madeiras (“Polybor” e “Timbor”). Os nitretos de boro possuem alto índice de refração,
portanto, são aplicados na indústria de cosméticos em geral. Nitretos de boro de
estrutura mole (lamelar) são empregados como lubrificantes que trabalham a altas
temperaturas e não condutor de corrente elétrica. A estrutura do nitreto de boro pode
ser dura como no caso do borazon, a alta dureza (mais próximo ao diamante) permite
ser utilizado em ferramentaria de corte e abrasivos.
14) Cite as principais características dos compostos de alumínio.
Resposta: O alumínio é um metal leve, macio e resistente. Possui um aspecto cinza
prateado e fosco, devido à fina camada de óxidos que se forma rapidamente quando
exposto ao ar. O alumínio não é tóxico como metal, não-magnético, e não cria faíscas
quando exposto a atrito. O alumínio puro possui tensão de 19 MPa a 400 MPa
Sua densidade é aproximadamente de um terço do aço ou cobre. É muito maleável,
muito dúctil, apto para a mecanização e fundição, além de ter uma excelente
resistência à corrosão e durabilidade devido à camada protetora de óxido. É o segundo
metal mais maleável, sendo o primeiro o ouro, e o sexto mais dúctil. Por ser um bom
condutor de calor, é muito utilizado em panelas de cozinha As aplicações do alumínio
são inúmeras:
-condutor elétrico (fios);
-laminados (fuselagem de aviões);
-carcaça de equipamentos (durabilidade);
-embalagens alimentícias (TETRA PAK, latas, papel alumínio);
-refletores automotivos;
-espelhos;
-bens de consumo (portas, janelas e outros);
-recipientes criogênicos;
[email protected]
www.aquitemquimica.com.br