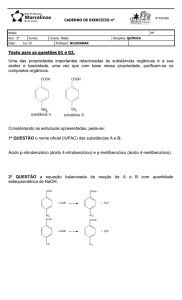
Aula: 14
Temática: Cálculos e objetivos da volumetria
Ao final desta aula você já terá ciência de como se promove
os cálculos mais empregados em procedimentos analíticos
desta natureza.
Lembrando novamente do objetivo de uma volumetria, e reafirmando que
o intuito é a identificação de concentração de uma solução, podemos calcular isso de modos diferentes, como por exemplo, para se calcular concentração ou volume, aí já temos uma infinidade de alternativas, a concentração do titulado; a concentração do titulante a se produzir; o volume que
necessito de amostra para fazer o procedimento; o volume esperado que
se utilize de titulante. Neste caso podemos aplicar dois métodos:
• Uma utilizando a equação da molaridade, pois no momento da neutralização, o número de mols do titulante é igual ao do titulado, e então, pode
se aplicar a equação duas vezes, uma para cada componente, e chegar
aos resultados.
M = nºmol / V (L)
• Outra, através da equação onde a concentração do ácido multiplicada
pelo volume do ácido será igual a multiplicação da concentração da base
e do volume da base.
C1 x V1 = C2 x V2, onde 1 e 2 serão titulante e titulado
Quando as concentrações estão expressas em alguma outra unidade que
não seja a molaridade, a única forma de se calcular as incógnitas é a segunda maneira.
Também deve se ter bastante claro o ambiente de se trabalhar com os
valores de pH, ou ainda pela equação já pronta, através de memorização:
pH = -log [H+] = log 1 / [H+] ou [H+] = 10-pH
[H+] = (Va.Ca) – ( Vb.Cb) / Va + Vb, onde “a” é o titulado e “b” é o titulante
Estas equações são as principais, pois trabalhamos em todas com volume, concentração e pH.
QUÍMICA ANALÍTICA QUANTITATIVA
51
Vamos resolver problemas?
PROBLEMA
Ao fazer uma volumetria de neutralização, utilizei uma solução de NaOH
0,1M, onde gastei 18mL para titular 5mL de uma solução de H2SO4. Qual a
concentração do ácido sulfúrico?
Pelo primeiro método podemos dizer que 0,1M = nºmol / 0,018 e que o
nºmol = 0,0018 = 1,8 . 10-3 sabendo que o nºmol é igual entre titulante
e titulado no ponto de equivalência, reutilizamos a equação para o ácido
M = 0,0018 / 0,005 = 0,36M.
Pelo segundo método, podemos aplicar a equação diretamente, onde sabemos que 0,1M x 18mL = C2 x 5mL C2 = 1,8 / 5 = 0,36M.
PROBLEMA
Qual o pH de uma volumetria onde a alteração de cor se deu no momento
em que tínhamos 8mL do titulante em concentração 0,15M; adicionado a
25mL de um titulado com concentração 0,1M?
Primeiro temos que substituir os dados na equação:
[H+] = (Va.Ca) – ( Vb.Cb) / Va + Vb = (25 x 0,1) – (8 x 0,15) / 25 + 8 =
0,03939
[H+] = 3,94 . 10-2
agora calculamos o pH por pH = -log [H+] = - log 3,94 . 10-2 = 1,40.
Você entendeu as resoluções? Fácil? Treine com estes dois exercícios:
1) Qual é a concentração de 15mL de um titulado, que teve seu ponto de
equivalência quando se adicionou 27mL de um titulante à 1,5N? (perceba
sempre a unidade)
2) Qual o pH no ponto de equivalência de uma volumetria onde foram usados 64mL de titulante à 0,1M, e 150mL de titulado à 0,06M?
RESPOSTAS:
1) 2,7N
2) 1,64
52
QUÍMICA ANALÍTICA QUANTITATIVA
Agora, descanse um pouco para a próxima aula, pois aprenderemos as forças dos ácidos e das bases.
QUÍMICA ANALÍTICA QUANTITATIVA
53