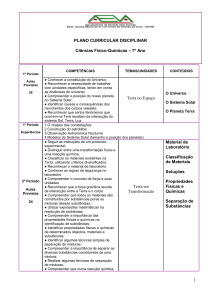
A REACÇÃO QUÍMICA ENTRE O HIDRÓXIDO DE BÁRIO E O CLORETO DE
AMÓNIO
INTRODUÇÃO
Grande parte das reacções químicas absorve ou liberta energia, usualmente, sob
a forma de calor.
Calor consiste em energia em transferência entre dois sistemas (parte específica
do Universo que nos interessa estudar) (Chang, 2004)) que se encontram a temperaturas
diferentes.
Os sistemas podem ser classificados, de acordo com as trocas que pode efectuar
ou não com a vizinhança (parte do Universo que rodeia o sistema), em:
Sistema aberto, onde são permitidas tanto trocas de energia como trocas
de massa.
Sistema fechado, onde apenas trocas energéticas são permitidas.
Sistema isolado, onde não existem nem trocas de energia nem trocas de
massa (O único sistema isolado que existe na realidade é o Universo, pois
o Universo consiste em tudo o que existe).
A ocorrência de uma reacção química implica, necessariamente, que os
reagentes possuam energia interna (U) suficiente para transformarem-se em produtos da
reacção. Os reagentes podem variar a sua energia interna ao transformarem-se em
produtos.
Recorrendo à primeira Lei da Termodinâmica, que enuncia que um sistema só
pode ter variações de energia interna (ΔU) se para ele ou dele for transferida energia sob
a forma de calor (Q), trabalho (W) e/ou radiação (R):
ΔU = Q + W + R
Pode concluir-se que a energia absorvida sob a forma de calor por um sistema
reaccional químico, mais a energia sob a forma de trabalho realizado sobre o sistema,
promovem um aumento da energia interna dos produtos da reacção. Por outro lado, a
energia libertada sob a forma de calor pelo sistema reaccional químico, mais a energia
sob a forma de trabalho realizado pelo sistema, promovem uma diminuição da energia
interna dos produtos da reacção.
De acordo com as transferências de energia que ocorrem durante a ocorrência de
uma reacção química, pode classificar-se ainda as reacções químicas em:
Reacções químicas endoenergéticas – reacções que ocorrem com absorção
de energia das vizinhanças.
Reacções químicas exoenergéticas – reacções que ocorrem com libertação
de energia para as vizinhanças.
Em sistema isolado, ainda pode dizer-se que uma reacção química
endoenergética ocorre com diminuição da temperatura e, por outro lado, uma reacção
química exoenergética ocorre com aumento da temperatura.
A quantidade de energia transferida durante uma reacção química é definida por
uma grandeza física denominada de entalpia (H). Então, quando ocorre uma reacção
química, que sofra variações de energia interna, existe sempre uma variação de entalpia,
ΔH, (entalpia de reacção). A variação da entalpia é igual à quantidade energia
transferida, sob a forma de calor, durante a ocorrência de uma reacção química. De
acordo com esta definição, pode estabelecer-se um novo critério de classificação para as
reacções químicas:
Quando uma reacção química tem uma variação de entalpia negativa, isto
é, liberta energia sob a forma de calor, a reacção é exoenergética (ΔH<0).
Quando uma reacção química tem uma variação de entalpia positiva, ou
seja, recebe energia sob a forma de calor, a reacção é endoenergética
(ΔH>0).
Nesta
actividade
laboratorial
estuda-se
qualitativamente
a
reacção
endoenergética entre o hidróxido de bário e o cloreto de amónio. Esta reacção química é
traduzida pela equação química:
Ba(OH)2 (s) + 2NH4Cl (s) → Ba2+ (aq) + 2Cl- (aq) + 2NH3 (aq) + 2H2O (l) ΔH > 0
Durante a realização desta actividade laboratorial verificar-se-á a diminuição da
temperatura das vizinhanças durante o decorrer da reacção química referida.
Esta actividade teve por base uma proposta de University of Wisconsin-Madison:
Chemistry Department - Demonstration Lab (2000).