77
78
79
Em relação aos casos de raiva em morcegos não-hematófagos no
Estado de São Paulo, três trabalhos citam dados que demonstram o
conhecimeto epidemiológico atual. Albas et al. (2005) descreveram o
diagnóstico do RABV efetuado em 4950 amostras animais, entre 1996 e
2003, na região oeste do Estado de São Paulo e, do total, 74 foram
positivas, 58 destas amostras (78.4%) são de morcegos não hematófagos e
16 (21.6%) de bovinos, animal costumeiramente infectado pelo D. rotundus.
Scheffer et al. (2007), que identificaram morfologicamente as espécies de
animais infectados pelo RABV, descreveram o resultado do diagnóstico de
4395 amostras de morcegos, no período de abril de 2002 a novembro de
2003, de diversas regiões do mesmo Estado, e a positividade alcançou 1,9%
(84 casos). Deste valor, não houve a descrição de casos em D. rotundus,
apesar de 10 Gêneros de morcegos serem descritos, predominantemente
insetívoros. Cunha et al. (2006), entre 1997 e 2002, diagnosticaram para a
raiva 7393 morcegos do norte e noroeste do Estado de São Paulo. Entre
todos, 1,3% foram positivos para a raiva, que também foram identificados
morfologicamente, constatando que os animais eram predominantemente
insetívoros, mas alguns frugívoros também o foram.
A análise da Figura 15 (Série histórica de casos de raiva em humanos
por Estado no Brasil, 1986-2008) permite que se afirme que, ano após ano,
a situação da raiva no Brasil tem melhorado. Quanto aos anos de 2004 e
2005, quando houve um aumento surpreendente nos casos de raiva
humana, é necessário esclerecer que os casos ocorreram em áreas da
Amazônia, nos Estados do Pará e Maranhão e foram transmitidos por D.
rotundus. Este tipo de surto, que ocorre esporádicamente, é basicamente
relacionado a deficiência dos serviços de saúde locais e fatores sócioculturais.
A Figura 16, que mostra a Série histórica de animais transmissores de
raiva humana no Brasil, 1986-2007, complementa a Tabela 15, comentada
anteriormente. Contudo, é notável o decréscimo no número de casos
relacionados a cães e gatos e aos casos onde o transmissor foi
indeterminado (ignorado). O decréscimo no números de “ignorados” se deve
basicamente a melhora da vigilância epidemiológica e a disponibilidade de
métodos moleculares para a identificação do vírus.
Para complementar a análise é apresentada a Tabela 8, que mostra o
número de casos de raiva por espécie no Brasil no ano de 2009 (dados
parciais até 23 de julho).
80
Para finalizar este tópico, sobre a epidemiologia da raiva no Brasil, é
fundamental citar alguns dados da Secretaria de Vigilância em Saúde, do
Ministério da Saúde do Brasil (SVS/MS).
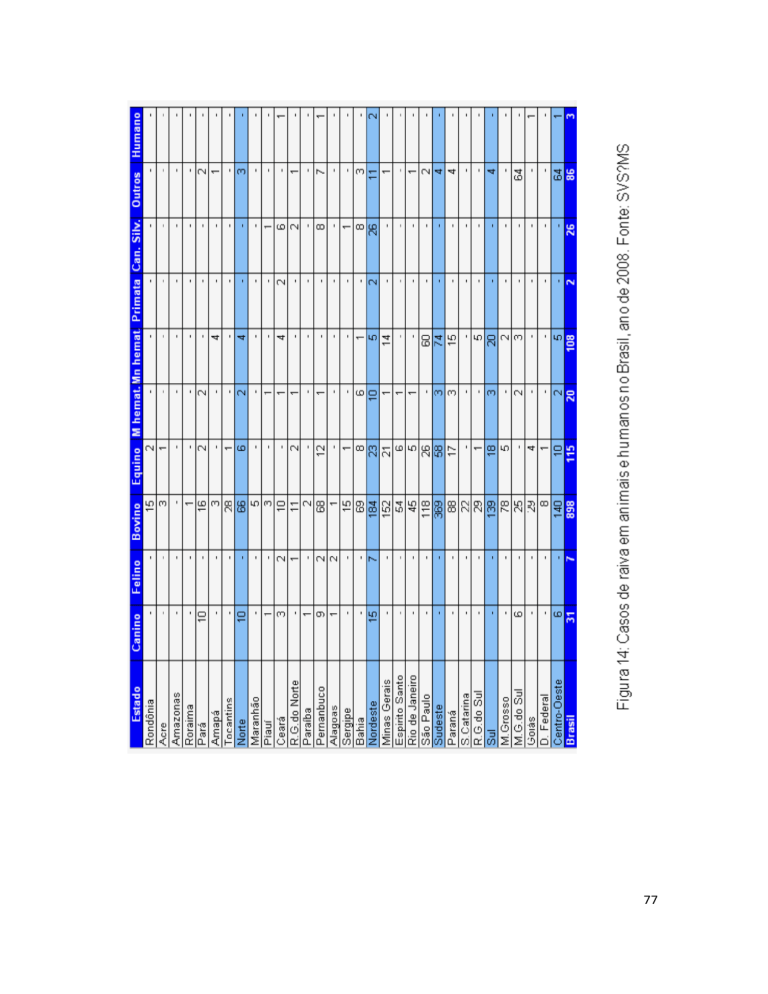
Em 1998 foram diagnosticados 1746 casos em cães e em 2006, 67
casos. Esta redução é produto do Programa Nacional para o Controle da
Raiva em Cães e gatos. Entre 1986 e 2006, um total de 758 casos de raiva
humana foi diagnosticado. Os cães foram responsáveis por 524 destes
casos (69.1%), gatos por 30 (4%), morcegos por 130 (17.1%), primatas nãohumanos por 14 (1.9%) e canídeos silvestres por 13 (1.7%).
A efetiva vigilância epidemiológica relacionada a animais silvestres
aumentou por volta do ano de 2000, e hoje, se encontra em ascensão (Kotait
et al., 2007). Utilizando dados da Secretaria de Vigilância em Saúde do
Ministério da Saúde do Brasil (SVS/MS) é possível comprovar a plenitude da
vigilância epidemiológica dirigida aos animais silvestres. O número de
ataques de animais silvestres a humanos notificados em 1999 e 2005 foram,
respectivamente, 35 e 16334. Nos mesmos anos os morcegos foram
responsáveis, respectivamente, por 29 e 11811 ataques, primatas nãohumanos por 05 e 3360 e canídeos silvestres e outras espécies de menor
importância epidemiológica, como gambás e guaxinins, 01 e 1163 ataques,
respectivamente. É importante salientar que associada à vigilância
epidemiológica o esforço governamental direcionado a educação foi de
grande importância.
Tabela 8: Número de casos de raiva por espécie no Brasil no ano de
2009. Dados parciais até 23 de julho. Fonte: SVS/MS.
Espécie
Número de casos
Cão
Gato
Bovino
Eqüino
Morcego hematófago
Morcego não-hematófago
Primata não humano
Canídeos silvestres
Outros animais
Humano
Total no Brasil
6
1
362
40
12
61
0
5
9
1
497
81
1.5.6.1.As variantes antigênicas e linhagens genéticas do RABV no
Brasil
A primeira tipificação antigênica do RABV no Brasil foi publicada em
2001 (Favoretto et al., 2001) e é a única tipificação antigênica e genética de
isolados do RABV de primatas no mundo. Supõe-se que o reservatório desta
linhagem do RABV é o sagüi de tufo branco (Callithrix jacchus). Apesar de
poucos casos conhecidos e relatados, os isolados são todos da região
Nordeste do país, a maioria deles do Estado do Ceará. Esta variante
antigênica não possui relação com outros reservatórios e não havia sido
prevista durante a produção do painel de MAbs distribuído pela OPAS e, por
isto, não possui, ainda hoje, uma nomenclatura oficial estabelecida.
Favoretto et al., (2002) tipificaram 330 isolados do vírus de várias
espécies e foram estabelecidas as quatro variantes antigênicas circulantes
no Brasil: AgV2 (cão), AgV3 (D. rotundus), AgV4 (Tadarida brasiliensis) e
AgV6 (Lasiurus cinereus). Além destas quatro variantes, outra variante
antigênica, AgV5 (morcego hematófago da Venezuela), também foi
identificada, porém não é comumente encontrada no país. Além das quatro
variantes acima mencionadas, outros seis perfis antigênicos não
determinados foram descritos. Os herbívoros de interesse econômico
(bovinos, eqüinos, ovinos, etc.), foram tipificados como AgV3.
No oeste do Estado de São Paulo, foram tipificados antigenicamente
isolados do RABV de morcegos não hematófagos e foram detectadas,
circulando na população dos animais as variantes antigênicas AgV3 e AgV4,
típicas de D. rotundus e T. brasilensis, respectivamente (Albas et al., 2009).
Em Portel e Viseu, cidades do Estado do Pará, 21 pessoas morreram
de raiva em 2004. As amostras isoladas em humanos, coletadas após o
falecimento das vítimas, foram tipificadas antigenicamente e geneticamente
como AgV3, típica de D. rotundus (da Rosa et al., 2006).
Schaefer et al. (2005), utilizando um painel de MAbs produzidos no
Estado do Rio Grande do Sul e, portanto, não aquele distribuído pela OPAS
e regularmente utilizado nas Américas, tipificaram antigenicamente isolados
do RABV de várias espécies animais de várias regiões do Brasil. Os autores
descreveram dois agrupamentos principais, cães e D. rotundus, que foi
concordante com a tipificação genética também descrita no trabalho. Ao
analisar os morcegos insetívoros os autores descreveram “espécieespecificidade”, pois houve a formação de agrupamentos por espécie.
A caracterização genética do RABV no Brasil e em todos os outros
países, se faz, principalmente, pelo seqüenciamento do gene N, mas um
82
número expressivo de trabalhos analisaram o gene G e, secundariamente, a
região intergênica G-L. Quanto ao tamanho das seqüências geradas é
variável, alguns autores utilizam os genes inteiros, outros, pequenas regiões,
tanto da região amino-terminal como, também, da carboxi-terminal.
O primeiro trabalho publicado relacionado à tipificação genética do
RABV no Brasil foi o de Ito et al. (2001), onde os autores seqüenciaram 203
nt do gene N e determinaram as duas principais linhagens do vírus no país,
cães e D. rotundus. Os autores também descreveram que a identidade
genética dos isolados de cães utilizados no trabalho foi maior que 99%,
enquanto que em D. rotundus maior que 96,6%. A partir deste trabalho
pioneiro, a caracterização genética do RABV mostrou a real diversidade do
vírus no país e outros se seguiram, mas uma clara dicotomia foi
estabelecida, o estudo genético do RABV isolado em canídeos e em
morcegos, com exceção ao de Favoretto et al. (2001), discutido durante as
citações relacionadas as tipificações antigênicas, no qual os autores
descrevem o RABV isolado do primata sagüi de tufo branco (Callithrix
jacchus).
Quanto aos canídeos, os trabalhos de Carnieli et al. (2006, 2008,
2009), que estudaram toda a região codante dos genes N e G e parte da
região intergênica G-L do RABV, estabeleceram um novo biotipo
(reservatório) da raiva na região Nordeste do Brasil, o cachorro do mato
Cerdocyon thous. Os autores identificaram linhagens regionais do vírus que
circulam em C. thous e em cães e identificaram geneticamente o hospedeiro
pela análise de DNA mitocondrial. Além do citado anteriormente, os autores
sugeriram que as linhagens do RABV circulam entre C. thous e cães,
podendo ser transmitidas entre os dois animais sem perder suas identidades
genéticas, pois mantém as assinaturas genéticas (marcadores genéticos)
das linhagens do vírus, que são específicas para as duas espécies de
canídeos.
No mesmo contexto, os trabalhos de Bernardi et al. (2005), Sato et al.
(2006) e Kobayashi et al. (2007), que estudaram geneticamente o RABV de
várias espécies de animais das regiões Norte e Nordeste do Brasil, também
estudaram canídeos silvestres do Estado da Paraíba, porém os identificaram
como Pseudalopex vetulus (raposinha do campo).
Schaefer et al. (2005) e Favoretto et al. (2006), que também estudaram
geneticamente o RABV isolado de várias espécies de animais, citam o
canídeo silvestre C. thous como aquele encontrado na região Nordeste do
Brasil.
83
Dos trabalhos citados nos dois parágrafos anteriores e relacionados a
canídeos, suas análises de maneira global indicam que o RABV isolado de
canídeos possui uma identidade média divergente das linhagens de D.
rotundus, calculada em 10%. Porém, entre as linhagens do RABV isoladas
de canídeos há uma evidente regionalização. No caso dos cães, esta
divergência, provavelmente, é determinada pelo deslocamento humano e
seus cães e gatos (Carnieli et al., 2008).
A tipificação genética do RABV isolado de morcegos iniciada por Ito et
al. (2001) se diversificou para outras espécies de quirópteros, além do D.
rotundus. Kobayashi et al. (2005), analisando amostras do RABV isoladas de
espécies frugívoras, insetívoras e de D. rotundus, relataram linhagens
associadas a morcegos Artibeus spp (frugívoro), D. rotundus e morcegos
insetívoros, sugerindo haver linhagens espécies-específicas. Kobayashi et
al. (2007), continuando a pesquisa anterior, obteve uma linhagem associada
aos morcegos insetívoros do Gênero Lasiurus. Oliveira (2009), em estudo
com diferentes espécies de morcegos, relatou diferentes linhagens do RABV
associadas a diferentes espécies de morcegos insetívoros, sugerindo haver,
linhagens espécies-específicas e Gênero-específicas.
O estudo das linhagens do RABV que infectam os animais de interesse
econômico são, em sua maioria absoluta, transmitidas pelo D. rotundus.
Apesar do grande número de animais de interesse econômico infectados
pelo RABV ser diagnosticado é pequeno o número de D. rotundus
encontrados infectados. Por este motivo o estudo das linhagens do RABV
que circulam entre estes morcegos são estudadas indiretamente, isto é, pelo
uso de isolados do vírus de bovinos e eqüinos.
Romijn et al. (2003), analisando parcialmente o gene N do RABV
isolados de bovinos no Estado do Rio de Janeiro, obteve agrupamentos
regionais do vírus. Bordignon et al. (2005), no Estado de Santa Catarina e
também analisando parcialmente o gene N do RABV, obteve um
agrupamento de linhagens típicas do Estado de Santa Catarina. Sato et al.
(2006), analisando 599 nt do gene G de isolados do RABV de várias
espécies dos Estados do Maranhão, Pará e Tocantins, identificaram
linhagens do vírus associadas a canídeos e D.rotundus. Kobayashi et al.
(2006), analisando parcialmente o gene N do RABV isolados de bovinos, de
vários Estados das regiões Sudeste e Centro-Oeste, sugerem a existência
de linhagens regionais formadas pelo isolamento geográfico determinado por
montanhas e rios. Kobayashi et al. (2008), continuando o trabalho anterior,
agora com 593 isolados do RABV de um maior número de Estados e
seqüenciando 202 nt do gene N, descreveram 24 linhagens regionais do
vírus, originadas por isolamento geográfico.
84
1.5.7.O Desmodus rotundus e a raiva em bovinos
A raiva bovina é um problema econômico e de saúde pública e
veterinária. Germano et al. (1992), associa o aumento populacional de
bovinos, ao longo da história, com o aumento da população do transmissor
do RABV para esta espécie, o morcego hematófago Desmodus rotundus
(Figura 17). Sendo assim, o estudo deste morcego é de fundamental
importância para a compreensão da raiva em bovinos e, também, em outros
herbívoros da América Latina.
Carini (1911) foi o primeiro a associar a raiva em herbívoros aos
morcegos, pesquisando a morte de, aproximadamente, 5000 animais no
Estado de Santa Catarina. Além deste fato, é importante salientar que Carini
foi o primeiro a associar a raiva a morcegos e, por isto foi severamente
combatido em sua época. Carneiro e Freitas Lima (1927) descreveram a
mesma situação no Estado do Paraná, mas a aceitação de que os morcegos
são também transmissores da raiva somente ocorreu na década de 1930
com a publicação de estudos semelhantes aos de Carini, na Ilha de Trinidad
(Pawan, 1936).
1.5.7.1.A biologia do Desmodus rotundus
D. rotundus é um quiróptero excepcionalmente ágil e furtivo na
natureza e é considerado um dos morcegos mais evoluídos em relação ao
Sistema Nervoso (Bhatnagar, 2007).
A Ordem Chiroptera é dividida em duas subordens, Megachiroptera e
Microchiroptera. Entre os microquirópteros existem 17 famílias e, no Brasil,
existem nove famílias desta subordem. Os morcegos hematófagos, como o
D. rotundus, pertencem à família Phyllostomidae, subfamília Desmodontinae
da subordem Microchiroptera (Reis et al., 2007).
A subfamília Desmodontinae é composta por três espécies e possuem
o hábito alimentar hematófago (Gardner, 1977) Entre as três espécies de
hábito hematófago D. rotundus é a espécie de maior ocorrência e é muito
estudada por ser associada à transmissão do RABV aos herbívoros na
América Latina. Esta espécie alimenta-se preferencialmente de sangue de
mamíferos (Taddei, 1983). Diphylla ecaudata é considerada a segunda
espécie em importância, seguida por Diaemus youngi, e ambas possuem
preferência por sangue de aves (Uieda, 1992).
85
Figura 17: Imagens de diferentes fenótipos de Desmodus rotundus. As
duas imagens superiores mostram a pelagem castanha, comum e, abaixo,
alaranjada e albina, raras. Fotos: W. Uieda.
Como todas as espécies da subfamília Desmodontinae, D.rotundus não
possui cauda, apresenta redução do apêndice nasal e da dentição, com
incisivos e caninos extremamente afiados (Greenhall, 1988). Sua coloração,
geralmente, é pardo-ferruginoso na parte dorsal do corpo e cinza claro na
parte ventral. O comprimento total varia de 69 a 90 mm; antebraço de 52 a
63 mm. Seu peso varia entre 25 e 40 gramas, sendo que as fêmeas são
maiores que os machos (Greenhall, Joermann, Schmidt, 1983).
D. rotundus ocorrem desde Sonora, Nuevo León e Tamaulipas, no
México, Ilha Margarita, na Venezuela, Trinidad, Bolívia, norte do Chile,
Brasil, Paraguai, Uruguai até o norte da Argentina (Peracchi et al., 2006).
Esta espécie não tolera climas frios, não ocorrendo em locais que possuam
temperatura média inferior a 10ºC no mês mais frio do ano (Greenhall,
Joermann, Schmidt, 1983).
D. rotundus não hibernam, porém o consumo alimentar e a atividade
muscular aumentam quando ficam expostos a baixas temperaturas (Wimsatt
e Guerriere, 1962). Estes morcegos têm capacidade termo regulatória
imprevisível, quando a temperatura ambiental diminui, a temperatura
corporal é normalmente mantida entre 33 e 37ºC pelo aumento da atividade
motora. Se a temperatura corporal chegar a 20ºC os D. rotundus não são
capazes de se aquecerem novamente (Wimsatt e Guerriere, 1962). São
86
também muito sensíveis a altas temperaturas, pois quando expostos entre
37 e 38ºC podem morrer (Greenhall, Joermann, Schmidt, 1983).
D. rotundus são noctívagos, normalmente se abrigam em refúgios
escuros e úmidos (Taddei, 1983), vivem em colônias com aproximadamente
10 a 200 indivíduos, refugiando-se em locais de difícil acesso; utilizam
muitos tipos de abrigos e podem dividir esse espaço com outras espécies de
morcegos (Arellano-Sota, 1988; Greenhall, Joermann, Schmidt, 1983). Suas
colônias geralmente são pequenas, porém já foram registradas
aglomerações com até 2000 morcegos (Wilkinson, 1988). As colônias,
geralmente, ocorrem em regiões de serra com muitas cavernas, onde o
serviço de vigilância e controle da agricultura tem dificuldade de acesso aos
seus abrigos (Uieda, 1996).
Os abrigos são muito importantes para esses animais, pois são locais
onde passam a maior parte do seu ciclo de vida. Nesses locais ocorre
repouso, interações sociais e reprodutivas, de proteção contra predadores e
más condições ambientais, como chuva e vento (Uieda, 1996).
Há uma grande variedade de tipos de abrigos que são utilizados pelo
D. rotundus. Originalmente são encontrados, principalmente, em cavernas,
matacões (afloramento de grandes pedras), oco de árvores, entre outros de
origem natural. Todavia, abrigos artificiais como túneis, bueiros, casas
abandonadas, cisternas, minas abandonadas, entre outros, podem
perfeitamente albergar colônias (Gonçalves et al., 1996) (Figuras 18 e 19).
Como comumente encontrado em mamíferos gregários, os D. rotundus
apresentam uma estrutura social caracterizada por hierarquia de
dominância, baseada na formação de um harém, onde um macho dominante
protege um grupo de fêmeas e seus filhotes. O macho dominante fica no alto
do abrigo, rodeado pelas fêmeas, e os outros machos ficam em localizações
periféricas na própria colônia ou são expulsos dos abrigos quando atingem a
idade entre 12 e 18 meses. Os filhotes machos e solteiros podem
permanecer próximos do harém à espera de uma oportunidade para
ocuparem o posto de dominância ou sair à procura de outros locais para
constituir o seu próprio harém ou, ainda, formar agrupamentos de machos,
geralmente a uma distância mínima de 3 km daquela de onde nasceram
(Wilkinson, 1988; Bredt et al., 1998).
O tempo de gestação da espécie é de sete meses e os nascimentos,
em geral, estão concentrados na estação chuvosa (Lord, 1992). As fêmeas
possuem maior fidelidade aos abrigos e aos membros da colônia as quais
pertencem (Gomes, Uieda, Latorre, 2005). Tal fidelidade pode ser
exemplificada pelos comportamentos de limpeza mútua e regurgitação
87
recíproca de alimento entre as fêmeas e entre mães e filhotes (Wilkinson,
1988).
O macho dominante, além de possuir maior acesso às fêmeas, também
se alimenta em localidades mais próximas do abrigo, já os machos
periféricos percorrem grandes distâncias para se alimentarem, podendo
desta forma sobrepor a sua área de alimentação com as de outras colônias
(Wilkinson, 1988).
Os morcegos hematófagos, normalmente, se alimentam em uma área
de 5 a 8 km ao redor dos abrigos diurnos (Crespo et. al., 1961). Em
condições ambientais favoráveis, sua atividade alimentar pode se iniciar por
volta de uma a duas horas após o pôr-do-sol e terminar por volta de uma
hora antes do alvorecer (Uieda, 1992). No verão, contudo, foi verificado que
os morcegos deixam os abrigos após as 21 horas e no inverno após as 22
horas (Villa, 1966). Isto confirma que estes morcegos só saem para se
alimentar quando a escuridão é completa, podendo fazer um vôo preliminar
para checar a luz da lua (Crespo et. al., 1961).
Comportamentos agonísticos, inserção de novos indivíduos nas
colônias, limpeza mútua, troca de regurgitado, deslocamentos dos indivíduos
entre abrigos e reorganização de colônias podem ser considerados, entre
outros eventos, como a base da transmissão e da dinâmica da raiva entre
morcegos que, certamente, reflete na dinâmica da enfermidade em bovinos
(Lord, 1992; Gomes, Uieda, Latorre, 2005).
Geralmente, um conjunto de colônias é composto por uma colônia
principal, na qual está o maior número de indivíduos, e ao seu redor há as
denominadas colônias satélites e/ou agrupamentos de machos que ainda
não formaram seu harém (Wilkinson, 1988). Os morcegos desse conjunto de
abrigos/colônias transitam entre si segundo seus comportamentos de
interação, possibilitando que o RABV seja transmitido de forma intraespecífica e, conseqüentemente, aos bovinos atacados por morcegos
infectados (Wilkinson, 1988). Outros motivos podem incrementar o
deslocamento de morcegos entre abrigos, como a divisão do clima em
épocas chuvosas e secas, a inundação de abrigos e seca extrema (Taddei
et al., 1991). Segundo Flores-Crespo e Arellano-Sota (1991), a espécie D.
rotundus usualmente utiliza um território de ação de aproximadamente 10 a
20 km2.
88
Figura 18: Imagens de abrigos artificiais de Desmodus rotundus.
Fotos: J.J. Ferrari.
89
Figura 19: Imagens de abrigo artificial (mina abandonada) de
Desmodus rotundus e outros morcegos. Foto: J.J. Ferrari.
Estudos da atividade de morcegos hematófagos em currais indicam
que o período no qual os morcegos se alimentam, está relacionado à
ausência de luar (Crespo et. al., 1972).
Antes de se alimentar, D. rotundus faz um “vôo de reconhecimento” ao
redor do animal em locais abertos (Greenhall, Schmidit, López-Forment,
1971). Acredita-se que esses vôos sejam um comportamento de
ambientação, no qual os morcegos examinam e escolhem suas presas
(Sazima, 1978).
A aproximação do D. rotundus às suas presas pode ser feita de duas
maneiras: pouso direto no corpo da presa ou pelo chão (Uieda, 1996). A
reação dos animais à aproximação dos morcegos geralmente ocorre quando
estes pousam em seu corpo, movimentando a cabeça, cauda e a
musculatura da pele (Greenhall, Schmidit, López-Forment, 1971). Durante a
aproximação da presa, os D. rotundus ficam cautelosos a qualquer reação
da vítima. A qualquer sinal de perigo ele se afasta do local até que o perigo
cesse ou abandona este animal e sai à procura de outra presa mais
acessível (Uieda, 1996). Após a aproximação, os morcegos escolhem um
local apropriado para morder sua presa (Figuras 20 e 21). D. rotundus pode
gastar cerca de 40 minutos para escolher um local no corpo para morder
(Greenhall, 1972).
90
Figura 20: Cavalo sendo atacado pelo Desmodus rotundus. Observar
morcego e ferimento causado pela espoliação no pescoço do cavalo. Foto:
J.J. Ferrari.
91
Figura 21: Detalhe da Figura 20 (cavalo sendo atacado pelo
Desmodus rotundus). Observar morcego e ferimento causado pela
espoliação no pescoço do cavalo. Foto: J.J. Ferrari.
Ao alimentar-se, D. rotundus prefere extremidades do corpo, tais como
orelhas, pescoço, região anal, vulva, mamilos, focinho e cauda, entre outros.
A presa é perfurada com os dentes incisivos afiados deixando um ferimento
característico. Sua saliva possui enzimas que evitam a coagulação do
sangue e dois canais, um de cada lado da língua, lhes permitem sugar o
sangue (Greenhall, Joermann, Schmidt, 1983).
Um morcego pode ingerir entre 15 e 25 mL de sangue em uma presa e
um animal pode ser visitado por vários morcegos na mesma noite
(Constantine, 1979). O tempo necessário para a alimentação dos morcegos
hematófagos depende das reações da vítima durante a refeição, geralmente
D. rotundus gasta em torno de 30 minutos, podendo eventualmente chegar à
uma hora (Uieda, 1996).
Enquanto o morcego se alimenta foi observado eliminação de urina,
que pode ser uma forma de esvaziar mais rapidamente o estômago,
possibilitando maior consumo de alimento ou maior facilidade em alçar vôo
durante a alimentação, se for necessário (Uieda, 1996).
92
Após a alimentação o morcego hematófago pode usar um abrigo
noturno ou temporário que serve como local de descanso e ambientação.
Esses abrigos estão situados próximos às fontes de alimento e podem ser
casas de máquina, estábulo, paiol, porão ou mesmo vegetação próxima
(Sazima, 1978).
D. rotundus podem reabrir ferimentos feitos em noites anteriores, pois a
reabertura é feita em poucos minutos, o que diminui seu tempo a eventuais
riscos que podem ocorrer durante sua alimentação, como coices ou
mordidas (Greenhall, Joermann, Schmidt, 1983).
Pelo fato de ter o hábito alimentar exclusivamente hematófago, D.
rotundus é um potencial transmissor do vírus da raiva e os prejuízos
causados pela raiva em herbívoros transmitida por este morcego são
notáveis (Mayen, 2003).
Ainda, um aumento surpreendente no número de casos de raiva
humana, transmitidos por D. rotundus ocorreu no Brasil nesta última década.
Entre os anos de 2004 e 2005, dezenas de pessoas contraíram raiva
transmitida por estes animais na Região Amazônica brasileira (da Rosa et
al., 2006) e outros relatos similares de raiva humana na Região Amazônica
já haviam sido documentados (Warner et al., 1999). Na América Latina, do
ponto de vista epidemiológico, D. rotundus constituem o principal
reservatório silvestre do RABV, mas outros quirópteros não hematófagos
também têm papel na transmissão do vírus (Favi et al., 2002).
1.5.8.A dinâmica da raiva em bovinos
No Estado de São Paulo, na década de 1980, houve uma epidemia,
estudada por Taddei et al. (1991), que se propagou a uma velocidade média
de 20 km/mês pelas principais bacias hidrográficas paulistas, como as dos
rios Tietê, Ribeira, do Peixe, entre outras. Os mesmos pesquisadores
também sugerem que áreas montanhosas, com presença de floresta, alto
índice pluviométrico e com presença de criação bovina de subsistência,
possuem maior probabilidade de ocorrência da doença, pois estas
características ecológicas são apropriadas para o D. rotundus.
Taddei et al. (1991), no Estado de São Paulo, sugerem que o inverno
seco determina o deslocamento do D. rotundus para locais mais úmidos,
como ao longo de bacias hidrográficas, desencadeando surtos de raiva.
93
Lord (1988) sugere que as características ecológicas, topográficas e
geológicas de uma área determinam a distribuição dos abrigos de D.
rotundus e, conseqüentemente a epidemia de raiva nas diferentes regiões.
Gomes, Uieda e Latorre (2005) relacionam a existência de D. rotundus
com a sua fonte de alimento, o gado, fazendo com que as epidemias em
bovinos se propaguem difusamente e não ao longo de bacias hidrográficas,
como sugerido por Taddei et al. (1991).
Aspectos relacionados à raiva, ao D. rotundus, aos ecossistemas
pecuários e, também, aspectos relacionados ao clima, relevo e tipo de
manejo dos animais, devem ser considerados na análise da raiva bovina
(Gomes, 2008).
Delpietro, Marchevsky e Simonetti (1992), na Argentina, sugerem que
D. rotundus tem preferência por ecossistemas pecuários aos naturais. Desta
forma, o animal demonstra preferência ao alimento do que ao seu próprio
ambiente natural.
O Estado de São Paulo possui diferentes regiões em relação à criação
de bovinos. A região do Vale do Paraíba possui gado de corte, mas é
predominantemente leiteira; o Vale do Ribeira apresenta pecuária de
subsistência; nas regiões noroeste e norte, apesar de apresentarem gado de
corte e leite, o de corte é predominante; e o oeste paulista continua sendo a
principal área de produção de carne do Estado (Gomes, 2008). Esta
regionalização é importante de ser analisada, pois, em teoria, quanto maior
for a relação comercial homem-animal, como no oeste paulista, maiores
serão os cuidados profiláticos. Um dos motivos da presença da raiva em
bovinos em certas áreas é a deficiências de cuidados de controle e profilaxia
da raiva (Brass, 1994).
Taddei et al. (1991) consideram que as diferenças entre o leste e o
oeste da pecuária paulista favorecem o aumento da raiva na região leste,
que possui criação de gado de subsistência e de caráter familiar, além de
áreas montanhosas com trechos de floresta natural e índice pluviométrico
mais elevados que a região oeste.
Havendo aumento da população de morcegos há o aumento
concomitante de raiva entre eles e, assim, há aumento da probabilidade de
transmissão da doença aos bovinos. Devido ao constante deslocamento do
D. rotundus, as epidemias de raiva se caracterizam pelo seu deslocamento e
sazonalidade (Brass, 1994).
94
1.5.9.A epidemia de raiva 1997-2002 no Estado de São Paulo
Estima-se que milhares de casos de raiva ocorram anualmente em
bovinos e eqüinos no Brasil, apesar de não haver concordância quanto a
estes números. Em 2007, SIRVERA (2008) cita 1255 casos diagnosticados
laboratorialmente, enquanto que SVS/MS (2008) cita 905 casos.
O RABV transmitido por D. rotundus faz dos grandes rebanhos de
bovinos suas vítimas preferenciais. Os milhões de bovinos no Brasil,
calculados, aproximadamante, em 200 milhões (IBGE, 2008), passivamente
fazem parte do ciclo silvestre da raiva como hospedeiros terminais. Apesar
dos bovinos serem hospedeiros terminais, um caso de raiva humana
transmitida por bovino é documentado (Ferreira, 2007). Ainda, mesmo que
até o momento não haja documentação da transmissão do RABV entre
bovinos ou outros herbívoros de criação, esta possibilidade existe,
principalmente pelo contacto oral (saliva contaminada) entre mucosas, como
descrito em Kudus (Tragelaphus strepsiceros) na África (Mansfield et al.,
2006). Recentemente foi descrito o mesmo tipo de transmissão entre
cangambás (skunks) (www.rabiescontrol.net) (2009).
Se, o gado é a fonte de alimento preferencial para D. rotundus (Del
Pietro e Russo, 1996; Romijn et al., 2003) e permitem o aumento
populacional destes morcegos (Uieda , 1996), pode-se afirmar que, de forma
indireta, auxiliam a manutenção do RABV no ciclo silvestre. Os herbívoros
de criação, principalmente bovinos, desencadeando o aumento da
população de D. rotundus, permitem que o RABV circule no ciclo silvestre de
forma facilitada, possibilitando o início de epidemias.
É possível sugerir que os bovinos atuam como indicadores ecológicos
da raiva no meio silvestre, isto porque o número de D. rotundus identificados
com raiva é pequeno em relação ao número dos casos da doença
identificados entre herbívoros de criação. Em 2007, o Ministério da Saúde do
Brasil (SVS/MS) identificou 905 casos de raiva em bovinos, 104 em eqüinos
e somente 27 em D. rotundus.
No Brasil, Kotait et al. (2007) citam 36 espécies de morcegos nãohematófagos diagnosticados com raiva, principalmente insetívoros. No
período 2005-2007 o Laboratório do Instituto Pasteur do Estado de São
Paulo, Brasil, analisou 10472 morcegos e entre estes foram identificados
10123 não-hematófagos e 349 hematófagos. O RABV foi identificado em
173 morcegos não-hematófagos, enquanto que somente dois D. rotundus
foram identificados positivamente . A importância da raiva entre os
*
Dados cedidos pela Seção de Diagnóstico do Instituto Pasteur, São Paulo, Brasil.
95
herbívoros de criação transmitida pelos morcegos não-hematófagos ainda
hoje é desconhecida.
O Estado de São Paulo (SP) localiza-se na Região Sudeste do Brasil,
possui 248898 Km2, cerca de 2,91% do território brasileiro e possui mais de
40 milhões de habitantes. É o Estado do Brasil mais industrializado e é
responsável por aproximadamente 30% do seu PIB. Sua capital é São Paulo
e junto com as cidades periféricas formam uma metrópole, a Grande São
Paulo, com cerca de 18 milhões de habitantes (IBGE, 2008). O Estado
possui uma região endêmica de raiva bovina na sua região Leste, no Vale do
Paraíba (Taddei et al., 1991). Esta região endêmica em SP se estende pelos
Estados brasileiros de Minas Gerais (MG) e Rio de Janeiro (RJ), vizinhos de
SP.
Entre os anos de 1997 e 2002 houve uma epidemia de raiva no
Estado de São Paulo envolvendo bovinos e eqüinos (Tabela 9). Naquela
ocasião, o Estado era oficialmente dividido pela Secretaria de Saúde em 25
Diretorias Regionais (DIR). A epidemia foi inicialmente detectada na DIR-3
(Mogi das Cruzes), vizinha à região endêmica de São Paulo, posteriormente
notificada na DIR-12 (Campinas) e em seguida na DIR-20 (São João da Boa
Vista).
Devido à nova reestruturação da Secretaria de Saúde do Estado de
São Paulo (decreto DOE nº51433 de 28 de dezembro de 2006), as antigas
Diretorias Regionais de Saúde (DIR) foram substituídas pelos
Departamentos de Saúde. Assim sendo, as antigas DIR-3 (Mogi das
Cruzes), DIR-12 (Campinas) e DIR-20 (São João da Boa Vista) tem, hoje,
suas áreas de abrangência equivalentes aos Departamentos de Saúde I
(Grande São Paulo), VII (Campinas) e XIV (São João da Boa Vista),
respectivamente (Figura 22).
Deste ponto em diante as DIR 3, 12 e 20, citadas anteriormente,
serão designadas por RD1, RD2 e RD3, respectivamente, e a epidemia
estudada por “epidemia 1997-2002” (Figura 23).
96
Figura 22: Departamentos de Saúde do Estado de São Paulo. Fonte:
www.saude.sp.gov.br/content/geral_estrutura_regionais_de_saude.mmp.
Tabela 9: Ocorrência de raiva em herbívoros, confirmação pela rede
de laboratórios de diagnóstico do Estado de São Paulo. Fonte: Peres, 2009.
Espécie/Ano 1997
1998
1999
2000
2001
2002
2003
2004
2005
2006
2007
Total
Bovina
149
188
431
624
413
148
89
50
55
56
40
2.243
Bubalina
0
1
3
0
0
1
1
1
0
0
1
8
Eqüina
23
35
103
260
130
86
42
27
11
12
11
740
Muar
0
0
1
6
3
2
5
2
0
0
0
19
Asinina
1
0
1
1
0
3
1
0
0
0
0
7
Ovina
2
1
1
8
5
1
0
0
0
0
0
18
Caprina
1
0
2
0
1
0
1
1
0
0
0
6
Total
176
225
542
899
552
241
139
81
66
68
51
3041
97
N
Região 1
Região 2
Região 3
Região endêmica
MT
MS
TO
MG
RJ
São Paulo - Capital
470 Km
Figura 23: Mapa do Estado de São Paulo (SP), Sudeste, Brasil, e as
áreas epidêmicas RD1, RD2 e RD3. A localização da capital do Estado,
cidade de São Paulo, e a região endêmica estão indicadas no mapa. A
localização do Estado de São Paulo é mostrada em cinza no mapa do Brasil
no canto direito da Figura. Os Estados brasileiros Mato Grosso (MT) e Mato
Grosso do Sul (MS), da região Centro-Oeste, Estado de Tocantins (TO), na
região Norte, além de Minas Gerais (MG) e Rio de Janeiro (RJ), os quais
como São Paulo, situam-se na região Sudeste, são também mostrados na
Figura. Abaixo, o mapa do Brasil mostrando o relevo do país e ao lado, o
mapa do Estado de São Paulo e seu relevo em maiores detalhes. Fonte:
Miranda (2009).
Em 2002, os órgãos oficiais ligados à pecuária instituíram vacinação
obrigatória na área epidemica e endêmica, além de realizarem o controle
populacional de D. rotundus à base de Warfarina, já iniciado anteriormente,
fazendo cessar a epidemia (Tabelas 10 e 11). Detalhes deste controle,
além de abrangentes dados epidemiológicos relativos à raiva em
herbívoros no Estado de São Paulo no período de 1997-2007, são
98
encontrados em Peres (2009). É importante esclarecer que em todo o
Estado de São Paulo, como em todo o Brasil, casos de raiva em bovinos e
outros herbívoros de criação, foram diagnosticados antes e após os anos
da epidemia 1997-2002. Também é apresentada a Figura 24, gerada a
partir de dados da Comissão Estadual de Controle da Raiva, que mostram
o número total de bovinos e eqüinos positivos para a raiva no Estado de
São Paulo, no período de 1996 a 2003 e o número total de herbívoros
positivos para a raiva no Estado de São Paulo, no período de 1996 a 2003,
além dos números de animais positivos nas áreas RD1, RD2 e RD3.
Tabela 10: Número de morcegos Desmodus rotundus capturados e
tratados com Warfarina e refúgios trabalhados no Estado de São Paulo,
1997–2007. Fonte: Peres, 2009
Ano
Hematófagos capturados e
tratados com Warfarina
Refúgios trabalhados
1997
sem informação
sem informação
1998
sem informação
sem informação
1999
3.951
1.421
2000
5.217
892
2001
6.367
1.803
2002
16.071
2.438
2003
11.687
sem informação
2004
9.371
sem informação
2005
6.417
sem informação
2006
12.919
sem informação
2007
10.117
6.554
TOTAL
82.117
A epidemia 1997-2002 ocorreu em uma área montanhosa,
densamente povoada e com um índice econômico privilegiado dentro do
Brasil. As três áreas estudadas, áreas RD1, RD2 e RD3, possuem altitudes
médias entre 800 e 1600 metros, temperaturas médias anuais de 18°C,
pluviosidade média anual superior a 1300 mm e, portanto, com condições
ecológicas propícias para D. rotundus (Wilkinson, 1988). Atualmente, a
vegetação original do Estado encontra-se alterada, pois foi o maior produtor
de café durante os séculos XIX e XX. Poucas áreas da Mata Atlântica,
situada nas regiões serranas de difícil acesso, a leste do Estado,
encontram-se parcialmente conservadas, mas sujeitas a grande
especulação imobiliária. Partes das áreas epidemicas estudadas situam-se
nestas regiões serranas (Figuras 25, 26 e 27).
99
Tabela 11: Número de herbívoros existentes e herbívoros vacinados,
na área de vacinação obrigatória da raiva, no Estado de São Paulo, 2001–
2006. Fonte: Peres, 2009.
Ano
Herbívoros existentes
Herbívoros vacinados
2001
2.921.893
2.740.887
2002
3.214.133
3.090.793
2003
3.461.303
3.413.369
2004
3.625.938
3.568.119
2005
2.870.286
2.830.852
2006
2.944.762
2.915.819
1996
1997
1998
1999
2000
2002
2003
Bovino
78
149
189
434
623
148
90
Eqüino
12
24
35
106
238
92
48
Estado de São
Paulo
RD 1
RD 2
RD 3
1996
6
5
1
90
1997
82
5
6
173
1998
34
49
7
224
1999
31
349
56
540
2000
44
469
227
861
2001
19
259
277
625
2002
-
-
-
240
2003
-
-
-
138
Figura 24: Gráficos e tabelas com os números de bovinos e eqüinos
positivos para a raiva no Estado de São Paulo (imagem superior), como
também nas áreas RD1, RD2 e RD3 (imagem inferior) Fonte:
(www.pasteur.saude.sp.gov.br/coordenacao/coordenacao).
100
Atualmente, grande número de pesquisadores da raiva sugere que,
além da presença de montanhas, os rios e represas também são fatores que
determinam a diversificação genética do RABV (Carnieli et al., 2009). A
Figura 28 mostra a posição dos principais rios e represas das áreas RD1,
RD2 e RD3.
Outro trabalho recente, com metodologia inédita e dados
abrangentes, que estudou a raiva em bovinos no Estado de São Paulo, no
período entre 1992 e 2003, é o de Gomes (2008). O autor, utilizando uma
abordagem ecológica, estudou os padrões espaciais da raiva bovina e seus
determinantes, partindo da premissa que a paisagem físico-territorial e o
ambiente pecuário do Estado, que se transformam ao longo do tempo,
influenciam a expansão da raiva. O autor sugere que a análise dos tipos de
uso e classes de cobertura da terra permite a identificação de fatores
relacionados à epidemia e de sua progressão pelo território, no espaço e no
tempo. A epidemia ou as epidemias de raiva em herbívoros, segundo o
autor, progrediram principalmente pelos Vales do Paraíba e Ribeira, do
sentido da divisa de Minas Gerais até o eixo entre os municípios de São
Paulo e Campinas e depressão periférica (ver Figura 25).
As Figuras 29 e 30, cedidas gentilmente por Gomes, permitem uma
melhor caracterização e visualização da epidemia 1997-2002. Porém, para
que possamos interpretar corretamente estas figuras, se faz necessário
analisar os dados presentes na Tabela 12, que mostra os números de casos
de raiva no Estado de São Paulo em relação aos mapas Kernel da Figuras
29 e 30, no período 1997-2003. A Figura 31 mostra a função Kernel da
cobertura vegetal das áreas RD1, RD2 e RD3 no ano de 1997.
101
0m
2700 m
Divisão Geomorfológica
Planalto Atlântico e
Província Costeira
Depressão Periférica
Cuestas Basálticas
Planalto Ocidental
Figura 25: Aspectos do relevo do Estado de São Paulo (imagem
superior) e divisão geomorfológica paulista (imagem inferior). Imagens
geradas a partir de dados provenientes do SRTM (“Shuttle Radar
Topography Mission”). Fonte: Gomes, 2008.
102
1100 mm
11°C
3850 mm
25°C
Figura 26: Pluviosidade média anual do Estado de São Paulo
(imagem superior) e temperatura média anual do Estado de São Paulo
(imagem inferior). Imagens geradas a partir de dados provenientes do SRTM
(“Shuttle Radar Topography Mission”). Fonte: Gomes, 2008.
103










