
Visualização do documento
Reacoes Organicas.doc
(1408 KB) Baixar
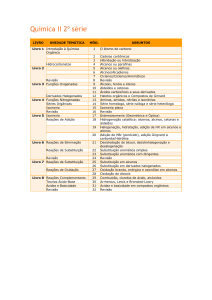
15
QUÍMICA
QUÍMICA
Professor: Alex Martins
Reações Orgânicas
1- Conceito:
São fenômenos químicos, que ocorrem em geral, em varias etapas, sendo o estudo dessas etapas
chamado de mecanismo de reação, onde os reagentes transforma-se em intermediários de reação e estes,
formarão os produtos.
2- Conceito de Ácido e Base Lewis:
Ácido de Lewis
É toda espécie química (molécula ou íon) capaz de receber par de elétrons.
Base de Lewis
É toda espécie química (molécula ou íon) capaz de doar par de elétrons.
Ex:
3- Tipos da Cisão, Clivagem, Ruptura ou Quebra de Ligações
A) Cisão Homolítica ou Homólise
É o tipo de cisão de ligação onde cada fragmento fica com um e do par eletrônico, originando
radicais livres que são espécies desprovidas de carga elétrica (eletricamente neutros).
-
Condições para ocorrer Homólise:
Presença de luz (), calor (, 300ºC) ou peróxido (R – O – O – R)
C + C
Ex: C — C
B) Cisão Heterolítica ou Heterólise
É o tipo de cisão de ligação onde apenas um dos fragmentos (+ eletronegativo) fica de posse do par
eletrônico, originando íons.
Condições para ocorrer Heterólise:
Presença de um catalisador, em geral, um ácido Lewis.
Ex: H — C
H + C
+
H c — C
H C + C
3
+
3
-
Catalisador: é toda espécie química, que adicionada a uma reação tem por função diminuir a energia
de ativação dessa reação, aumentando com isso a velocidade da reação. Nas reações orgânicas o
catalisador em geral é um "ÁCIDO DE LEWIS".
Ácido de Lewis: são espécies químicas que possuem deficiência de e .
Ex.: BF , AlC , FeC , FeBr .
–
3
3
3
3
Bases de Lewis: são espécies químicas que possuem um ou mais e não compartilhados (e livres),
podendo doá-los em uma reação:
-
–
Ex:
.. ..
..
H O , NH , R — OH , R — NH , ..
..
2
..
2
..
2
4- Tipos de Reagentes ou Atacantes
A) Reagente Eletrófilo (E.)
Íon positivo (cátion) ou molécula que possui afinidade por e , isto é, é um ÁCIDO DE LEWIS.
Ex: H , C , H C , AlC ...
-
+
+
+
3
3
B) Reagente Nucleófilo (Nu)
Íon negativo (ânion) ou molécula que possui afinidade por centros ou regiões +, isto é, é um "BASE
DE LEWIS".
Ex:
..
C , H C , OH , H O , ...
..
C) Radical Livre
Espécie química eletricamente neutra, com o octeto incompleto e 1 e desemparelhado, possuindo
devido a isso, um leve caráter eletrófilo.
Ex: H , Br , H C ...
–
3
–
–
2
–
3
5- Intermediários de Reações
São espécies químicas formados entre o início e o final de uma reação orgânica.
TIPOS DE INTERMEDIÁRIOS:
Radicais Livres ()
Íon Carbônio ou Carbocátion (+)
Íon Carbânion
A) Radical Livre
Espécie química eletricamente neutra que possui e desemparelhado e provém de uma homólise.
Ex:
–
ORDEM DECRESCENTE DE ESTABILIDADE DOS RADICAIS LIVRES:
EXERCÍCIO
1- Colocar as espécies abaixo em ordem crescente de estabilidade.
B) Carbocátion
É toda espécie química que possui o carbono com carga positiva, sendo formado a partir da perda
de e (heterólise).
Ex:
–
ORDEM DECRESCENTE DE ESTABILIDADE DOS CARBOCÁTIONS:
Exercício
2- Colocar as espécies abaixo em ordem decrescente de estabilidade.
C) Carbânion
É toda espécie química que possui o carbono com carga negativa, sendo formado a partir do ganho
de e (heterólise).
Ex:
–
6- Classificação das Reações Orgânicas
6.1- Reações de Adição
É o tipo de reação em que duas substâncias reagem originando um único produto, onde a hibridação
do carbono do produto é mais estável que no carbono do reagente reagente.
Ordem de estabilidade
sp > sp > sp
3
2
A) Reação de Adição Eletrófila ou Eletrofílica
É o tipo de reação de adição que caracteriza-se pelo ataque do reagente eletrófilo ao substrato
orgânico, sendo este mecanismo característico das substâncias orgânicas que possuem dupla ou tripla
ligação entre carbonos.
Regra de MARKOVNIKOV (atualizada):
Nas reações de adição o reagente eletrófilo entra de preferência no carbono mais hidrogenado da
insaturação, pois originará o carbocátion mais estável.
REAÇÕES DOS ALCENOS
1º) Adição de Hx a alcenos (Hx = HC, HBr e HI)
Os alcenos adicionam ácidos halogenidricos, originando haletos de alquila.
Ex:
CH – CH = CH + HBr
3
2
2ª) Adição de H O (Hidratação)
Os alcenos adicionam água em meio ácido (H SO ) originando álcoois.
2
2
Obs.: segue a regra de Markovnikov
Ex:
H C = CH + H O
2
2
2
3ª) Adição de X (X = C , Br )
2
2
2
2
4
Os alcenos adicionam halogênios em solução de CC , produzindo dialogenetos vicinais.
4
Ex:
H C = CH + Br
2
2
2
CH - CH = CH + C
3
2
2
B) Reação de Adição Nucleófila ou Nucleofílica
É o tipo de reação de adição que se caracteriza pelo ataque do reagente nudeófilo ao substrato
orgânico, sendo este mecanismo característico das substâncias que possuem dupla ligação entre o
carbono e outro elemento.
...
Arquivo da conta:
lendel-hat
Outros arquivos desta pasta:
Exercicios de Revisao 7 Q.O.doc (200 KB)
Exercícios de Revisao 1 Q.O.doc (155 KB)
Exercícios de Revisao 2 Q.O.doc (297 KB)
Exercícios de Revisao 3 Q.O.doc (208 KB)
Exercícios de Revisao 4 Q.O.doc (168 KB)
Outros arquivos desta conta:
acidez e basicidade
camada de ozonio
eletrolise
equilibrio
isomeria
Relatar se os regulamentos foram violados
Página inicial
Contacta-nos
Ajuda
Opções
Termos e condições
Política de privacidade
Reportar abuso
Copyright © 2012 Minhateca.com.br






![Alimentação seleciona tipo de flora intestinal [em humanos].](http://s1.studylibpt.com/store/data/005364369_1-848e597800655660c691a1b0cee4b7cd-300x300.png)




