Como tudo começou?
BERZELIUS
"Somente os seres vivos podem
transformar substâncias
minerais em orgânicas."
(Teoria da Força Vital)
Jöns Jacob Berzelius (1779-1848)
A Teoria da Força Vital
Significou estagnação no desenvolvimento
de novos materiais que hoje chamamos de
compostos orgânicos
WHÖLLER
Realizou a síntese da uréia
(composto orgânico) a
partir do cianato de amônio
(composto inorgânico) em
laboratório.
(Derrubou a Teoria da Força
Vital)
Friedrich Wöhler (1800-1882)
NH2
NH4CNO
calor
C = O
NH2
Cianato de amônio
uréia
(inorgânico ou “mineral”)
(orgânico)
Conseqüências da Síntese de Wöhller
Milhões de compostos podem ser
sintetizados em laboratório, pois há
mudança de paradigma.
Surge
a Síntese Orgânica
Graças aos avanços da Síntese Orgânica,
hoje, obtêm-se compostos de alta
complexidade.
Qual o limite?
Fórmula estrutural da palitoxina.
Entendendo alguns mecanismos de RQO
Chama-se mecanismo de uma RQO a
descrição das várias etapas pelas quais
ela passa, como . . .
1. A ruptura das ligações.
X
X
X
X
2. Os ataques eletrofílicos e nucleofílicos
ao reagente orgânico
3. A formação de novas ligações e de
compostos intermediários, etc.
Ruptura das ligações
Homolítica- a ruptura é de modo igual.
Ocorrem em moléculas apolares ou com
baixa diferença de eletronegatividade
entre os átomos.
Br · · Br
Ruptura
Br ·
+
Radical livre
· Br
Heterolítica- a ruptura é feita de modo
desigual, ficando o par eletrônico com
apenas um dos átomos da ligação.
Moléculas polarizadas. Forma íons.
H
I
H–C··H
I
H
Ruptura
H
I
H–CΘ
I
H
Carbânion
+
H+
Cátion
X · Radical livre: produto da quebra
homolítica.
X+ Agente eletrófilo : produto da quebra
heterolítica.
X- Agente Nucleófilo: produto da quebra
heterolítica.
X+ Agente eletrófilo
São “deficientes de elétrons”;
São ácidos de Lewis.
Ex: H+ , Br+, CH3+, BF3, AlCl3, carbo-cátions,
etc.
Dica: sinal positivo ou nenhum par de elétrons
sobrando.
X- Agente nucleófilo
São “fornecedores de elétrons”;
São bases de Lewis.
Ex: OH-, CN-,Cl-, carbo-ânions, etc.
Dica: sinal negativo ou par de elétrons
sobrando.
Ácido: toda espécie química capaz de
doar prótons (H+)
Base: capaz de receber prótons (H+) em
uma reação
Ácido de Lewis: toda espécie química
capaz de receber par de elétrons.
Base de Lewis: toda espécie química
capaz ceder par de elétrons
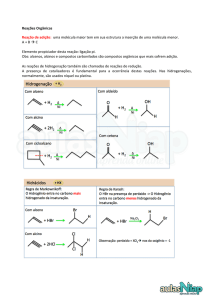
Adição;
Substituição;
Eliminação;
- Oxidação-redução.
É quando duas ou mais moléculas
reagentes formam uma única como
produto.
H
H
C
C
H
+
H
H
H
H
C
H
C
H
H
Observação: são 2 moléculas de H2
ocorrem nos alcenos, nos alcinos, em
aldeídos e nas cetonas.
Hidrogenação: entra H
Halogenação: entra halogênio (7 A)
Adição de haletos de hidrogênio ou
halogenidretos: entra H e halogênio
(ácidos).
Hidratação: entra H e OH (água).
H2 e presença de catalisadores
metálicos (Ni, Pt e Pd).
H
H
C
H
C
+
H
Alceno forma alcano
Pt
H
H
H H
H C C H
H H
(1)Parcial: alcino forma alceno
(2)Total: alcino forma alcano
H
C
C
H
+
H
C
H
H
C
1
H
H
2
H
C
C
H
+
H
H
H
H
C
H
Observação: são 2 moléculas de H2
C
H
H
presença do CCl4, formando di-haletos
de alquil
alcenos
Parcial- alcinos
Total- alcinos
presença de catalisadores ácidos (H+),
originando álcoois
H
H
H
C
C
CH 3
+
H
OH
H
H
H
C
C
H
OH
CH 3
3
REGRA DE MARKOVNIKOV, que diz:
“O hidrogênio
carbono
da
hidrogenado”.
(H+) é
dupla
adicionado ao
ligação
mais
Produz: haletos de alquil
Alcenos e alcinos com três ou mais
átomos de carbono: produzirá 2
compostos, sendo um deles em maior
proporção (produto principal).
REGRA DE MARKOVNIKOV
Hidrogenação de óleos: fabricação da
margarina
As moléculas : função éster.
Especificamente são tri-ésteres de ácidos
graxos
de
cadeia
longa
e
glicerol
(triglicerídeos).
As insaturações possibilitam
que
o
hidrogênio
seja
adicionado
às
ligações
duplas C=C, convertendo-as
em ligações simples
Hidrogenação de um óleo, produz
uma gordura sólida.
A hidrogenação total é
evitada, porque o triacilglicerol
completamente saturado é
muito duro e quebradiço.
As
gorduras
hidrogenadas
rançam muito menos do que as
não-hidrogenadas.
O rancescimento deve-se à presença
de ácidos e aldeídos voláteis, de mau
odor, resultante (pelo menos em parte)
do ataque do oxigênio às posições
duplas, reativas da molécula.
A hidrogenação, diminuindo o número de insaturações, retarda o
desenvolvimento de ranço.
Reação Nucleofílica: ocorre quando o
substrato adiciona na primeira etapa um
reagente nucleófilo
Reação eletrofílica: ocorre quando o
substrato adiciona na primeira etapa
um reagente eletrófilo.
No equilíbrio abaixo, podemos afirmar que de acordo com o
conceito de ácido e base de Brönsted-Lowry:
a) NH4 + atua como base.
b) NH3 atua como base.
c) HCl atua como base.
d) Cl – atua como ácido.
e) NH3 atua como ácido.
Na equação abaixo, o íon bicarbonato (HCO3–)
é classificado como:
a) base de Arrhenius.
b) base de Brönsted.
c) base de Lewis.
d) ácido de Brönsted.
e) ácido de Lewis
Indique, dentre os reagentes abaixo, o
nucleofílico:
a) BF3.
b) H3O +.
c) AlCl3.
d) Cl2.
e) H2O.
Indique, dentre os reagentes abaixo, o
eletrofílico:
a) NH3.
b) HCN.
c) H3O+.
d) ROH.
e) H2O.
O produto principal da reação:
a) álcool primário.
b) álcool secundário.
c) aldeído.
d) ácido carboxílico.
e) cetona.
Próxima aula:
Reação de Substituição