Escola Superior de Agricultura Luiz de Queiroz
ESALQ-USP
Funções Orgânicas
Trabalho realizado como exigência da
disciplina Bioquímica, ministrada
pelo Prof. Dr. Luis Antonio Gallo.
Uli Birgit Flechtmann Suadicani-8019224
Luana Bresciani-8564394
Piracicaba, 2013
Introdução
“A Química orgânica é a parte da Química que estuda praticamente todos os
compostos do elemento carbono.”, definição aceita atualmente, proposta por Friedrich August
Kekulé (1829-1896) em 1858.
Elementos organógenos são os quatro elementos que formam praticamente todos os
compostos da Química Orgânica: C, H, O e N. Outros elementos que também formam
compostos orgânicos, porém em menor número, são o enxofre, fósforo e os halogênios, como
o cloro, bromo, iodo e, eventualmente, o flúor.
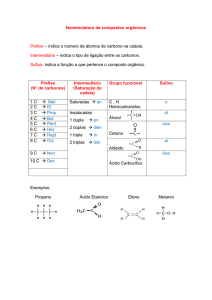
Funções Orgânicas
Hidrocarbonetos
São os compostos orgânicos mais importantes, possuindo apenas os elementos
carbono e hidrogênio (CxHy).
Os hidrocarbonetos são divididos em dois grupos: aromáticos, que apresentam pelo
menos um anel ou núcleo aromático; e alifáticos, todos os demais. Possuem as seguintes
características principais:
São substâncias apolares, cujas moléculas se mantêm unidas por forças de van der
Waals (forças de dipolo induzido).
Possuem baixos pontos de fusão e ebulição em relação aos compostos polares.
Comparando hidrocarbonetos de cadeia normal, de uma mesma classe, observa-se
que os pontos de fusão e ebulição aumentam com o aumento de massa molar do
composto. Se forem comparados hidrocarbonetos de cadeia normal com de cadeia
ramificada, notar-se-á que os compostos de cadeia normal têm pontos de fusão e
ebulição mais elevados que os de cadeia ramificada.
Em condições de temperatura e pressão ambientes, pode-se fazer a seguinte
generalização: hidrocarbonetos que possuem de 1 a 4 carbonos são gasosos, de 5 a
17 são líquidos e acima de 17 carbonos são sólidos.
Todos os hidrocarbonetos apresentam densidade menor que a da água (1 g/mL).
Os hidrocarbonetos dissolvem-se em substâncias apolares ou de baixa polaridade,
portanto, são insolúveis em água.
Possuem reatividade baixa nos compostos saturados de cadeia acíclica, nos
compostos cíclicos com seis ou mais carbonos e nos aromáticos. Compostos
insaturados de cadeia acíclica apresentam reatividade média, e os compostos cíclicos
que possuem de três a cinco carbonos, reatividade alta.
Aplicações práticas: são ótimos combustíveis e formam toda a matéria prima da
indústria petroquímica, que produz desde plásticos, fibras têxteis e borrachas sintéticas
até tintas, detergentes e fertilizantes agrícolas.
Alcanos
Fórmula geral: CnH2n+2
São hidrocarbonetos de cadeia aberta que possuem apenas ligações simples entre
carbonos.
São encontrados na natureza em emanações naturais gasosas (do metano e butano) e
como constituintes do petróleo.
Alcenos
Fórmula geral: CnH2n+.
São hidrocarbonetos de cadeia aberta em que ocorre uma ligação dupla entre carbonos.
São chamados de olefinas devido ao aspecto oleoso dos alcenos de mais de cinco
carbonos. O alceno mais simples e mais importante é o eteno ou etileno, gás incolor e de sabor
adocicado, encontrado principalmente em poços petrolíferos. É usado como combustível, no
amadurecimento artificial de frutos, como narcótico e na fabricação de plásticos como o
polietileno.
Alcadienos
Fórmula Geral: CnH2n-2
São hidrocarbonetos de cadeia aberta que apresentam duas ligações duplas entre
carbonos.
Alguns alcadienos podem ser utilizados como matéria prima na fabricação de borracha,
como o isopreno ou borracha comum (1,3-dieno) e o neopreno ou borracha sintética (cloro-but1,3-dieno).
Alcinos
Fórmula geral: CnH2n-2
São hidrocarbonetos de cadeia aberta que possuem uma ligação tripla entre carbonos.
O alcino mais importante é o etino, conhecido também por acetileno. Esse composto
possui muitas aplicações, dentre elas o uso como gás de maçarico oxiacetilênico para cortar
chapas de aço, e também como matéria prima na fabricação de borracha sintética.
Ciclanos
Fórmula geral: CnH2n
São hidrocarbonetos de cadeia fechada que apresentam apenas ligações simples entre
carbonos.
A maior fonte de ciclanos são os petróleos caucásicos e americanos. O ciclopentano é um
gás que possui propriedades anestésicas; o ciclo-hexano é usado como combustível e na
produção de ácido adípico, COOH(CH2)4COOH, que é matéria prima para a fabricação de
nylon.
Ciclenos
Fórmula geral: CnH2n-2
São hidrocarbonetos de cadeia fechada que apresentam uma ligação dupla entre
carbonos.
Hidrocarbonetos aromáticos
São aqueles que possuem pelo menos um anel aromático, isto é, um ciclo plano com 6
átomos de carbono que estabelecem entre si ligações ressonantes. Devido à ressonância das
ligações π, os aromáticos são compostos bastante estáveis e só reagem em condições
energéticas.
O benzeno é o mais importante dos aromáticos; líquido entre incolor e amarelado; tóxico e
inflamável. Aromáticos derivados do benzeno também possuem aplicações importantes. Um
deles, o metilbenzeno, conhecido comercialmente como tolueno, é utilizado na fabricação do
explosivo TNT.
Haletos orgânicos
São todos os compostos derivados de hidrocarbonetos, procedentes da substituição de um
ou mais hidrogênios da molécula por átomos de halogênios: flúor, cloro, bromo ou iodo.
Grupo funcional: R—X
Em que: R: radical de carbonos; X: Fl, Cl, Br ou I
Nomenclatura oficial: quantidade de X + nome do X + nome do hidrocarboneto
Nomenclatura usual: nome do haleto + de + nome do substituinte com terminação ila
Propriedades:
Os mono-haletos orgânicos são levemente polares e suas moléculas mantêmse unidas por forças de atração do tipo dipolo permanente ou forças dipolo-
dipolo. Os poli-haletos orgânicos podem ser levemente polares ou apolares,
dependendo da geometria molecular. Quando são apolares, suas moléculas
mantêm-se unidas por forças fracas de van der Waals (forças de dipolo
induzido).
Os pontos de fusão e ebulição dos haletos orgânicos são próximos aos dos
alcanos (comparando composto de massas molares semelhantes) e vão se
tornando cada vez mais altos à medida que os seguintes fatores começam a
influenciar: aumento da massa molar devido ao aumento do numero de
carbonos na cadeia carbônica; aumento do numero de halogênios substituídos;
aumento da massa atômica de halogênios substituídos.
A maioria dos mono-haletos orgânicos são líquidos em condições ambientes.
Com poucas exceções, os que possuem até três átomos de carbono na
molécula são gases ou líquidos voláteis. Os poli-haletos geralmente são
líquidos e os de massa molar elevada apresentam-se sólidos.
Os haletos orgânicos são insolúveis em água. São solúveis em solventes
orgânicos de baixa polaridade, como o benzeno, o éter, o clorofórmio.
Em geral possuem cheiro forte característico e muitos deles apresentam sabor
doce.
A reatividade desses compostos não é muito acentuada.
São largamente utilizados na síntese de diversas substâncias, dentre elas os
compostos de Grignard, intermediários na obtenção de álcoois, aldeídos e
ácidos. Também são utilizados como solvente para ceras, vernizes e
borrachas, como é o caso do tetracloreto de carbono, CCl4 (l), e do clorofórmio,
CHCl3 (l).
Álcool
É todo composto orgânico que apresenta um grupo hidroxila, —OH, ligado a um
carbono saturado.
Grupo funcional:
Nomenclatura oficial: prefixo + infixo + ol
Nomenclatura usual: álcool + nome do substituinte + ico
Propriedades:
Devido à presença do grupo —OH, as moléculas realizam pontes de hidrogênio
entre si.
Como as pontes de hidrogênio são forças de atração muito intensas, a quantidade
de energia necessária para separar moléculas que estabelecem esse tipo de força
é muito grande. Por isso, as substâncias que fazem ligações de hidrogênio têm
pontos de ebulição e de fusão elevados.
Em condições de pressão e temperatura ambientes, os monoalcoois com até 12
carbonos na molécula são líquidos; os demais são sólidos. Polialcoois com até
cinco carbonos são líquidos cuja viscosidade aumenta com o aumento do numero
de hidroxilas; polialcoois com seis ou mais carbonos na cadeia tendem a ser
sólidos.
Álcoois com poucos átomos de carbono na cadeia são bastante solúveis em água.
O metanol é o mais toxico dos álcoois, podendo levar à cegueira e até mesmo à
morte quando ingerido, inalado ou em contato com a pele em grande quantidade. É
usado como combustível, solvente e na síntese de compostos orgânicos. O etanol
é utilizado na limpeza domestica, como combustível, ou destinado às industrias
químicas e farmacêuticas, além de ser usado na fabricação de bebidas.
Fenóis
Fenol é todo composto que possui um grupo OH, hidroxila, ligado a um carbono de um
anel aromático.
Grupo funcional:
Nomenclatura oficial: localização do grupo — OH + hidróxi + nome do aromático
Propriedades:
Todos os monofenóis possuem moléculas polares com o vetor resultante no
sentido do átomo de oxigênio. Alguns difenóis com dois grupos — OH nas
posições 1,4 são considerados moléculas apolares. São estabelecidas ligações
de hidrogênio entre moléculas de fenóis.
Os fenóis possuem pontos de ebulição e fusão bem mais elevados que os de
hidrocarbonetos de massa molecular semelhantes, devido às pontes de
hidrogênio.
Os monofenóis mais simples são líquidos ou sólidos de baixo ponto de fusão.
Os demais fenóis são sólidos.
Fenóis são mais densos que a água.
Possuem cheiro forte característico, são tóxicos e altamente irritantes.
São compostos facilmente oxidáveis e possuem um fraco caráter ácido,
decorrente da ressonância do anel aromático.
O fenol comum (hidroxibenzeno) é utilizado na produção de desinfetantes e
medicamentos. O 2,4,6-trinitrofenol (ácido pícrico) entra na fabricação de
pomadas para queimaduras e detonadores de explosivos.
Enóis
Enol é todo composto que apresenta um grupo — OH ligado a um carbono que faz
dupla ligação. São compostos instáveis que não existem de forma isolada.
Grupo funcional:
Nomenclatura oficial: prefixo + en + ol
Os enóis possuem um fraco caráter ácido dedo à presença de ligações 𝜋, que
estabiliza o carbono do grupo — OH quando ocorre a perda do próton H+.
Devido à alta eletronegatividade do átomo de oxigênio, há uma tendência dos enóis em
sofrerem um rearranjo molecular, transformando-se em um aldeído ou em uma cetona.
Éteres
Éter é todo composto que possui o oxigênio entre dois átomos de carbono. São
compostos de cadeia heterogênea.
Grupo funcional:
Nomenclatura oficial: nome da cadeia mais simples (prefixo + oxi) + nome da cadeia
mais complexa (prefixo + infixo + o)
Nomenclatura usual: éter + nome do substituinte mais simples + nome do substituinte
mais complexo + ico
Propriedades:
As moléculas dos éteres são levemente polares devido à geometria angular.
São compostos pouco reativos.
A maioria dos éteres possui cheiro agradável, toxidez moderada e é altamente
inflamável.
Em geral são compostos menos densos que a água.
Os éteres mais simples são gases; os demais são líquidos normalmente
voláteis.
São muito utilizados como solventes inertes em reações orgânicas e na
extração de essências, óleos e gorduras de suas fontes naturais.
Aldeídos
Aldeído é todo composto orgânico que possui o grupo carbonila ligado a um hidrogênio.
Grupo funcional:
Nomenclatura oficial: prefixo + infixo + al
Propriedades:
As moléculas são polares, mas não fazem ligações de hidrogênio entre si.
São compostos bastante reativos, sendo os aldeídos alifáticos mais reativos que os
aldeídos aromáticos.
Dos aldeídos, os que mais apresentam diversidade de uso são o metanal e o etanal. O
primeiro é um gás incolor, de cheiro característico e irritante, usado como desinfetante
e na conservação de peças anatômicas. Já o etanal é usado na síntese de diversos
compostos orgânicos, na obtenção de resinas, inseticidas e também como redutor de
íons prata na fabricação de espelhos comuns.
Cetonas
Cetona é todo composto que possui o grupo carbonila entre dois carbonos.
Grupo funcional:
Nomenclatura oficial: prefixo + infixo + ona
Nomenclatura usual: nome do substituinte mais simples + nome do substituinte mais
complexo + cetona
Propriedades:
As moléculas de cetona não fazem pontes de hidrogênio entre si, porém são mais
polares que as moléculas de aldeídos.
Possuem cheiro agradável e são parte constituinte de óleos essenciais
encontrados em flores e frutas.
São compostos bastante reativos.
A mais importante é a propanona, conhecida como acetona. Trata-se de um liquido
incolor, de cheiro agradável (quando puro), inflamável, usado, principalmente,
como solvente de esmaltes, tintas, vernizes e na extração de óleos de sementes
vegetais.
Ácidos carboxílicos
Ácido carboxílico é todo composto orgânico que possui o grupo carbonila ligado a um
grupo hidroxila
Grupo funcional:
Nomenclatura oficial: ácido + prefixo + infixo + óico
Propriedades:
São compostos muito polares e podem fazer o dobro de ligações de hidrogênio
que as moléculas de álcoois.
São compostos bastante reativos, principalmente os mais simples.
Os ácidos metanoico e etanoico são os que possuem maior diversidade de
uso. O ácido metanoico é um liquido incolor, de cheiro forte, muito tóxico,
usado no tingimento de tecidos, como desinfetante em medicina e na síntese
de outros compostos. O ácido etanoico é um liquido incolor, muito toxico, de
cheiro penetrante e sabor azedo. É usado na preparação de perfumes,
corantes, seda artificial e vinagre.
Ésteres
Éster é todo composto formado pela substituição da hidroxila do grupo carbonila de um
ácido orgânico por um grupo — O — C/\ — proveniente de um álcool.
Grupo funcional:
Nomenclatura oficial: prefixo/infixo/oato + de + nome do substituinte com terminação ila
Nomenclatura usual: nome usual do ácido com terminação trocada de ico para ato + de
+ nome do substituinte com terminação ila
Propriedades:
As moléculas dos ésteres apresentam uma relativa polaridade acentuada em
ésteres de cadeia carbônica pequena.
Possuem aroma agradável de flores e frutas.
São pouco reativos, mas, conforme as condições, sofrem hidrolise com certa
facilidade.
São usados como essências de frutas e aromatizantes na indústria alimentícia,
farmacêutica e cosmética e em perfumaria.
Sais de ácidos carboxílicos
Sal de ácido carboxílico é todo composto obtido pela reação entre um ácido carboxílico
e uma base inorgânica. O hidrogênio ionizável do ácido reage com o ânion hidróxido formando
água, e o ânion orgânico une-se ao cátion da base para formar o sal.
Grupo funcional:
Nomenclatura oficial: prefixo + infixo + oato + de + nome do cátion
Nomenclatura usual: nome usual do ácido com terminação trocada de ico para ato + de
+ nome do cátion
Propriedades:
Possuem uma extremidade altamente polar, formada pela atração eletrostática
entre cátions e ânions, e outra praticamente apolar, referente à cadeia
carbônica (ligação carbono e hidrogênio).
Possui pontos de fusão e ebulição muito elevados.
São sólidos cristalinos e não voláteis.
São inodoros; apresentam sabor característico ligeiramente adstringente.
Reagem da mesma maneira que os sais inorgânicos.
Os sais mais usados industrialmente são os derivados do ácido etanoico. Os
sais de metais alcalinos obtidos a partir de ácidos carboxílicos de cadeia longa
(ácidos graxos) são denominados sabões.
Anidridos de ácido
São todos os compostos derivados da condensação de duas moléculas de ácido
carboxílico, iguais ou diferentes, com perda simultânea de uma molécula de água.
Grupo funcional:
Nomenclatura oficial: anidrido + nome do(s) ácido(s): prefixo + infixo + oico
Propriedades:
São compostos polares, mas não fazem pontes de hidrogênio entre si.
São mais reativos do que os ácidos carboxílicos dos quais se originaram, por
isso são empregados em sínteses orgânicas.
O composto mais importante é o anidrido acético, o qual é utilizado na
produção de acetato de celulose, matéria prima para a fabricação de vários
produtos, como fibras têxteis e filmes fotográficos.
Cloretos de ácido
Cloreto de ácido ou cloreto de acila é todo composto derivado de ácido carboxílico, no
qual o grupo — OH foi substituído por um átomo de cloro.
Grupo funcional:
Nomenclatura oficial: cloreto + de + prefixo + infixo + oíla
Propriedades:
São altamente polares, embora suas moléculas não façam ligações de
hidrogênio entre si.
Possuem cheiro forte e são tóxicos.
São compostos bastante reativos.
São usados na síntese de substâncias orgânicas, como ácidos carboxílicos,
éteres e ésteres.
Aminas
Amina é todo composto orgânico derivado da amônia, NH3, pela troca de um, dois ou
três hidrogênios por substituintes orgânicos (cadeias carbônicas).
Grupo funcional:
Nomenclatura oficial: nome do(s) substituinte(s) com terminação il + amina
Propriedades:
As aminas possuem caráter básico.
São compostos polares.
A reatividade das aminas aumenta com o aumento do caráter básico desses
compostos.
São utilizadas na síntese de diversos compostos orgânicos; entram como
ingredientes na fabricação de certos tipos de sabões e na vulcanização da
borracha; as aminas aromáticas são compostos importantes na fabricação de
corantes e explosivos.
Amidas
Amida é todo composto que possui o nitrogênio ligado diretamente a um grupo
carbonila.
Grupo funcional:
Nomenclatura oficial: prefixo + infixo + amida ou N + nome do substituinte ou N,N +
nomes dos substituintes + prefixo + infixo + amida
Propriedades:
São compostos bastante polares - duas moléculas podem fazer mais de uma
ponte se hidrogênio entre si.
Possuem pontos de fusão e ebulição muito elevados.
São compostos bastante reativos.
Possuem um caráter básico muito fraco.
São importantes na síntese se outros compostos orgânicos e como
intermediarias na preparação de medicamentos. A ureia (diamida do ácido
carbônico) se destaca pela função biológica e pelos seus usos diversificados:
umectante e hidratante em cremes e pomadas cosméticas, produção de
fertilizantes agrícolas e medicamentos.
Nitrocompostos
São derivados orgânicos do ácido nítrico, NHO 3. Os nitrocompostos apresentam o
grupo nitro, —NO2, ligado a uma cadeia carbônica.
Grupo funcional:
Nomenclatura oficial: nitro + prefixo + infixo + o
Propriedades:
São substâncias bastante polares, suas moléculas sofrem forças de dipolo
permanente.
São compostos bastante reativos.
Dos derivados aromáticos, o nitrobenzeno é o mais importante. Trata-se de
um liquido amarelado, tóxico e insolúvel em água, usado como solvente de
compostos orgânicos. Muitos nitrocompostos aromáticos são utilizados como
explosivos.
Referências Bibliográficas
Fonseca, Martha Reis Marques da; Química: química orgânica/ Martha Reis. — São
Paulo: FDT, 2007. — (Coleção química).