- 2009 -
PROGRAMA DE REVISÃO INTENSIVA PARALELA
“RUMO AO VESTIBULAR”
Disciplina
Química
Tema
Professor
Reações
orgânicas
Regina
Natureza
Rumo ao Vestibular
Dia / Mês / Ano
Código Sequencial
AULA 24
NOMENCLATURAS ORGÂNICAS
INTRODUÇÃO
A química orgânica é o ramo da química que estuda os compostos que possuem em sua estrutura o
elemento carbono. São poucos os compostos que apresentam carbono em sua composição e que
pertençam a química inorgânica. Os mais importantes e conhecidos são:
Ácido carbônico (H2CO3) e seus derivados (carbonatos)
Ácido cianídrico (HCN) e seus derivados (cianetos)
Gás carbônico (CO2)
Gás monóxido de carbono (CO)
O elemento hidrogênio (H) normalmente aparece junto ao elemento carbono (C). Mas
outros elementos também podem se ligar ao carbono e, nesse caso, não se trata mais de um
hidrocarboneto. Vale lembrar e memorizar o número de ligações que cada um deles pode
fazer:
Elemento
Carbono
Hidrogênio
Oxigênio
Enxofre
Nitrogênio
Halogênios (flúor, cloro, bromo,
iodo)
Símbolo químico
Número de ligações
C
H
O
S
N
F , Cl , Br , I
QUATRO (4)
UMA (1)
DUAS (2)
DUAS (2)
TRÊS (3)
UMA (1)
CLASSIFICAÇÃO DAS CADEIAS CARBÔNICAS
As cadeias carbônicas são classificadas em:
a)
b)
c)
d)
Normal ou ramificada
Aberta (alifática) ou cíclica (alicíclica)
Saturada (apenas simples ligação) ou insaturada (presença de dupla ou tripla)
Homogênea (apenas C e H) ou heterogêneas (presença de um heteroátomo entre dois
carbonos)
e) Aromáticas
Mononucleadas (um benzeno)e polinucleadas (mais de um benzeno)
Polinucleada isolada ou condensada
CLASSIFICAÇÃO DE CARBONOS
a)
b)
c)
d)
A classificação se dá de acordo com o número de carbonos ligados ao carbono em estudo.
São classificados em:
Primários ( 0 ou 1)
Secundários (2)
Terciários (3)
Quaternários (4)
RAMIFICAÇÕES ESPECIAIS
2 CARBONOS etil (-C2H5) e vinil (-C2H3)
3 CARBONOS propil e isopropil
4 CARBONOS
butil, sec-butil, isobutil e terc-butil
2
AROMÁTICOS fenil (-C6H5) e benzil (-C7H7)
HIDROCARBONETOS
Hidrocarbonetos são compostos formados apenas pelos elementos carbono (C) e hidrogênio (H).
São classificados em :
Hidrocarboneto
Característica
Nomenclatura
Fórmula geral
CnH2n+2
a) Alcanos
Simples ligações
___ANO
b) Alcenos
Dupla ligação
___ - no -ENO
CnH2n
c) Alcino
Tripla ligação
___ - no - INO
CnH2n-2
d) Alcadienos
DUAS duplas ligações ___A – nos- DIENO
e) Cicloalcanos
ciclanos
f)
Benzenos
ou Cadeia fechada
Núcleo benzênico
CnH2n-2
CICLO___ANO
CnH2n
_____BENZENO
C6H6
1. Cadeia principal
a) É a maior possível para alcanos.
b) Para cadeias insaturadas, é a maior cadeia desde que a insaturação faça parte dela.
2. Numeração
a) Para alcanos, as ramificações devem possuir a menor numeração possível
b) Para hidrocarbonetos insaturados, a insaturação recebe o menor número possível.
3. Nome do composto
a) As ramificações devem ser dispostas em ordem alfabética junto com a sua posição
numérica na cadeia principal.
b) A finalização do nome se dá com a cadeia principal, seguindo a nomenclatura dada na
tabela acima.
Nos aromáticos que possuem 2 ramificações, iguais ou diferentes, existem posições com nomes
especiais:
Orto = posição 1-2
Meta = posição 1-3
Para = posição 1-4
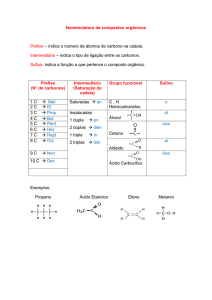
COMPOSTOS OXIGENADOS E NITROGENADOS
Compostos oxigenados são aqueles que apresentam o elemento O em sua composição.
São classificados em:
Fenol – Benzeno + hidroxila (OH)
Álcool – Presença do grupo hidroxila (OH) na cadeia carbônica → ___-n°-OL
Cetona – Presença do grupo carbonila (=O) em carbonos secundários → ___-n°-ONA
Aldeídos – Presença do grupo carbonila (=O) em carbonos primários → ____AL
Ácidos – Presença do grupo carboxila (COOH) → Ác ___ÓICO
Ésteres – Presença do grupo -COO- → ___anoato de ___ILA
Éteres – Presença do oxigênio entre 2 carbonos da cadeia → menor ÓXI-maior ANO
Amina – Presença do nitrogênio na cadeia → ___AMINA
3
Amida – Presença do grupo –CON- → “N,N”-____AMIDA
As nomenclaturas de compostos oxigenados e nitrogenados seguem as mesmas regras dos
hidrocarbonetos começando a numeração pelo oxigênio ou nitrogênio.
POLARIDADE, SOLUBILIDADE, CARÁTER ÁCIDO E BÁSICO, SÉRIES ORGÂNICAS
Propriedades físicas dos compostos orgânicos
Os fatores principais que determinam as propriedades físicas e químicas dos compostos
orgânicos são:
- Polaridade das moléculas (polar ou apolar)
- Massa molar (M)
- Cadeia carbônica (normal ou ramificada)
1. Polaridade da moléculas
Moléculas apolares se unem por forças de atração fracas conhecidas por vários nomes:
- Força de van der Waals
- Força de London
- Força dipolo induzido-dipolo instantâneo
- Dipolo induzido-dipolo induzido
Possuem baixo ponto de fusão e ebulição e são insolúveis em água.
Moléculas polares se unem por dois tipos de força de atração distintas:
- Dipolo-dipolo ou dipolo permanente-dipolo permanente ou
- Ponte de hidrogênio (H – FON)
Possuem pontos de fusão e ebulição mais elevados e são solúveis em água.
Dentre essas forças, a mais forte é a Ponte de Hidrogênio, seguida pelo dipolo-dipolo e a
força mais fraca é a de Van der Waals.
Maior a força
intermolecular
(força de
atração)
Maior a
energia
necessária
para a
mudança
de estado
Maior a
temperatura
de ebulição
A polaridade de um composto orgãnico depende da sua geometria e de suas ligações. É difícil
determinar a geometria de uma molécula orgânica devido à presença de cadeias carbônicas. De um
modo geral dizemos que:
- Hidrocarbonetos são apolares
- Presença de OH (ácidos, fenóis e álcoois) e NH (aminas) são muito polares devido às Pontes
de Hidrogênio formadas.
- Em geral os demais compostos são polares, guardadas as devidas particularidades.
2. Massa molar
Para moléculas
de mesma força
intermolecular
Maior massa
Maior
temperatura
de ebulição
3. Cadeia carbônica
Para moléculas de mesma força
intermolecular e mesma massa molar.
4
Resumindo
1)Para moléculas com tamanhos aproximadamente iguais, a TF e TE dependerá da interação
(força) intermolecular.
2)Para moléculas com o mesmo tipo de interação, a TF e TE dependerá da massa molar.
3)Para moléculas de mesma interação e massa molar iguais (isômeros), a TF e TE dependerá
do tipo da cadeia carbônica.
Solubilidade de compostos orgânicos
Regra geral
“Semelhante dissolve semelhante”.
Água (H2O) e amônia (NH3) são polares.
Hidrocarbonetos, óleos e graxas são apolares.
Álcoois de até 3 carbonos possuem solubilidade infinita em água, pois são polares e
interagem por pontes de hidrogênio.
Caráter ácido
Segundo o conceito de Arrhenius, ácido é todo composto capaz de liberar o íon H + em
meio aquoso.
Existem duas funções orgânicas que possuem essa característica (por apresentarem o
grupo hidroxila (OH)):
a) os ácidos carboxílicos
b) os fenóis
Apesar dos álcoois apresentarem o grupo OH eles podem ser considerados neutros.
Caráter básico
O único composto de caráter básico que nos interessa são as que pertencem ao grupo das
aminas.
Séries orgânicas
Série isóloga – Número de C iguais e insaturações diferentes.
5
Ex: Etano (C2H6), eteno (C2H4), etino (C2H2)
Série homóloga – Número de C diferentes (-CH2) e mesma função.
Ex: Metanol, etanol, propan-1-ol
Série heteróloga - Número de C iguais e funções diferentes.
Ex: Etano, etanal, etanol
6