EM34F
Termodinâmica A
Prof. Dr. André Damiani Rocha
[email protected]
Aula 04 – Propriedades
2
Aula 04
Avaliando Propriedades
Fase e Substância Pura
Fase: refere-se a uma quantidade de matéria que é
homogênea como um todo, tanto em composição
química como em estrutura física.
Homogeneidade: em estrutura física significa que a
matéria é toda sólida, toda líquida ou toda vapor.
Um sistema pode conter uma ou mais fases!
3
Aula 04
Avaliando Propriedades
Fase e Substância Pura
Substância Pura: É uma substância cuja composição
química é uniforme e invariável. Pode existir em mais de
uma fase, mas sua composição química deve ser a
mesma em cada fase.
Exemplo: água líquida e vapor d’água
4
Aula 04
Avaliando Propriedades
Estado Termodinâmico
O estado de um sistema fechado em equilíbrio é sua
condição como descrita por valores de suas
propriedades termodinâmicas;
O estado é estabelecido por valores das propriedades
independentes
5
Aula 04
Avaliando Propriedades
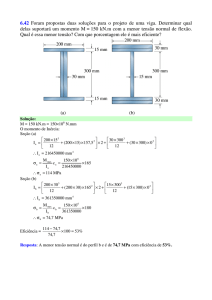
Relação p-v-T
Propriedades
de
substâncias
puras
simples
compressíveis e a relação entre essas propriedades
com a pressão, o volume específico e a temperatura.
Evidência experimental: temperatura e volume
específico podem ser considerados independentes.
Assim,
𝑝 = 𝑝 𝑇, 𝑣
6
Aula 04
Superfície p-v-T
Superfície p-v-T (Água)
Expansão durante a solidificação;
7
Aula 04
Superfície p-v-T
Superfície p-v-T
De uma substância que se contrai
durante a solidificação;
A maioria das substâncias exibe
esse comportamento;
8
Aula 04
Superfície p-v-T
Regiões
Regiões Monofásicas: o estado é determinado por
quaisquer duas das seguintes propriedades: pressão,
volume específico e temperatura;
Regiões Bifásicas: duas fases coexistem em equilíbrio:
líquido-vapor, sólido-líquido e sólido-vapor. Nessas
regiões, pressão e temperatura não são independentes;
9
Aula 04
Superfície p-v-T
Regiões
O estado no qual uma mudança de fase começa ou
termina é denominado estado de saturação;
A região em formato de sino composta pelos estados
bifásicos líquido-vapor é chamada de domo de vapor;
As linhas que definem o contorno do domo de vapor são
denominados linhas de líquido saturado e de vapor
saturado.
10
Aula 04
Superfície p-v-T
Regiões
O topo do domo, onde as linhas de líquido e de vapor
saturados se encontra é denominado ponto crítico;
A temperatura crítica, TC, de uma substância pura
corresponde à temperatura máxima na qual as fases
líquida e de vapor podem coexistir em equilíbrio.
A pressão no ponto crítico é denominada pressão crítica,
pC.
11
Aula 04
Projeções da Superfície p-v-T
Diagrama p-v
Projetar a superfície p-v-T sobre o plano pressão-volume
específico resultado no diagrama p-v.
12
Aula 04
Projeções da Superfície p-v-T
Diagrama T-v
Projetar as regiões de líquido, bifásica líquido-vapor e de
vapor da superfície p-v-T sobre o plano temperaturavolume específico obtém-se um diagrama T-v.
13
Aula 04
Avaliando Propriedades
Mudança de Fase
Considere como sistema a água contida no conjunto
êmbolo-pistão:
14
Aula 04
Avaliando Propriedades
Mudança de Fase
T,oC
Isobaric process
P = 1 atm
300
2
100
20
Saturated
mixture
5
3
4
1
v
15
Aula 04
Avaliando Propriedades
Mudança de Fase
Tsat – Temperatura na qual ocorre mudança de fase para
uma dada pressão;
Psat – Pressão na qual ocorre a mudança de fase para
uma dada temperatura;
Exemplo:
p = 1atm = 101.3 kPa,
p = 500 kPa,
T = 100 C
T = 151.9 C
16
Aula 04
Avaliando Propriedades
Mistura bifásica líquido-vapor
As misturas bifásicas líquido-vapor podem ser distinguidas
entre si pelo título.
O título (quality) é uma propriedade intensiva;
Para uma mistura bifásica líquido-vapor, o título é a razão
entre a massa de vapor presente e a massa total da
mistura,
𝑚𝑣𝑎𝑝𝑜𝑟
𝑥=
𝑚𝑙í𝑞𝑢𝑖𝑑𝑜 + 𝑚𝑣𝑎𝑝𝑜𝑟
17
Aula 04
Avaliando Propriedades
Mistura bifásica líquido-vapor
O título (x) representa a fração de massa de vapor;
Seu valor varia entre 0 e 1 (0 x 1);
𝑚𝑣𝑎𝑝𝑜𝑟
𝑥=
𝑚𝑙í𝑞𝑢𝑖𝑑𝑜 + 𝑚𝑣𝑎𝑝𝑜𝑟
x = 0 → Líquido Saturado
x = 1 → Vapor Saturado
18
Aula 04
Avaliando Propriedades
Mistura bifásica líquido-vapor
Como na região de saturação, todo o líquido está na
situação de líquido saturado e todo vapor está na
situação de vapor saturado,
∀𝑙𝑖𝑞 = 𝑚𝑙𝑖𝑞 𝑣𝑙𝑖𝑞
∀𝑣𝑎𝑝 = 𝑚𝑣𝑎𝑝 𝑣𝑣𝑎𝑝
∀ ∀𝑙𝑖𝑞 ∀𝑣𝑎𝑝
𝑣= =
+
𝑚
𝑚
𝑚
𝑣𝑙𝑖𝑞 𝑚𝑙𝑖𝑞 𝑣𝑣𝑎𝑝 𝑚𝑣𝑎𝑝
𝑣=
+
𝑚
𝑚
𝑣 = 1 − 𝑥 𝑣𝑙𝑖𝑞 + 𝑥𝑣𝑣𝑎𝑝
19
Aula 04
Avaliando Propriedades
Tabelas de Líquido e de Vapor
As propriedades do vapor d’água estão listadas nas
tabelas/apêndices dos livros de termodinâmica;
Saber utilizar as tabelas é essencial para o curso;
Em muitas situações, será necessário
interpolação para obter os dados,
aplicar
TL T
vL v
TH TL vH vL
a
20
Aula 04
Avaliando Propriedades
Exemplo 01: Utilizando as tabelas de água, determine os
estados:
a) P=1,0 MPa; T=207 ºC
b) P=1,0 MPa; T=107,5 ºC
c) P=1,0 MPa; T=179,91 ºC; x=0,0
d) P=1,0 MPa; T=179,91 ºC; x=0,45
e) T=340 ºC; P=21,0 MPa
f) T=340 ºC; P=2,1 MPa
g) T=340 ºC; P=14,586 MPa; x=1,0
h) T=500 ºC; P=25 MPa
i) P=50 MPa; T=25 ºC
21
Aula 04
Avaliando Propriedades
Exemplo 02: Considerando a água como fluido de trabalho,
complete a tabela.
P (MPa)
T(oC)
v (m3/kg)
300
0,15
0,50
1,0
0,65
300
x (se aplicável)
22
Aula 04
Avaliando Propriedades
Exemplo 02: Solução
P (MPa)
T(oC)
v (m3/kg)
x (se aplicável)
8.5810
300
0.02167
1,0
0,15
111,37
0,65
0.56
0,50
300
0.52256
Não se Aplica
23
Aula 04
Avaliando Propriedades
Exemplo 03: Inicialmente uma amostra de água se encontra
a 120°C e apresente título igual a 25%. A temperatura da
amostra é aumentada para 140°C num processo onde o
volume é constante. Determine a pressão e o título no
estado final desse processo.
Resolução no Quadro
24
Aula 04
Avaliando Propriedades
Exemplo 04: Um tanque rígido contém 50kg de água líquida
saturada a 90°C. Determine a pressão e o volume do
tanque.
A partir da tabela de água saturada, P = 70,14kPa
O volume específico do líquido saturado a 90oC é,
v vl 0,001036m3 / kg
Então, o volume total do tanque resulta,
V mv (50)(0,001036) 0,0518m3
25
Referências
MORAN, Michael J.; SHAPIRO, Howard N. Princípios de
termodinâmica para engenharia. 4. ed. Rio de Janeiro:
LTC, 2002. 681 p.