TERMODINÂMICA APLICADA
2 – Efeitos Térmicos
2.1 - Calores Latentes de Substâncias Puras
2.2 - Calor de Reação Padrão
2.3 - Calor Padrão de Formação
2.4 - Calor Padrão de Combustão
2.5 - O processo reversível
2.6 - A variação da entalpia com a Temperatura
2.1 - Calores Latentes de Substâncias Puras
• O que é uma substância pura?
• Uma substância pura é aquela que tem
composição química invariável e homogênea.
• Pode existir em mais de uma fase, por
exemplo líquida e gasosa, sendo que cada fase
tem a mesma composição química
OBJETIVOS
Estudar:
• o comportamento PVT das substâncias puras
• o equilíbrio de fases Vapor-Líquido-Sólido
Usar:
• as Tabelas Termodinâmicas
Entender:
• as Superfícies Termodinâmicas
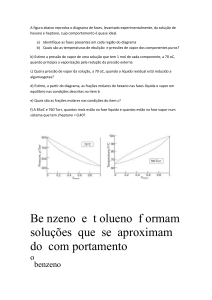
• A figura a seguir mostra o processo de
vaporização dá água que inicialmente está em
estado de líquido comprimido (a).
• Quando aquecida chega ao ponto de líquido
saturado onde começa o aparecimento do
vapor.
• A figura (b) apresenta a mistura líquido-vapor
saturado e
• Após toda a transformação de fase temos o
vapor superaquecido (c).
(a) Líquido comprimido
(b) Mistura Líquido-Vapor Saturado (L-V)
(c) Vapor superaquecido
Curva de pressão de vapor x Temperatura
Qual a temperatura de ebulição da água?
Resposta:
A temperatura para a água ferver depende da pressão em que se encontra,
À P = 1 atm a Tempertura de ebulição normal = 100 ͦC
Esse ponto em que o líquido entra em processo de vaporização é chamado
de ponto de saturação e temos a pressão e temperatura de saturação.
Ponto crítico é onde os pontos de líquido saturado e vapor
saturado se encontram
Diagrama completo com as fases sólido, líquido e vapor
Diagrama tridimensional P-V-T
• Tabela de Propriedades Termodinâmicas
• Devido à dificuldade de se expressar as
relações termodinâmicas por meio de
equações simples, as propriedades quase
sempre são apresentadas em forma de
tabelas.
• No Apêndice dos livros de TD encontra-se as
tabelas com informações de pressão,
temperatura, entalpia específica, entropia
específica, energia interna específica e volume
específico.
Entalpia (H)
Em estudos na análise de turbinas a vapor
e na representação de propriedades do vapor
um termo aparecia com grande importância:
• a soma da energia interna com o produto
pressão-volume que foi chamado de ENTALPIA
H = U + pϑ [kJ]
(ENTALPIA TOTAL)
H = u + pv [kJ/kg] (ENTALPIA ESPECÍFICA)
Título (x)
• Necessário calcular quando estamos lidando com a região de
mudança de fase, no ELV (equilíbrio Líquido-Vapor)
• O título (x) é a quantidade de vapor presente na mistura
bifásica.
• Se pegarmos uma propriedade como o
volume específico, no ELV:
E a massa total:
mtotal = m líq + m vapor
TABELAS TERMODINÂMICAS
• http://sistemas.eel.usp.br/docentes/arquivos/
8554681/00000000/Tabelasdepropriedadeste
rmodinamicas(agua).pdf