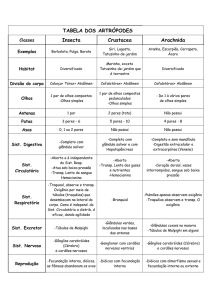
Termodinâmica
Todo processo (transformação) pode ser classificado como
espontâneo (em geral processos naturais) ou não
espontâneo (processos realizados à custa de consumo de
energia).
A termodinâmica estuda a espontaneidade dos processos
físicos e químicos.
Sistema – o que está sob análise
Vizinhanças – o restante do universo
1a Lei: Toda transformação, natural ou não, ocorre com
conservação de energia.
Calor e trabalho – vamos nos restringir àqueles processos
que só envolvem transferência de calor e/ou realização de
trabalho.
Sistema recebe calor (q) ou trabalho (w) → energia (E)
aumenta
Sistema perde calor ou realiza trabalho → energia diminui
E q w
Convenção para os sinais algébricos de calor e trabalho
Quantidade
Sinal algébrico
Significado
q
+
O sistema recebe calor
das vizinhanças
O sistema transfere calor
para as vizinhanças
w
+
O sistema realiza trabalho
para as vizinhanças
O sistema recebe trabalho
das vizinhanças
A variação de energia de um sistema é a diferença entre o
calor que o sistema recebe ou transfere e o trabalho que o
sistema realiza ou é realizado sobre ele.
O trabalho de variação de volume
O trabalho de expansão
Expansão de um gás
estado inicial
V1
Pext < Pi
estado final
V2 > V 1
Pext = Pi
entre V1 e V2 o gás se expandiu de ΔV
w Pext V
De acordo com a dedução acima, o trabalho terá unidades
de pressão vezes volume, e será, em geral, somado ao
calor que tem unidades de energia.
1 atm.L = 101,3 J
Exemplo: Um sistema com volume 25,00 L, absorve 1,00
kJ de calor. Calcule ∆E do sistema se: a) o calor é
absorvido a volume constante, b) o sistema expande para o
volume de 28,95 L contra uma pressão constante de 1,00
atm, c) o sistema expande para um volume de 42,63 L,
contra uma pressão constante de 0,560 atm.
Energia e Entalpia
E q w
E E2 E1 q Pext V q PextV2 PextV1
para um processo a pressão constante Pext Psist P
E2 E1 q PV2 PV1
( E2 PV2 ) ( E1 PV1 ) q p
Definindo ( E PV ) H H q p
e ∆H = ∆E + ∆(PV), onde, aqui, P é a pressão do sistema.
Então, quando um sistema sofre expansão ou contração à
pressão constante, a quantidade de calor trocada é
chamada de variação de entalpia do sistema.
Exemplo: Água líquida no ponto de ebulição tem uma
densidade de 0,958 g/ml. Nessas condições Hvap = 40,66
kJ/mol. Calcule Evap (admita que o vapor d’água
comporta-se idealmente.
Transformações Espontâneas
Que condição ou condições devem se verificar para que
um processo ocorra espontaneamente?
A 1a Lei diz que em toda transformação há conservação de
energia, mas a variação de energia do sistema E 0,
assim como H. Então os valores de E ou H não servem
como critério para decidir se uma transformação é
espontânea ou não.
Exemplo:
HC + H2O HC(sol)
H < 0
KI + H2O KI (sol)
H > 0
O que caracteriza os processos que ocorrem naturalmente
com aumento de energia?
R: O sistema torna-se menos ordenado!
em todo processo natural há uma competição entre
diminuição de energia e organização do sistema.
2a Lei: um sistema isolado tem uma tendência natural a
tornar-se menos organizado.
Em outras palavras: todos os processos naturais são
acompanhados de um aumento líquido na desordem do
mundo.
Então, olhando para a direção na qual a desordem
aumenta, pode-se identificar se um determinado processo
tem tendência a ocorrer.
A desordem do mundo é medida por uma propriedade
chamada ENTROPIA.
A variação de entropia de um processo pode ser calculada
por:
S = q/T
Onde q é o calor trocado entre o sistema e as vizinhanças
e T é a temperatura em que esse calor foi trocado.
Em qualquer transformação espontânea num sistema
isolado S > 0.
Se um sistema não está isolado (pode trocar energia com
as vizinhanças):
S = SSist + SViz > 0
SViz
qtrocado entre o sistema e as vizinhanças
TVizinhanças
O calor trocado com as vizinhanças é –q, onde q é o calor
trocado pelo sistema.
SViz
qsist
TViz
Como as vizinhanças é tudo – sistema TViz = T = cte. Se
Tsist for cte, Tsist = T
SViz
qsist
T
Se o processo for a pressão cte qsist = Hsist
SViz
H sist
T
Então:
S S sist
H sist
T
Multiplicando ambos os lados da equação por T
TS TS sist H sist
TS H sist TS sist
ou
- A energia livre de Gibbs
Definindo G = H – TS onde G chama-se energia livre de
Gibbs
GSist H Sist TS Sist
e pode-se concluir que GSist TSTotal
Como em qualquer transformação espontânea S > 0
-TS < 0 GSist < 0
GSist > 0 transformação não espontânea
GSist = 0, diz-se que o sistema está em equilíbrio
H
+
-
S
+
-
+
+
G = (H - TS)
+
T baixa, T alta, +
T baixa, +
T alta, -
transformação
espontânea
não-espont.
espontãnea
não-espont.
não-espont.
espontânea
Outra formas de expressar as 1a e 2a leis:
1a Lei: a energia do universo é constante
2a Lei: A entropia do universo aumenta
Mudanças de Fase
Considere uma substância mudando de fase. Como
durante a mudança de fase ambas as fases estão em
equilíbrio:
G H TS 0
S
H
T
por exemplo, na fusão:
S fus
H fus
T fus
- 3a Lei: A entropia de um sólido cristalino puro e perfeito à
0K=0
Para um aumento na temperatura,
S 0 T ST S 0 ST