Concurso de seleção 2004-2
Química – Página 1
QUÍMICA
QUESTÃO 51
Uma das conseqüências da poluição ambiental é a chuva ácida, que, em alguns casos, pode causar danos
irreparáveis à natureza. Substâncias básicas são capazes de neutralizar esses ácidos, atenuando os seus efeitos. O
volume de Ca(OH) 2 0,20 molar que será necessário para reagir com 100 mL de H2SO4 0,40 molar é de
(a)
(b)
(c)
(d)
(e)
200 mL
100 mL
90 mL
50 mL
150 mL
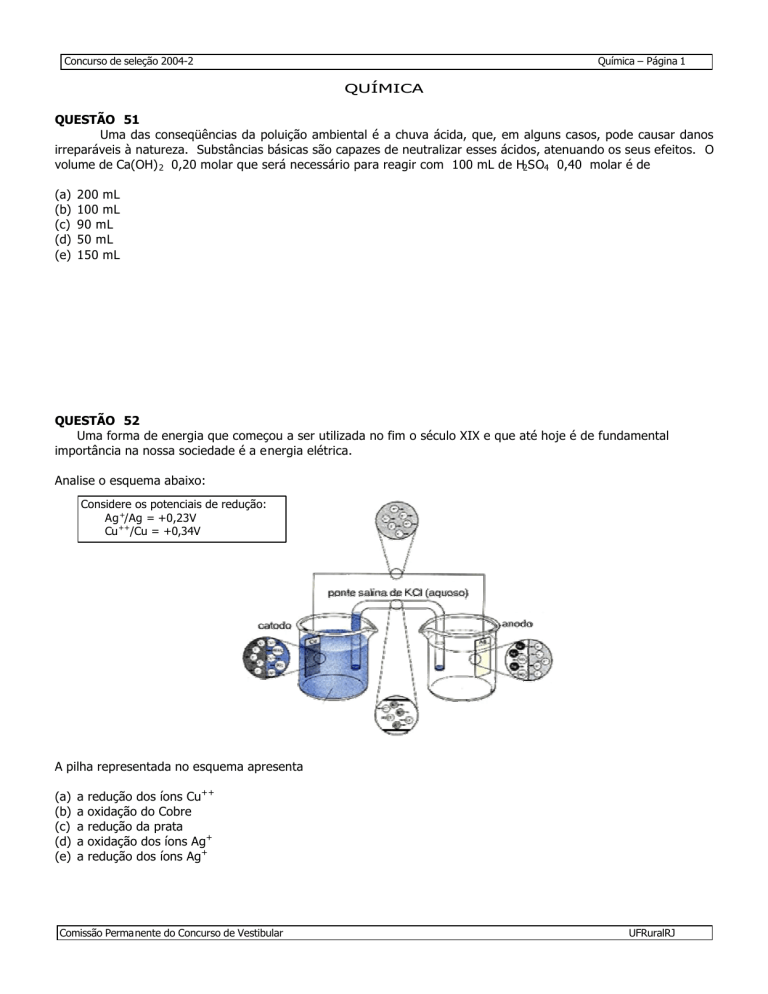
QUESTÃO 52
Uma forma de energia que começou a ser utilizada no fim o século XIX e que até hoje é de fundamental
importância na nossa sociedade é a energia elétrica.
Analise o esquema abaixo:
Considere os potenciais de redução:
Ag +/Ag = +0,23V
Cu ++/Cu = +0,34V
A pilha representada no esquema apresenta
(a)
(b)
(c)
(d)
(e)
a
a
a
a
a
redução dos íons Cu++
oxidação do Cobre
redução da prata
oxidação dos íons Ag+
redução dos íons Ag+
Comissão Permanente do Concurso de Vestibular
UFRuralRJ
Concurso de seleção 2004-2
Química – Página 2
QUESTÃO 53
Quando comparamos o pH do refrigerante (pH = 3) com o pH da cerveja (pH = 5), podemos afirmar que o
primeiro é maior que o segundo
(a)
(b)
(c)
(d)
(e)
2 vezes.
10 vezes.
50 vezes.
100 vezes.
200 vezes.
QUESTÃO 54
O corpo humano excreta moléculas de odor peculiar. Algumas são produzidas por glândulas localizadas nas
axilas. A substância em questão é o ácido 3- METIL-2-HEXENÓICO. A cadeia carbônica dessa substância é
classificada como:
(a)
(b)
(c)
(d)
(e)
acíclica, normal, saturada, homogênea.
acíclica, ramificada, insaturada, homogênea.
acíclica, ramificada, saturada, heterogênea.
alifática, normal, saturada, heterogênea.
alicíclica, ramificada, saturada, homogênea.
Comissão Permanente do Concurso de Vestibular
UFRuralRJ
Concurso de seleção 2004-2
Química – Página 3
QUESTÃO 55
Praticamente toda a energia que a terra recebe do sol é produzida num processo denominado fusão
nuclear, que é um processo em que núcleos pequenos reúnem-se para formar um núcleo maior.
A equação radioativa 4
1
1
temperaturas muito altas
H
→ x + 2
0
+1
representa o processo de fusão nuclear entre
núcleos de hidrogênio leve que ocorrem no sol. O produto X que torna essa reação verdadeira é
(a)
2
1
3
1
H
4
2
He
(b) H
(c)
4
4
(d) H
(e)
2
1
He
QUESTÃO 56
Um dos principais agentes tóxicos é o gás cianídrico, que é letal na dose de 100mg/m3 de ar. Os agentes tóxicos
agem sobre o sistema nervoso, paralisando-o, tanto que, ao se combinar com a hemoglobina, impedem o
transporte de oxigênio para as células.
A equação que representa a reação de formação do gás tóxico é:
(a) H 2 SO 4 + 2KCl → K 2 SO 4 + 2HCl
(b) 2HCl + K 2 SO 4 → 2KCl + H 2 SO 4
(c) H 2 SO 3 + 2NaCl → Na 2 SO 3 + 2HCl
(d) 2HCl + BaSO3 → BaCl2 + H2SO3
(e) H 2 SO 4 + 2KCN → K 2 SO 4 + 2HCN
Comissão Permanente do Concurso de Vestibular
UFRuralRJ
Concurso de seleção 2004-2
Química – Página 4
QUESTÃO 57
Temos representada abaixo a seqüência para as hibridizações dos átomos de carbono da molécula.
NCV CIV H2CIII HCII HCI ONH2
Os números superescritos em algarismos romanos indicam a ordem da cadeia
A seqüência correta para as hibridizações dos átomos de carbono da molécula acima é
(a)
(b)
(c)
(d)
(e)
CI
CI
CI
CI
CI
=
=
=
=
=
SP2
SP2
SP
SP
SP
CII
CII
CII
CII
CII
=
=
=
=
=
SP
SP2
SP2
SP2
SP
CIII
CIII
CIII
CIII
CIII
=
=
=
=
=
SP2
SP2
SP3
SP2
SP
CIV
CIV
CIV
CIV
CIV
=
=
=
=
=
SP3
SP3
SP3
SP
SP3
CV
CV
CV
CV
CV
=
=
=
=
=
SP
SP
SP
SP3
SP2
QUESTÃO 58
A fenil-alanina (A) e a histidina (B) são aminoácidos naturais encontrados em proteínas.
CH2CHCOOH
NH2
(A)
CH2CHCOOH
N
N
H
NH2
(B)
Em relação a estas moléculas, a seqüência de informações correta correspondentes ao total de ligações sigma,
ligações pi e carbonos assimétricos é, respectivamente:
(a)
(b)
(c)
(d)
(e)
45,
43,
42,
43,
44,
6,
7,
7,
7,
8,
3.
3.
2.
2.
3.
Comissão Permanente do Concurso de Vestibular
UFRuralRJ
Concurso de seleção 2004-2
Química – Página 5
QUESTÃO 59
Óxidos são compostos binários onde o oxigênio é o elemento mais eletronegativo. Dos óxidos abaixo,
aquele que é capaz de reagir com a água, formando uma base é
(a)
(b)
(c)
(d)
(e)
N2O3.
SO3.
CO.
Fe3O4.
K2O.
QUESTÃO 60
Uma das misturas utilizadas como combustível para a propulsão de foguetes consiste na reação entre
hidrazina (N2 H4) e peróxido de hidrogênio (H2O2), que atua como oxidante.
A reação que ocorre é a seguinte
N 2 H 4( l ) + 2H 2 O 2 (l ) → N 2( q ) + 4H2 O (q )
Os reagentes se misturam a 25ºC na relação molar indicada pela equação acima.
Dados os valores dos Calores de formação padrão (298K)
N 2 H 4 ( l) = +12 KCal/mol
H 2 O 2 ( l) = − 45 KCal / mol
H 2 O (g) = − 57 KCal / mol
O calor da reação na temperatura indicada é
(a) − 309 KCal / mol
(b) − 153 KCal / mol
(c) − 24,8 KCal / mol
(d) + 153KCal / mol
(e) − 150 KCal / mol
Comissão Permanente do Concurso de Vestibular
UFRuralRJ