PARACOCCIDIOIDOMICOSE
Micose profunda que se caracteriza por processo granulomatoso crônico, causada pelo
fungo dimórfico paracoccidioides brasiliensis.
Micose sistêmica endêmica.
É a infecção fúngica sistêmica de maior prevalência na América Latina, conhecida
também como blastomicose sul-americana.
Infecta, por via respiratória, mas apenas uma minoria (particularmente adultos do
sexo masculino ligados à atividade agrícola) desenvolve a doença, que é um processo
granulomatoso-piogênico, com evolução crônica.
Atinge pulmões, mucosa oral e das vias respiratórias, pele e gânglios linfáticos.
Quadro clínico
- Forma aguda-subaguda = crianças e jovens, tendência à disseminação pelos sistemas
linfático e retículo-endotelial e para outros tecidos.
- Forma crônica = adultos, acomete mais pulmões e mucosa das vias respiratórias. É a
mais comum.
• Paracoccidioides brasiliensis
– Fungo dimórfico, assexuado (criptoesporulação ou brotamento simples)
– Ágar - Sabouraud - crescimento lento
– Gelose chocolate - crescimento rápido (37°C)
– Cobaia, hamster e camundongo são sensíveis (a sensibilidade varia e amostras diferentes do
fungo podem ter diferentes graus de virulência).
- Produz enzimas (urease, protease e fosfolipase), mas sua atividade bioquímica é fraca nos
testes de identificação de leveduras. Libera exoantígenos (gp 43)
- Via inalatória blastoconídia
- Fator de risco : profissões ou atividades relacionadas ao manejo do solo contaminado
- Paciente exerceu atividade agrícola nas e primeiras décadas de vida, adquirindo a infecção,
mas a clínica manifesta-se anos depois
- 10 a 15 homens : 1 mulher. Na infância, distribuição uniforme
- Se não diagnosticada e tratada : forma grave e letal
- Pode ser assintomática (a infecção é diagnosticada, por vezes, em necropsias de indivíduos
assintomáticos, que morreram por outras causas).
- Causa infecção em milhões de pessoas, mas só causa a doença na minoria.
EPIDEMIOLOGIA
_ Pb isolado do solo, vegetais e fezes de morcegos
_ Clima úmido, Temp. 11 a 30o C
_ México até a Argentina (áreas mais endêmicas no Brasil, Venezuela e Colômbia)
_ Trabalhadores rurais, sexo mesculino 8:1. Até a puberdade a incidência da doença é igual nos
dois sexos. Predominância entre 30 e 50 anos de idade. A maioria infectada é do sexo
masculino devido à proteção dada pelos estrógenos na mulher adulta, além desta se expor
menos ao P. brasilienses. Além disso o P. brasiliensis tem receptores para o estradiol, o
impossibilita a transformação do micélio em levedura.
_ O surgimento da doença também é relacionado ao alcoolismo e a desnutrição. Pode também
se comportar como agente oportunista, em indivíduos imunodeprimidos.
_ Transmissão: inalação ou implantação traumática / não há congênita ou inter-humana (não é
contagiosa). Lesões de mucosa oral, retal, intestinal e cutâneas devem ser consideradas
secundárias à disseminação hematogênica do agente a partir dos pulmões.
_ PI: desconhecido (20 a 30 anos)
_Deflorestamento de bacias hídricas, caça a tatus, escavação do solo, cafezais predomínio
no SE, com migração para outras áreas (BA, PA, RO)
PATOLOGIA
- O patógeno nos pulmões gera alveolite com neutrófilos, depois substituídos por
mononucleares e macrófagos. A partir da sexta semana aparecem os granulomas epitelióides.
A partir da vigésima ocorre disseminação para linfonodos, fígado e baço (sequência de eventos
em camundongos).
- Vias de disseminação : hematogênica, linfática e canicular. A linfática é a que ocorre mais
rapidamente, com adenomegalias em todo o corpo. Mesmo gânglios pequenos,
aparentemente sãos, podem mostrar a presença de fungos. A disseminação linfática pelos
pulmões confere o padrão em asa de borboleta observado em RX. A via hematogênica
possibilita a disseminação para vários órgãos. A via canalicular é importante na disseminação,
paricularmente no pulmão, através da árvore traquebrônquica.
- 2 fatores são fundamentais : a virulência do agente e a capacidade de resposta imunológica.
Existem cepas mais resistentes, mas não se sabe se estão relacionadas a gravidade da doença.
- Mecanismos de defesa : imunidade mediada por células e a fagocitose por células do sistema
fagocítico-mononuclear. Em pacientes com formas sistêmicas da doença, ocorre depressão da
imunidade dependente de linfócitos T (fundamentais na defesa imunológica), o que é atestado
pela negatividade em testes cutâneos, pela ausência de transformação blástica de linfócitos
utilizando paracoccidioidina, pela redução de linfócitos T circulantes e pela presença de
granulomas frouxos, ricos em parasitas nas lesões. Além disso ocorre queda no número de
linfócitos T helper circulantes, na secreção de linfocinas e na produção de determinados
ativadores de macrófagos. Os neutrófilos fagocitam normalmente, mas não conseguem digerir
os fungos. A virulência da cepa relaciona-se com a capacidade de digestão. O sistema
complemento também pode ser ativado pelo próprio P. brasiliensis, o que resulta em uma
fagocitose mais eficiente pelos macrófagos. Ocorre aumento de imunoglobulinas, que vão
atuar na opsonização do agente infeccioso.
- O trato respiratório é a porta de entrada, sendo os pulmões, os primeiros
- A infecção e a sobrevivência do fungo no pulmão pode levar a 3 situações : infecção
assintomática
(paracoccidioidomicose-infecção),
paracoccidioidomicose-doença
e
paracoccidioidomicose residual (sequelar). A progressão da doença depende da virulência e
quantidade de inóculo e dos mecanismos de defesa do hospedeiro.
_ Demonstração do fungo
_ Reação granulomatosa
_ Células de Langhans (células gigantes)
_ Necrose de caseificação e supuração no centro do granuloma
_ Fibrose cicatricial calcificação
_ Células histiocitárias, tipo Virchow (fenômenos imunoalérgicos)
CLASSIFICAÇÃO E AVALIAÇÃO DA GRAVIDADE
- Paracoccidiodomicose infecção = o complexo primário involui espontaneamente, embora
possa haver fungemia (focos metastáticos). As cicatrizes dessas lesões iniciais podem se tornar
estéreis ou podem persistir os fungos com formação de foco latente ou quiescente.
Excepcionalmente as lesões primárias podem evoluir, com sinais e sintomas da forma aguda
ou subaguda (juvenil). Usualmente a alveolite pulmonar bloqueia o crescimento dos fungos em
um nódulo fibrótico e encapsulado. A infecção primária pode ser assintomática ou
oligossintomática (sinais e sintomas transitórios, inespecíficos e indistinguíveis de infecções
virais pulmonares).
- Paracoccidiodomicose doença = processo piogênico-granulomatoso, em geral como evolução
crônica. Atinge pulmões, mucosa oral e da vias respiratórias, a pele e os gânglios linfáticos.
Mais frequentes no sexo masculino (fator de proteção hormonal em mulheres) nos adultos e
indiferente entre sexos nas crianças. Pode apresentar-se na forma latente ou quiescente em
granulomas e nódulos fibróticos pulmonares ou extrapulmonares. A latência ocorre pela
redução da atividade metabólica dos fungos e explica os longos períodos de latência da
doença. Esses períodos podem ser rompidos por fatores (tabagismo, alcoolismo, déficits
nutricionais, imussupressão, reinfecções, fatores genéticos) que alterem a relação parasitahospedeiro e determinar a forma crônica da doença.
- Forma aguda / subaguda mais observada em crianças e jovens, com tendência a
disseminação pelo sistema linfático e outros tecidos.
- Forma crônica ocorre em adultos, é mais localizada e acomete mais pulmões e
vias repiratórias.
- Unifocal / Multifocal (+ comum)
- Forma residual ou sequelar = pode deixar sequelas anatômicas e funcionais e até
levar à morte. Reicidivas são frequentes.
- Importância da avaliação imunológica para o prognóstico comprometimento do estado
geral, perda de peso, tipo de linfadenopatia supurada ou não e presença de envolvimento
pulmonar.
- Sequelas microstomia, estenose da traquéia, fibrose pulmonar e insuficiência supra-renal.
- Co-infecção com HIV formas disseminadas da micose, por reativação de focos quiescentes
da micose.
FORMA AGUDA/SUBAGUDA (juvenil)
- até 35 anos
- 3 a 5% dos casos
- Evolução + rápida
- Quadro clínico desencadeia logo após a infecção primária incompetência dos
mecanismos de defesa, inalação de grande quantidade de conídios ou infecção por amostra
muito virulenta do fungo.
- Pode resultar também de reinfecção pelo fungo.
- Linfadenomegalia, manifestações digestivas, hepatoesplenomegalia, evolvimento ósteoarticular e lesões cutâneas
FORMA CRÔNICA (adulta)
- + 90% dos pacientes.
- Adultos entre 30 e 60 anos, predomínio de homens
- Progride lenta e silenciosamente, pode levar anos para ser diagnosticada
- Manifestações pulmonares em 90%
- Geralmente, apresentação multifocal. Pulmões, mucosas e pele são os + acometidos
- Avaliação imunológica = prognóstico, atividade da doença, acompanhamento clínico e
controle de cura.
- Critérios de gravidade = tratamento
- Estomatite moriforme (lesão na boca que parece uma amora) = fecha diagnóstico
- Forma ganglionar = focos críticos (locais que o remédio não alcançou) que reicidivam
- Infecção depende da resposta imuno-celular = síntese de citocinas que ativam macófagos e
linfócitos CD4 e CD8+
- Indivíduo doente = depressão da resposta tipo 1
- Formas mais graves = resposta imunológica tipo 2, maior ativação de linfócitos B
- Alterações da resposta imunológica indicam se há fungos quiescentes.
Quadro Clínico
- Tendência à disseminação
- Predomínio do envolvimento de pulmões, linfonodos e mucosas das vias aerodigestivas
superiores.
- Geral : mal-estar generalizado, indisposição, anorexia e emagrecimento (pode chegar à
caquexia). Febre nem sempre presente, é sinal de gravidade.
- Pulmões : porta de entrada, quase todos os casos. Causa dispnéia progressiva. Pode aparecer
tosse e expectorção. Hemoptóicos são mais raros. Não há dor torácica. O comprometimento
pulmonar também pode ser assintomático. A semiologia pulmonar é pobre. Há
comprometimento da função pulmonar (não melhora mesmo com a regressão das lesões
radiológicas).
- Linfonodos : pode ocorrer adenopatia subclínica (lesões em linfonodos considerados normais
ao exame clínico), com depressão imune celular por lesão do tecido linfóide. Queixa mais
frequente na forma aguda ou subaguda da doença. Pode ocorrer ainda adenopatia abdominal,
que pode levar à compressão extrínseca das vísceras ocas (icterícia por compressão de vias
biliares, síndrome da compressão da veia cava inferior, quadro de suboclusão ou oclusão
intestinal). O comprometimento linfático mesentérico pode levar à síndrome de má absorção,
por vezes acompanhada de ascite quilosa.
- Mucosa das vias aerodigestivas superiores : fossas nasais, cavidade oral, orofaringe,
hipofaringe e laringe. Ocorre rouquidão, odinofagia, disfagia, ardor na garganta e dispnéia.
Pode ocorrer amolecimento dos dentes por acometimento do periodonto. Estomatite
moriforme é uma lesão de evolução lenta, exulcerada.
- Pele : alcançada pelo fungo por disseminação hematogênica ou por contiguidade. Raros casos
em que é a porta de entrada. O comprometimento cutâneo pode se confundir com sarcoidose,
cromoblastomicose e TB.
- Supra-renais : os sintomas relacionados com a insuficiência supra-renal crônica são
indisposição, cansaço fácil, anorexia, emagrecimento, diminuição da PA, hipotensão postural,
hiperpigmentação da pele e mucosas, náuseas, vômitos e diminuição da potência sexual e
libido. Baixos níveis plasmáticos de cortisol e aldosterona, mesmo com estimulação com ACTH.
- Aparelho digestório : sialorréia, disfagia, halitose, dor abdominal, empachamento, queimação
e alteração da motilidade intestinal são os sintomas mais frequentes. Íleo, estômago,
duodeno, jejuno, colo ascendente e descendente são os seguimentos mais acometidos. Em
geral, não há queixas relacionadas à lesão hepática.
- Ossos e articulações : envolvidos na doença disseminada. Trauma prévio deve ser
considerado fator desencadeante da infecção. A partipação óssea é, em geral, assintomática.
Nas articulações ocorre dor e impotência funcional.
- SNC : lesões podem ser tumorais (hipertensão intracraniana, sintomatologia sensitiva e
déficits motores) ou meníngeas (base do encéfalo).
- Olhos e anexos : comprometimento unilateral. Lesões palpebrais e conjuntivais.
- Aparelho urogenital : quase exclusivo em homens. Epidídimo, testículo e, a seguir, próstata.
- Tireóide : níveis séricos de T3 reduzidos
HISTÓRIA NATURAL semelhante com a da TB
FORMAS POLARES DA PB MICOSE
1. Pólo anérgico (-)
2. Pólo hiperérgico (+)
Na forma aguda, há falha do sistema imune, sem produção de citocinas (predomínio da
resposta TH2).
FORMAS CLÍNICAS
I. Infecção Paracoccidióidica
II. Paracoccidioidomicose Doença
1. Forma regressiva
2. Formas progressivas
2.1 Forma aguda ou sub-aguda (tipo juvenil)
A- Com adenomegalia superficiais (mod. ou grave)
B- Com acometimento abdominal ou do aparelho digestivo (forma grave)
C- Com comprometimento ósseo (forma grave)
D- Com outras manifestações clínicas (mod. ou grave)
2.2 Forma crônica (tipo adulto)
A-Forma leve
B-Forma moderada
C-Forma grave
3. Forma seqüelar
RX da forma pulmonar poupa ápice e base, acúmulo de infiltrado no meio.
FORMA AGUDA/SUBAGUDA
HOMENS : MULHERES = 1 A 2:1
< 30 ANOS
LIGAÇÃO C ZONA RURAL RECENTE
FORMA CRÔNICA UNIFOCAL/MULTIFOCAL / LEVE MODERADA GRAVE
HOMENS : MULHERES > 10:1
CIGARRO E ETILISMO
LIGAÇÃO C ZONA RURAL RECENTE / PRÉVIA
DIAGNÓSTICO
• IDENTIFICAÇÃO DO FUNGO:
• esfregaço de lesão mucosa, secreção de gânglio, escarro, lavado brônquico etc;
• histopatológico, com coloração específica;
• cultura
• SOROLOGIA: >90% quando usa > 2 métodos
• Imunodifusão: p/ diagnóstico; +, frac. + ou • Contraimunoeletroforese p/ seguimento: 1:1... 1:2048
• Outras: fixação de complemento, imunofluorescência indireta, ELISA
• Dados Clínicos e epidemiológicos
• Exame Direto
– citologia e histopatologia
– cultura e inoculação em animais
• Exame Indireto
– Reação de precipitação: imunodifusão e
– Reação de fixação de complemento
• Outros exames subsidiários
– eletroforese de proteinas
– estudo radiológico
COMPLICAÇÕES CLÍNICAS
FORMA AGUDA/SUB-AGUDA
•FRATURAS PATOLÓGICAS
•ALTERAÇÕES DE TRATO GI diarréia, má absorção intestinal, desnutrição, compressões
extrínsecas-vias biliares, ascite
FORMA CRÔNICA
• ADDISON
•DIFICULDADE P/ DEGLUTIÇÃO desnutrição
•INSUFICIÊNCIA RESPIRATÓRIA
DIAGNÓSTICO DIFERENCIAL
FORMA AGUDA/SUB-AGUDA
•LINFOMAS
•TUBERCULOSE GANGLIONAR
•ARTRITES E OSTEOMIELITES
•LUES 2ária (SÍFILIS)
FORMA CRÔNICA
•TUBERCULOSE PULMONAR
•HISTOPLASMOSE
•PROCESSOS NEOPLÁSICOS (baso/espinocelular, pulmão, cabeça e pescoço)
TRATAMENTO
ATAQUE- LEVES A MODERADOS (sem SNC)
Sulfadiazina, Sulfametoxazol-trimetoprim, Imidazólicos
MANUTENÇÃO- LEVES A MODERADOS (sem SNC)
Sulfametoxipiridazina (sulfa lenta), Sulfametoxazol-tmt.
ATAQUE - CASOS GRAVES
Anfotericina B, Itraconazole, associar drogas: Anf-B + Sulfas/
Itraconazole?
SNC- Sulfadiazina / SMX-TMP / Anf-B
CRITÉRIOS DE “CURA”
– Clínico - regressão dos sinais e sintomas da doença, cicatrização das lesões, involução das
adenopatias, estabilização do peso corporal
– Micológico - negativação no exame direto e histopatológico
– Radiológico - estabilização das imagens em cinco radiografias, num intervalo de três meses
– Imunológico - negativação ou estabilização em títulos baixos da Imunodifusão.
Paracoccidioidina (teste cutâneo com antígeno do P. brasiliensis, leitura de 48h: negativo, < 5
mm, p/ +, > 5mm diâmetro
– Acompanhamento pós-terapêutico: Clínico/sorológico
MONITORAMENTO DO TRATAMENTO: RADIOLOGIA
SEQUELAS
•Fibrose Pulmonar
•Addinson
•Microstomia
•Traqueostomia (Estenose Traquéia)
•Má-absorção Intestinal
CRIPTOCOCOSE
Micose profunda rara, cosmopolita, com comportamento oportunista. Aumento da
prevalência com o advento da AIDS.
Cryptococcus
- Espécie mais importante = neoformans (mais comum no Brasil)
- Cresce em meios com ágar-Sabouraud ou ágar-extrato de malte (37°C)
- Identificação do fungo – usa-se a capacidade de assimilar carboidratos e a capacidade de
hidrolisar uréia.
- Variedades do fungo apresentam diferenças bioquímicas e genéticas e diferenças antigênicas
e epidemiológicas significantes.
Epidemiologia
- Mais frequente em homens (70%) e em adultos (maioria entre 30 e 60 anos)
- Encontrado no mundo todo. Os fungos crescem nas fezes dos pombos, mas o animal não se
infecta (temperatura corpórea de 42°C).
- Não há contágio inter-humano. Aumento do nº de casos em imunossuprimidos (pacientes
com linfomas, leucemias crônicas, diabetes, LES, sarcoidose, AIDS, uso de corticóides e
transplantados). Na co-infecção com AIDS, a criptococose é incurável e requer terapêutica
supressiva antifúngica (sobrevida média de 8,4 meses).
- A mortalidade da doença é alta, e, nos casos de cura, são frequentes as sequelas neurológicas
Patogenia e patologia
- Inalação das formas leveduriformes
- No parênquima pulmonar pode determinar reações tissulares e de defesa imunitária
mediada por células. Se não ocorre esse bloqueio, a infecção pode permanecer localizada ou
disseminar-se.
- A via gastrintestinal e a inoculação cutânea são formas de infecção raras.
- A resistência natural humana é muito importante, portanto, essa infecção pode ser o
primeiro sinal de uma imunossupressão.
- Patogênese depende da virulência do fungo e a resposta imune (sobretudo celular).
- Fatores de virulência = cápsula composta por mucopolissacarídeos (propriedades deletérias e
antifagocitárias, além de efeitos deletérios no sistema imune) e a produção de enzimas
(protege o fungo dos radicais livres).
- Uma resposta imune normal do hospedeiro elimina ou sequestra o fungo, que pode
permanecer latente no organismo.
- Alterações no sistema imune permitem que a infecção primária ou, mais comumente, a
reativação do fungo sequestrado determina a disseminação secundária. Os locais mais
acometidos são: SNC, pulmões, miocárdio, pericárdio, gânglios linfáticos, trato GI, fígado, baço,
medula óssea, articulações, sangue, olhos, pele e próstata (reservatório crítico do fungo).
- A meningite criptococósica acomete pacientes com AIDS e linfócitos CD4 abaixo de 100.
Tipos de infecção por criptococcus
- Pulmonar
- Disseminada
Criptococose Pulmonar Manifestações clínicas
- Ocorre após exposição intensa. Normalmente, a lesão inicial é transitória, resolvendo-se por
resposta inflamatória local.
- Pode ocorrer desde uma colonização assintomática até formas graves, com síndrome do
desconforto respiratório do adulto.
- O comprometimento pulmonar pode ser isolado ou associado a outras localizações e pode
não ser evidente mesmo em casos de criptococcemia ou meningite.
- Tosse
- Dor Torácica
- Escarro hialino
- Emagrecimento
- Febre baixa
- Hemoptise
- Derrame Pleural
- Dispnéia
- Fraqueza
A clínica não é muito característica
Aparece um nódulo no RX = por punção = diagnóstico
Meningite Criptocócica Manifestações clínicas
- É a mais frequente manifestação clínica (70%)
- Início brusco ou insidioso
- É obrigatória a punção liquórica em doentes com criptococose em qqr localização. No líquor :
hipercelularidade com predomínio de neutrófilos linfomononucleares, aumento das proteínas
e diminuição da glicorraquia.
- Cefaléia
- Sinais Meníngeos
- Nível de consciência alterado
- Alterações motoras
- Paralisia de nervos cranianos
- Sintomas cerebelares
- Hipertensão clínica (+ tardia)
Muitos sintomas
Diagnóstico
Criptococose Pulmonar
- materiais orgânicos (escarro, liquor, sg, fragmentos de biópsia, lavado broncoalveolar e
aspirados de medula óssea, gânglios ou tumorações)
- histologia
- cultura +
Meningite
- antígeno criptocócico
- tinta da china (no líquor) = pode dar negativo = repetir
- cultura positiva
Prognóstico
- Depende do sítio de infecção, início da terapia (precoce ou alterada), eficácia das drogas,
situação imunológica e clínica do paciente
- Longo período de terapia antifúngica
HISTOPLASMOSE
A histoplasmose é uma infecção causada pelo Histoplasma capsulatum nos seres
humanos e em varias espécies de animais. A infecção se da pela inalação de microconídias
espalhadas pelo ar. Essa espécie apresenta três variedades: H. capsulatum var capsulatum, H.
capsulatum var duboisii, e o H. capsulatum var. farciminosum.
O H. capsulatum var capsulatum apresenta-se nas lesões como elementos
leveduriformes, esféricos ou ovóides, com apenas um brotamento e uma parede celular não
captadora de anilina. A maior parte desses elementos encontra-se no interior de macrófagos
ou células gigantes, podendo algumas vezes invadir neutrófilos polimorfornucleares. Nas
preparações coradas com Giemsa ou Wright, a parede celular não capta o corante, aparecendo
como um halo claro e o citoplasma apresenta-se como uma massa cromática unipolar azulescura a azul celeste, de formato semilunar. O H. capsulatum é um Gram positivo nos
esfregaços, tem a coloração arroxeada nas preparações histopatológicas coradas com PAS e
tinge-se de marrom a negro com a metenamina de prata de Grocott.
Os focos com grande densidade de fungo são locais com dejeções de aves de criação,
morcego ou pássaros: galinheiros, grutas habitadas por morcegos, cúpulas de prédios, etc. Tais
locais podem ser denominados “pontos endêmicos”.
O H. capsulatum causa infecção natural em varias espécies animais, sendo mais
freqüentes nos cães, roedores e morcegos. Esses últimos podem ter infecções intestinais,
excretar o fungo e transmitir a infecção aos outros animais.
A infecção, quase sempre, é produzida pela inalação de micronídias da fase
filamentosa. Estas penetram até o alvéolo pulmonar, são fagocitadas pelos macrófagos e se
transformam em elementos leveduriformes gemulares. A fase leveduriforme do H. capsulatum
se reproduz inicialmente no parênquima pulmonar, invadindo posteriormente os linfonodos
hilo-mediastinais e, finalmente, disseminando-se pela corrente sanguínea. Esta fungemia é
assintomática e permite que o H. capsulatum parasite todos os tecidos do sistema monocíticohistiocitário, tais como pulmões, fígado, baço, linfonodos e estruturas linfáticas do tubo
digestório. Nas fases iniciais da infecção, a resposta inflamatória é constituída por neutrófilos
que rapidamente, são constituídas por neutrófilos e macrófagos. Estes são capazes de
fagocitar o fungo, porém não o lisam, permitindo, então, seu desenvolvimento. Após a 2° ou 3°
semana de infecção, os linfócitos T CD4 se sensibilizam e passam a secretar linfocinas, tais
como o interferon gama, interleucinas (principalmente a IL2) e fator de necrose tumoral.
Esssas citocinas ativam os macrófagos que adquirem, então, a capacidade de lisar as leveduras
do H. capsulatum. Concomitante a isso, a resposta inflamatória se modifica, dando origem à
formação de granulomas epitelióides, com células gigantes, uma área central de necrose
caseosa e um envoltório periférico de fibrose colagenosa com tendência á calcificação.
Simultaneamente, passa-se a detectar a positividade à intradermorreação com histoplasmina
e, duas a três semanas depois, tornam-se evidentes os anticorpos específicos. Neste estado, o
hospedeiro é bastante resistente a novas infecções, porém se estas não ocorrerem, a
imunidade mediada por células específicas decresce, podendo, raras vezes, originar
reinfecções exógenas que têm um período de incubação mais curto e uma evolução mais
rápida.
Tem sido descrito muitos poucos casos de primoiinfecção cutânea, com a formação de
nódulos, localizados e tendência à cura espontânea.
Nos indivíduos acometidos por doença pulmonar obstrutiva crônica (DPOC), não
ocorre cura espontânea da primoinfecção pulmonar. Os focos de pneumonite sofrem
reativação periódica e dão origem paulatinamente à histoplasmose pulmonar crônica cavitária.
As outras formas progressivas dessa micose profunda são devidas à falhas, mais ou
menos graves, dos mecanismos de fagocitose e lise dos macrófagos. Assim desenvolvem-se as
formas disseminadas agudas, subagudas ou crônicas.
Fungo dimórfico e geofílico com inoculação através do ar
Três variedades:
- H. capsulatum var capsulatum
- H. capsulatum var dubosii
- H. capsulatum var farciminorum
Infecção por inalação de microconídias da fase filamentosa
Crescimento em solos ricos em substâncias orgânicas e pH ácido, onde há dejeções de aves ou
morcegos
Distribuição no solo restrita à área de maior endemicidade
Áreas endêmicas = grandes áreas fluviais e lagos
Pontos endêmicos = galinheiros, grutas habitadas por morcegos, cúpulas de prédios...
Infecções em cães, roedores e morcegos (eliminação nas fezes)
Correntes de ar carregam conídeos para grandes distâncias
EPIDEMIOLOGIA
- 20 a 90% da população adulta tem reação intradérmica +
- Distribuição mundial
- América e África
- Sul do Canadá até regiôes centrais da Argentina
- Maiores zonas endêmicas = vales dos rios Mississipi, Missouri e Ohio, bacia do rio da Prata e
Serra do Mar
PATOGÊNESE
Inalação Fagocitose pelos macrófagos alveolares Elementos leveduriformes gemulantes
no parênquima pulmonar Linfonodos mediastinais Disseminação hematogênica
assintomática Ativação de todos tecidos do sistema monocítico histiocitário
Hepatoesplenomegalia importante (leva um tempo)
1ª SEMANA
Resposta inflamatória mediada por neutrófilos Linfócitos/Macrófagos Multiplicação no
interior do macrófago
2ª A 3ª SEMANAS
Sensibilização dos linfócitos T-CD4 Produção de linfocinas TH1 e TH2 Ativação dos
macrófagos (lise fúngica) Formação de granulomas epitelióides (células gigantes, área
central de necrose caseosa e envoltório periférico de fibrose colágena com tendência à
calcificação) + intradermorreação com histoplasmina e, 2 a 3 semanas depois tornam-se
evidentes os anticorpos específicos Cura da primo infecção
SITUAÇÕES ESPECIAIS
DPOC
- Não ocorre cura espontânea da infecção pulmonar
- Focos de pneumonite sofrem reativação periódica, dando origem à histoplasmose
pulmonar crônica cavitária
Falhas graves na imunidade celular
Evolução desfavorável em indivíduos sem história de imunodepressão
- Predomínio da resposta TH2
Formas agudas, subagudas e crônicas de histoplasmose
CLASSIFICAÇÃO
Histoplasmose do hospedeiro normal
1. Primo infecção assintomatica
2. Infecção Pulmonar Aguda
- Moderada a severa
- Inóculo maciço
3. Infecção Pulmonar Subaguda
- Assintomática ou doença leve
- Inóculo leve
- Infiltrados focais ou múltiplos
- Adenopatia hilar ou mediastinal
- Recuperação espontânea em 1 mês
Histoplasmose em pacientes com DPOC
- Histoplasmose pulmonar crônica cavitária
- Queda do sistema imune
- Não ocorre cura espontânea
- Cavitação
- Lembra TBC
- Lenta e progressiva
* Dependendo da doença de base formas mais graves
Histoplasmose em imunodeprimidos
1. Histoplasmose disseminada grave
- clínica variada
- hepatomegalia
- linfadenomegalia
- falência hepática
- comprometimento SNC
- meningite
- falta resposta celular
- RX = imagem em espelho (homogêneo)
= lembra TB miliar
- disseminação gastrintestinal
- disseminação adrenal
- < 10% casos
- massa adrenal
- insuficiência adrenal (necrose adrenal)
- S. Addison
- pericardite
2. Histoplasmose disseminada crônica
- sem disseminação hematogênica
- + manifestações dermatológicas
3. Histoplasmose disseminada subaguda
- Semelhante à aguda, mas com evolução mais prolongada e deterioração mais lenta do
estado geral.
Doença determinada imunologicamente
- histoplasmonas = lesões numulares, únicas ou múltiplas de lento crescimento
excêntrico, com calcificações concêntricas
- fibrose mediastinal
- hipersensibilidade aos antígenos de H. capsulatum
- linfonodos paratraqueais direitos e subcarinais, gerando atelectasia lobar média,
compressão de artérias, veias pulmonares e esôfago e pericardite crônica
- síndrome ocular
Diagnóstico
Análise da resposta imune específica
_ Isolamento do H. capsulatum obtido das lesões estudadas
_ Reações sorológicas
- Imunodifusão em gel – sensibilidade de 90%
- Contra-imunoeletroforese – maior sensibilidade
- Fixação de complemento – 25% de reações cruzadas
HEPATITES
•
Definição: designação genérica de várias doenças difusas, inflamatórias,
degenerativas e regenerativas do fígado.
•
Agentes causais: - Vírus
- Bactérias
- Fungos
- Parasitas
- Produtos químicos
- Auto-imune
CAUSAS
•Ingestão abusiva de bebidas alcoólicas
•Infecções bacterianas, fúngicas, por protozoários
•Ação de medicamentos hepatotóxicos
•Ação de agentes químicos hepatotóxicos
•Ação de células citotóxicas (auto-imune)
•Infecções virais: HCMV, HSV, FA, VH a,b,c,d,e+ VH f,g,tt,sen
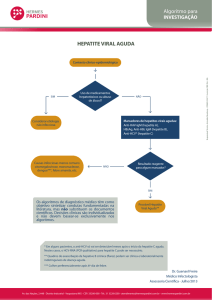
HEPATITES VIRAIS AGUDAS
•
Etiologia: A, B, C, D, E, F, G
•
Outros vírus: VEB, VCM, VVZ, VHS,
Sarampo, Rubéola,
Caxumba, Coxsackie B,
Febre Amarela
HEPATITE VIRAL – Perspectiva Histórica
- Infecciosa A
- Sérica B, D
- NANB Transmissão Entérica E
Transmissão Parenteral C
F, G, Outras ?
A
Fonte do vírus
fezes
Forma de
transmissão
fecal-oral
Infecção crônica
não
imunização prépós
exposição
Prevenção
B
sg/derivados
fluidos
corpóreos
percutâneo
permucosa
Sim
imunização prépós
exposição
Formas de Hepatite
C
D
sg e derivados
sg e derivados
•
•
•
percutâneo
permucosa
sim
Doador de sg
screening
comport.
modificado
percutâneo
permucosa
sim
imunização prépós
exposição
comport.
modificado
1. Infecção auto-limitada
a) anictérica
b) ictérica
c) recorrente
d) colestásica
2. Infecção persistente
a) portador
b) hepatite crônica persistente
3. Infecção progressiva
a) hepatite crônica ativa
b) hepatite aguda grave (fulminante)
c) cirrose - carcinoma
d) carcinoma hepato-celular
4. Formas atípicas extra-hepáticas
FATORES DETERMINANTES
•
•
•
•
•
•
tipo antigênico do vírus causal (capacidade citopática)
forma de infecção (carga viral do inóculo)
estado nutricional e suscetibilidade do hospedeiro
doença hepática pré-existente
estado imunitário prévio (humoral e celular)
individual e populacional
MANIFESTAÇÕES CLÍNICAS
Quatro Fases Clínicas :
fezes
fluidos corpóreos fluidos corpóreos
FORMAS CLÍNICAS
•
E
fecal-oral
não
consumir água
potável
I - Período de Incubação (varia de acordo com o vírus) = período entre a penetração do
vírus e a manifestação de sintomas. Em geral, não é conhecido.
•
•
•
•
•
•
VHA de 15 a 50 dias (média 30 dias)
VHB de 45 a 180 dias (média de 60 a 90 dias)
VHC de 15 a 180 dias (média de 45 dias)
VHD de 15 a 45 dias (média 30 dias)
VHE de 15 a 60 dias (média 40 dias)
Não A-E : etiologia desconhecida
II - Período Pré Ictérico ou Prodrômico
Conjunto de sintomas não específicos que antecedem o aparecimento da icterícia
Pode ou não estar presente. Em crianças são mais brandos e, com frequencia,
ausentes. Duração de aproximadamente 10 dias
Sintomas mais freqüentes: “gripe-símile” -- mal estar, anorexia, náuseas e dor no
hipocôndrio direito
Nesta fase pode ocorrer Síndrome do Soro Símile.
Em 15% dos casos: febre, rash cutâneo e artralgia.
III - Período Ictérico
Duração de 1 a 3 semanas
Geralmente com redução dos sintomas prodrômicos
Hepatomegalia dolorosa e discreta, com ocasional esplenomegalia
Icterícia pode ou não ocorrer (2 a 50% dos casos)
- colúria
- prurido cutâneo e fezes claras nos casos de colestase
ALT e AST aumentam no final do período de incubação, cerca de 1 a 2 semanas antes
da elevação das bilirrubinas.
As manifestações clínicas dependem do tipo de hepatite
- A e C = raramente com icterícia
- B aguda = icterícia em 30 a 50% dos casos
- D = somente com co-infecção com VHB
- E = anictérica (exceção = gestantes)
III - Período de Convalescença
Desaparece a icterícia
Duração variável até cura ou progressão para Hepatite Crônica
Pode persistir prurido cutâneo
Adinamia = as vezes desproporcional ao período
Sensação de desconforto no hipocôndrio direito, fezes amolecidas e intolerância a
alimentos gordurosos
A situação pode ser confundida com cronificação da dça --- fazer biópsia do fígado para
esclarecimento, se necessário. Lembrando que o diagnóstico de cronicidade é
histopatológico. As hepatites A e E não se cronificam.
SINTOMAS: 4 fases na doença aguda
E
Febre, Rash
X
Artrite (15%)
P
___icterícia 2-50%
O
___urina escura
S
_______________mal estar 95%
I
_______________anorexia 90%
Ç
____________náusea 80%
Ã
_________dor QSD 60%
O
___________prurido 10%
___PI___> Pré-Ictérica > Ictérica
> Convalescença
(10 dias)
(1 a 3 semanas)
DIAGNÓSTICO DIFERENCIAL DAS HEPATITES VIRAIS AGUDAS
•
•
•
•
•
•
•
•
Hepatite alcoólica
Colecistite
Síndrome de Gilbert
Infecções bacterianas (Pneumonia pneumocócica, leptospirose)
Drogas (acetaminofen, isoniazida)
Toxinas (tetracloreto de carbono)
Injúrias inespecíficas (Anóxia, Choque, ICC)
Outros – colestase reacional, leptospirose ictérica, processos expansivos
neoplásicos ou granulomatosos, colangites e cirrose.
PATOLOGIA NA HEPATITE AGUDA
•
•
•
•
•
•
1. Desarranjo lobular (perda padrão cordões sinusoidais)
2. Balonização (aumento do volume e clareamento do hepatócito)
3. Degeneração eosinofíllica (corpos hialinos livres)
4. Necrose de células hepáticas (em faixa, multilobular, maciça)
5. Infiltrado mononuclear do parênquima e espaço porta
6. Variados graus de colestase
HEPATITE CRÔNICA
•
•
•
DEFINIÇÃO: Anormalidade na função hepática persistente por mais de 6 meses
(reação inflamatória persiste sem melhora, níveis elevados de
aminotransferases ou de marcadores virais)
A biópsia hepática verifica se predominam lesôes intralobulares (HC lobular) ou
portais e periportais (HC persistente ou ativa).
O diagnóstico final da hepatite deve basear-se na etiologia, grau e estágio da
doença. Na biópsia é possível referir-se ao grau de atividade baseado nas
•
lesões portais, periportais e intralobulares e fazer o estadiamento (grau de
fibrose e das alterações estruturais).
Os pacientes podem ser assintomáticos. Os sintomas, quando surgem, são
inespecíficos. Somente formas mais graves acompanham-se de icterícia e, na
fase cirrótica, edema, ascite e sinais de insuficiência hepática. A hepatomegalia
é frequente, e a esplenomegalia é mais proeminente nas formas avançadas.
MANIFESTAÇÕES CLÍNICAS
•
•
HCP (persistente) - fadiga, icterícia pode ou não estar presente
cirrose não se manifesta. Hepatites B e C podem evoluir para HCP
HCA – hepatites B e NANB/C. Icterícia flutuante, amenorréia, fadiga importante
que piora à tarde e à noite, desnutrição, “spiders”, hepatoesplenomegalia pode
estar presente. Desenvolvimento de cirrose – encefalopatia, edema, ascite,
varizes esofageanas.
HEPATITE FULMINANTE
•
•
•
•
•
•
Síndrome clínica caracterizada pela presença de encefalopatia, coagulopatia,
alterações hemodinâmicas e metabólicas com repercussão renal e cardíaca,
decorrente de necrose maciça dos hepatócitos.
Encefalopatia hepática – sempre presente. Acúmulo de substâncias tóxicas não
metabolizadas nem removidas da circulação insuficiente pelo fígado
desencadeia alterações fisiológicas que causam a EH e o edema cerebral (graus
III e IV de EH, principal causa de óbito nesses pacientes). Fatores extrahepáticos também contribuem para agravar a EH : Síndrome da Resposta
Inflamatória Sistêmica, hipoglicemia, hipoxemia, distúrbios hidroeletrolíticos e
acidobásicos, hemorragias digestivas e uso de benzodiazepínicos.
Coagulopatia, por falta dos fatores de coagulação e anticoagulação produzidos
pelo fígado.
Distúrbios Cardiocirculatórios – vasodilatação sistêmica, hipotensão arterial e
alto débito cardíaco pela perda da auto-regulação do tônus vasogênico. A
hipovolemia funcional resultante pode ser agravada por vômitos, queda da
ingesta de líquidos, sangramentos e edema intersticial. Piora a perfusão
tecidual, com hipóxia e acúmulo de lactato – agrava o dano hepático e a EH.
Insuficiência renal – ocorre por hipoperfusão renal não compensada, por
necrose tubular aguda ou por distúrbios funcionais na síndrome hepatorrenal.
Alterações metabólicas – hipoglicemia (redução da gliconeogênese, queda nos
estoques de glicogênio hepático e menor captação de insulina pelo fígado);
distúrbio ácido-básico ; alterações hidroeletrolíticas (hiponatremia,
hipocalcemia, hipocalemia, hipofosfatemia e hipomagnesemia). No distúrbio
ácido-básico, o quadro começa com alcalose respiratória por hiperventilação
central ou alcalose metabólica por hipocalemia compensatória renal. Nos
pacientes avançados de EH e edema cerebral, ocorre depressão dos centros
respiratórios e conduz a acidose repiratória, enquanto a hipóxia tissular e o
aumento da produção de lactato levam a acidose metabólica.
•
•
Maior susceptibilidade à infecções.
Aparecimento de sinais de falência hepática aguda:
- letargia, sonolência
- alterações personalidade: comportamento anormal
disfunção sexual
atitude agressiva
-esturpor- coma: asterixis, flapping língua
postura de descerebração
movimentos involuntários
“fetor hepaticus” (cheiro de maçã verde)
HEPATITE AUTO-IMUNE
•
•
•
•
•
•
Definição: Hepatite crônica de etiologia desconhecida comumente associada
com fenômenos auto-imunes.
Quadros característicos de cronicidade
Hipergamaglobulinemia
FAN, Células LE
Mais freqüente em mulheres (amenorréia)
Artrite e vasculite
Outras manifestações clínicas associadas às Hepatites Auto-imunes
• colite ulcerativa
• diabetes mellitus
• anemia hemolítica
• pneumonite, pleurite, pericardite
• glomerulite
• tireoidite
• púrpura trombocitopênica
Manifestações Extra-hepáticas
Hematológicas
• Crioglobulinemia mista
• Anemia aplástica
• Trombocitopenia
• Linfoma Não-Hodgkin de células b
Dermatológicas
• Porfiria cutanea tarda
• Liquen plano
Renais
• Glomerulonefrite
• Síndrome Nefrotica
Endócrinas
• Ac Anti-tireóide
• Diabetes mellitus
Salivares
• Sialadenite
Oculares
• Úlcera de Cornea
• Uveite
Vasculares
• Vasculite necrotisante
• Poliarterite nodosa
• Fibrose Pulmonar
Neuromusculares
• Fadiga/mialgia
• Neuropatia Periférica
• Artrite/artralgia
Fenômenos Autoimunes
• Autoanticorpos
• Doença do Soro Símile
Cardiovasculares
• Pericardite/miocardite
VÍRUS DA HEPATITE A
Doença viral aguda, de manifestações clínicas variadas desde formas subclínicas,
oligossintomáticas até formas fulminantes (menos que 1% dos casos)
Transmissão fecal-oral
• Água e alimentos contaminados com HAV eliminado nas fezes de indivíduos
infectados
• Sangue e derivados (raro<<<1%)
• Comum entre crianças que ainda não aprenderam noções de higiene
• A pessoa pode desenvolver ou não as manifestações da doença; 10 dias após ser
infectada ela passa a eliminar o vírus pelas fezes, durante 3 semanas.
Hepatite A - Fatores Clínicos
•
•
Período Incubação: Média: 30 dias
Variação: 15-50 dias
Icterícia e
grupo de idade:
•
Complicações:
•
Seqüelas crônicas: Nenhuma
<6 anos, <10%
6-14 anos, 40%-50%
>14 anos, 70%-80%
Hepatite Aguda Grave
Hepatite Colestásica
Hepatite Recorrente
DOENÇA AGUDA COM:
•Aparecimento discreto dos sintomas (exs. febre baixa, fadiga, dores abdominais,
perda de apetite, náuseas, vômitos)
•Icterícia ou níveis elevados das aminotransferases séricas, urina escura castanhoavermelhada, fezes amarelo-esbranquiçadas
•Icterícia:6-14 anos (40-50%) e > 14 anos (70-80%)
•Adultos são geralmente mais sintomáticos
•Complicações são raras: hepatite fulminante/colestática
•Muitos casos se resolvem espontaneamente em 2-4 semanas
•Recuperação completa: 99% dos casos
Patogênese
Incubação: 4 semanas (2-6)
•Cavidade Oral Trato GI Fígado via sangue
•Replicação nos hepatócitos (poucos danos celulares) liberação via bile intestinos
7-10 dias antes do aparecimento dos sintomas clínicos
•Danos hepáticos e síndrome clínica resultam da resposta imune e não do efeito
citopático direto do virus HAV
PERÍODOS
a) incubação: 15 a 45 dias;
b) prodrômico ou pré-ictérico: +/- 7 dias;
c) ictérico: geralmente 4 a 6 semanas;
d) convalescência
Agente etiológico:
Vírus da hepatite A (HAV). Vírus RNA, família Picornaviridae
Capsídeo icosaédrico 27-32 nm
•Sem envelope
•RNA ss+ (750 nucleotídeos=7,5 Kb)
•Genoma:duas regiões 5’ e 3’não codificadoras, e uma longa ORF (open read
frame) codificadora: 11 proteínas
•VPg : clivada nos segmentos P1, P2, P3
•Segmento P1= proteínas estruturais VP1, VP2, VP3 (capsômeros), VP4 (RNA), 2A
(capsídeo)
•Segmentos P2 e P3= proteínas não-estruturais 2B (permeabilidade membranas),
2C (replicacão genoma), 3A (ancoragem 3B e 3D), 3C (protease), 3D (polimerase
RNA dependente)
Família Picornaviridae
Gênero Hepatovirus HAV -Sorotipo único
Reservatório único: seres humanos
Modo de transmissão:
Fecal-oral, veiculação hídrica, pessoa a pessoa (contato intrafamiliar e
institucional), alimentos contaminados e objetos inanimados. Contribui para a
transmissão a estabilidade do VHA no meio ambiente e a grande quantidade de
vírus presente nas fezes dos indivíduos infectados.
Características epidemiológicas:
-Distribuição universal, forma esporádica ou surto
- > prevalência em más condições sanitárias e higiênicas
-freqüente em instituições fechadas
-países subdesenvolvidos acomete com mais freqüência crianças e adultos jovens;
nos desenvolvidos, os adultos
-mortalidade e letalidade baixas
Diagnóstico:
Na infecção aguda - anti-HAV IgM positivo (desde o início da sintomatologia e
normalmente desaparece após 3 - 6 meses do quadro clínico)
Na infecção passada e na vacinação: anti-HAV/IgG positivo (detectado uma semana
após o início dos sintomas e se mantém ao longo da vida)
Tratamento
Mortalidade Devido à Hepatite A segundo a idade
Evolução dos Marcadores
•
ALT
•
•
•
Anti-HVA
VHA Fecal
IgM anti-VHA
Concentração do Vírus da Hepatite A em Vários Fluidos Corporais
Fezes
Soro
Saliva
Urina – ausente
Padrão Global da Transmissão do Vírus da Hepatite A
Endemicidade
Alta
Moderada
Baixa
Muito baixa
Taxa de doença
Baixa a alta
Alta
Baixa
Muito baixa
Pico etário de infecção
Pré-escolar
Escolares e adultos jovens
Adultos jovens
Adultos
Padrões de transmissão
Pessoa a pessoa; surtos incomuns
Pessoa a pessoa; água e alimentos; surtos
Pessoa a pessoa; água e alimentos; surtos
Viajantes; surtos incomuns
Alta eficácia da vacina contra hepatite A (estudo)
Estratégias de Vacinação da Hepatite A
Considerações Epidemiológicas
• Muitos casos ocorrem em surtos
casos sem fator de risco identificado
altas taxas entre 5-14 anos de idade
crianças são reservatórios de infecção
• Pessoas com risco aumentado de infecção
– viajantes
– homosexuais masculinos
– UDI (usuários de drogas injetáveis)
•A prevenção inclui a utilização de água fervida ou clorada, e consumo de alimentos
cozidos
•Deve-se lavar as mãos com água e sabão antes das refeições
Vacinação Infantil Rotineira da Hepatite A
• Benefícios
– estabelecer sistema de distribuição
– vacinação prévia do período de risco
– potencial de interromper a transmissão
• Assuntos indefinidos/considerações
– imunogenicidade infantil
– desenvolvimento de vacinas combinadas
–
–
duração da proteção
custo-efetividade
Recomendações de Vacina de Hepatite A pré-exposição
• Pessoas com alto risco de infecção
– viajantes para países com endemicidade alta
– homossexuais e bissexuais masculinos
– UDI
– pessoas com doença hepática crônica
• Comunidades com altas taxas de hepatite A
- vacinação infantil de rotina
Vírus da Hepatite B
Transmissão parenteral: sangue e hemoderivados, contato sexual, uso compartilhado
de seringas e agulhas contaminadas
Países em desenvolvimento: Gestantes podem transmitir para o bebê sendo a hora do
parto a de maior risco (90%)
1/3 adultos são assintomáticos!!!
Concentração de HBV: alta (sangue e exsudatos), moderada (sêmen, secreções
vaginais e menstruais) e baixa (urina, fezes, suor, saliva, lágrimas e leite)
HBV
•Família Hepadnaviridae Gênero Hepadnavirus
•Virus envelopado
•DNA ds incompleto Circular
•Vírion =partícula de Dane
•Virus estável, muito resistente, o que o torna bastante infecioso !
Três tipos de partículas de natureza lipoproteíca:
Partícula de Dane1= vírion 42nm, completa, simetria icosaédrica
Duas outras sem material genético, resíduos membranas células contaminadas,
contendo o HBsAg
Estrutura esférica222nm, proteína : lipídeo (1:1)
Estrutura tubular3, 200nm >>> conteúdo lipídico
•DNAds circular incompleto
•Complexo da polimerase
•Estruturas gênicas: S, C, P, X
GENE S: codifica proteínas das espículas do envelope externo (HBsAg), tb participa na
adsorção do HBV às membranas dos hepatócitos
GENE C: codifica Ag core (HBcAg) capsídeo + HBeAg (Ag solúvel, não-estrutural).
Ambos Ag induzem produção de IgM e IgG, anti-HBcAg, anti-HBeAg (soro pcts HBV+)
GENE P: codifica polimerase (duplicação DNA e TR)
GENE X: codifica proteína X transativadorada transcrição viral ~ replicação (transcrição
DNA do HBV)
ANTÍGENO HBs = HbsAg
•Vários subtipos
•1 determinante de grupo = a(comum a todos os sorotipos)
•4 determinantes de subtipos = d, y, w, r
•Combinações + usuais: adw, adr, ayw, ayr
•Em cada subtipo há variedades antigênicas (nos) = adw2, adw4, ayw1, ayw2
•Américas do Sul e Norte: adw
•Brasil é também destaque o subtipo ayw
•Distribuição geográfica dos subtipos : local das origens e migração das populações
humanas infectadas –Importância epidemiológica
Fatores Clínicos
•
•
•
•
•
Período de Incubação:
Média 60-90 dias
Variação 45-180 dias
Doença Clínica (ictérica):
<5 anos, <10%
5 anos, 30%-50%
Hepatite Aguda Grave:
0.5%-1%
Infecção Crônica:
<5 anos, 30%-90%
5 anos, 2%-10%
Mortalidade Prematura da doença hepática crônica: 15%-25%
Fases
•Período de incubação: 60-90 dias (45-180 dias)
•Fase pré-ictérica ou Fase prodrômica: quando surgem os primeiros sintomas
inespecíficos (3-10 dias): mal-estar generalizado, cansaço, falta de apetite, febre baixa,
rash cutâneo, dores de cabeça, musculares e nas articulações ,a urina se torna escura
1-2 dias antes de aparecer a icterícia
•Fase ictérica(1-3 semanas): icterícia, hepatomegalia, bilirrubinemia, bilirrubinúria,
fezes claras (massa de vidraceiro), aumento das transaminases
< 5 anos <10% > 5 anos 30-50%
•Fase de convalescença ( semanas-meses): os sintomas começam a desaparecer
gradativamente. Recuperação total: 95% casos
Período de transmissibilidade
2 a 3 sem antes dos primeiros sintomas e mantém-se durante a evolução clínica
da doença. O portador crônico (HBs-Ag positivo) pode transmitir por vários anos
Tratamento:
Não existe tratamento específico para a forma aguda
Forma crônica:
-interferon
-lamivudina (HIV=3TC+TDF)
-adefovir
-entecavir
HEPATITE B e GRAVIDEZ
Transmissão vertical do VHB
Hepatite Aguda na Gestação
- 1o ou 2o trimestres = raro raro (+ 5%)
- 3o trimestre ou próximo ao parto ou até 5 sem. Após = 70 % - 90 %
Transmissão: sexual, exposição percutânea e de mucosas a fluidos corporais
contaminados e vertical
Adultos contaminados: 90% evoluem para cura
Recém-nascidos contaminados verticalmente: 70 a 90% tornam-se infectados
cronicamente
Possibilidade de profilaxia da transmissão vertical
Rastreamento sorológico da hepatite B obrigatório no pré-natal
Quadro clínico
PI: 30 a 180 dias
Sintomática: fases prodrômica, ictérica e de convalescença
Maioria assintomática ou oligossintomática
Profilaxia pré-exposição: VACINA
Gravidez e lactação não são contra-indicações
90 a 95% de resposta vacinal adequada em imunocompetentes
Não apresenta toxicidade
Raros efeitos colaterais
Técnica: injeção intra-muscular (deltóide) de 1ml, total de 3 doses (1 mês e 6 meses
após a 1ª dose)
Profilaxia pós-exposição
Gamaglobulina hiperimune : gravidez e lactação não são contra-indicações
Deve ser realizada associada ao esquema vacinal em pacientes não vacinadas
Técnica: injeção intra-muscular na dose de 0,06ml/Kg de peso
Maior eficácia se realizada dentro de 24 a 48 horas pós-exposição
Recomendações
Rastreamento sorológico no pré-natal
Tipo de parto obedece critérios obstétricos
Profilaxia do RN: gamaglobulina e vacina
Amamentação liberada
Solicitar sorologia do parceiro e filhos
Orientar condom ( anti-HBsAg do parceiro)
Profilaxia do RN (CDC,1998)
- Mãe HBsAg positivo ou desconhecido: vacina e gamaglobulina hiperimune (HBIG)
- Mãe HBsAg negativo: vacina VHB
Transmissão vertical do VHB
Gestante portadora do VHB: considerar a presença do HBeAg
HBeAg positivo: 80% de transmissão ao RN/neonato
HBeAg negativo: 5 a 15% (8%)
Transmissão mãe-filho do HBV (vertical)
Intra-útero (5 %)
transfusão materno –fetal
Perinatal (95 %)
sangue e secreções maternas (liq amniótico)
Pós-natal
contato próximo
leite materno (?)
Eficácia da profilaxia do RN
1- vacina
2- gamaglobulina
1 + 2 = 90 a 98%
1 = 72 a 83%
EVOLUÇÃO DA HEPATITE B
História natural da infecção pelo VHB
Padrão Global da Infecção Crônica HBV
•
Alta (8%): 45% da população global
– risco vitalício de infecção >60%
– freqüente infecção precoce em crianças
• Intermediária (2%-7%): 43% da população global
– risco vitalício de infecção 20%-60%
– infecção ocorre em todos grupos etários
• Baixa (<2%): 12% da população global
– risco vitalício de infecção <20%
– mais infecções ocorrem em adultos c/ grupos de risco
Concentração do Vírus Hepatitis B em Vários Fluidos Corpóreos
Alta
Moderada
Baixa / Não detectável
sg
soro
feridas exsudativas
Sêmen
fluido vaginal
Saliva
urina
fezes
suor
leite materno
Lágrima
Modos de Transmissão do Vírus da Hepatite B
• Sexual
• Parenteral
• Perinatal
Fatores de risco
MARCADORES SOROLÓGICOS EM DIFERENTES ESTÁGIOS DA INFECÇÃO PELO VHB
Estágio da Infecção
PI longo
Hep B aguda
HB ag AgHBs negativo
Portador são
Hep B crônica
HB infec recente
HB infec tardia
Vacinação VHB
AgHBs
+
+
+
+
-
anti-HBs
++
+/++
IgG
+
+
+++
+++
++
+/-
AntiHBc
IgM AgHBe anti-HBe
+/+
+
+/+
+/+
+/-/+
-
Eliminação da Transmissão do Vírus da Hepatite B
Objetivos
•
•
•
•
Prevenir Infecção crônica pelo HBV
Prevenir doença hepática crônica
Prevenir carcinoma hepatocelular primário
Prevenir infecção aguda sintomática pelo HBV
Estratégia
•
•
•
•
Prevenir transmissão perinatal do HBV (12 h de vida)
Vacinação de rotina de todas as crianças
Vacinação de adolescentes
Vacinação de adultos de grupos de “alto risco”
Indivíduos Suscetíveis
Profissionais da área da saúde;
Profissionais de outras áreas com risco elevado de contato; com sangue e
hemoderivados, como bombeiros, policiais, etc.;
Pacientes com hemoglobinopatias ou outras doenças que necessitam receber
sangue e hemoderivados com freqüência;
Pacientes em programas de hemodiálise;
Pacientes com infecção pelo HIV ou Aids;
Pacientes com doenças sexualmente adquiridas;
Pacientes com infecção pelo vírus da hepatite C;
Homens que fazem sexo com homens e homens que fazem sexo com homens e
mulheres;
Profissionais do sexo;
Profissionais e pacientes de instituições de saúde;
Profissionais e internos de instituições corretivas.
Estado de São de Paulo: as indicações para vacinação
Profissionais que exerçam atividade na área da saúde, preferencialmente nos
cursos de graduação, do setor público ou privado;
Policiais civis e militares;
Podólogos e manicures;
Tatuadores;
Auxiliares de necropsia;
Profissionais de funerárias responsáveis pelo preparo dos corpos;
Coletores de lixo hospitalar e domiciliar;
Carcereiros de delegacias e penitenciárias;
Profissionais do sexo;
Pessoas com exposição a sangue de portadores de hepatite B;
Comunicantes sexuais de casos agudos de hepatite B;
Comunicantes domiciliares de portador crônico do vírus da Hepatite B;
População institucionalizada;
População penitenciária;
Vítimas de abuso sexual;
Pacientes com risco de transfusão múltipla em virtude de doença hematológica
(hemofilia, talassemia, anemia, falciforme);
Pacientes em uso, ou aguardando hemodiálise;
Pessoas infectadas pelo HIV ou imunocomprometidos;
Portadores crônicos do vírus da Hepatite C;
Transplantados;
Doadores regulares de sangue
VÍRUS HEPATITE C
Período de Incubação
Média 6-7 semanas
Varia 2-26 semanas
Mod. (<20%)
Doença Aguda (ictérica)
Casos Fatais Baixo
Infecção Crônica
75%-85%
Cirrose 10%-20%
Mortalidade da Doença Hepática Crônica
1%-5%
Transmissão parenteral:
•usuários de drogas injetáveis 4X>HIV
•usuários de cocaína (erosões nasais)
•piercings, tatuagens
•transfusão (1991-triagem)*
•transplantes (doadores infectados)*
•exposição ocupacional a sangue
•nascimento de mãe HCV+ **
•contato sexual (parceiros infectados e/ou múltiplos parceiros) ***OMS: 3%
população +++África e ÁsiaAméricas 1,7%
* agora raras; ** só com alta [viral] ***difícil
HCV
Família Flaviviridae, Gênero Hepacavirus
•Vírus envelopado, 60nm, RNAss+ 9,5kb
•Reservatórios: homens e chimpanzés
•6 genotipos e vários subtipos/prevalência geográfica: classificação feita com base na
alta variabilidade das glicoproteínas do envelope
•G1a: Américas do Sul e Norte, Austrália
•G1b: Europa e Ásia
•G2a: Japáo e China
•G2b: EUA e norte Europa
•G3: Austrália e sul Ásia
•G4: África Setentrional e Central, Oriente Médio
•G5: África do Sul
•G6: Sudoeste asiático
•Brasil 65% G1; 4,6% G2; 30,2% G3; 0,2% G4; 0,1% G5
Evolução da hepatite C
75-80% assintomáticos
Infecção aguda: icterícia LEVE
Indice fatalidade: baixo (<1%)
Infecção crônica:60-85%
Hepatite crônica: 10-70%
Cirrose:<5%-20%
Mortalidade: 1%-5%
Manifestações extra-hepáticas
Crioglobulinemia mista
Tireoidite autoimune
Porfiria cutânea tarda
Líquen plano
Glomerulonefrite
Sialoadenite
membranoproliferativa
Poliarterite nodosa
Úlcera de córnea
Linfoma de células B
Síndrome de sicca
Fibrose pulmonar
Fenômeno de Reynaud
idiopática
Diagnóstico:
- sorológico: Anti-HCV
- indica contato prévio, deve ser confirmada pela pesquisa qualitativa de HCV-RNA
Hepatite C Crônica
Fatores Promotores de Progressão ou Gravidade
• Ingesta alcoólica importante
• Idade > 40 anos no momento da infecção
• Co-infecção (HIV, HBV)
• Sexo Masculino
Transmissão do HCV
• Percutânea
– Uso de Drogas Injetáveis
– Fatores de Coagulação antes da inativação viral
– Transfusão, transplante de doador infectado
– Terapêutica (equipamento contaminado, práticas inadequadas de
injeção)
– Ocupacional (pérfuro-cortante)
• Pela mucosa
– Perinatal
– Sexual
Fontes de Infecção em Pessoas com Hepatite C
• UDI 60%
• Sexual 15%
• Transfusional 10% (antes screening)
• Desconhecido 10%
• Outros* 5%
* Nosocomial; Profissionais da saúde; Perinatal
Uso de Droga Injetável e Transmissão do HCV
• Alto Risco entre usuários de droga injetável
• Aquisição precoce após início da prática UDI
• Quatro vezes mais freqüente que HIV
• Prevalence 60-90% após 5 anos
Queda na hepatite C pós-transfusional
Transmissão Nosocomial do HCV
• Considerado em contexto de surtos
• Equipamentos Contaminados
– hemodiálise*
– endoscopia
• Práticas de injetáveis inseguras
– plasmaferese,* flebotomia
– Medicação doses múltiplas
– injecões terapêuticas
Transmissão Ocupacional do HCV
• Baixa transmissibilidade nas exposições ocupacionais
Incidência média de 1.8% após acidente pérfuro-cortante com fonte HCV-positiva
– Associada com reencape de agulha
• Casos de transmissão de sangue em mucosa ocular
– Não há referência de transmissão pela exposição de sangue em pele
• Prevalência de 1-2% entre profissionais de saúde
– Menor que adultos na população geral
– 10 vezez menor que infecção pelo HBV
• Presença de fator de risco reconhecido não necessariamente significa “risco
aumentado”
Transmissão do HCV do Profissional de Saúde para o Paciente
• Raro
– Nos U.S.A., nenhum relato
– Relato na Espanha Cirugião de Tórax
• Muitos relacionados ao abuso de drogas
– Reuso de seringas com narcóticos
• Sem restricão recomendada para Prof. Saúde com HCV-infecção
Transmissão Perinatal do HCV
• Transmissão de gestante HCV-RNA positivo no parto
– Taxa de infecçào 6%
– Maior (17%) se co-infecção com HIV
– Carga viral sem papel definido
• Sem associação com
•
– Método de Parto
– Amamentação
Infecção vertical
Hepatite grave é rara
Transmissão Sexual do HCV
• Estudo Longitudinal Caso-controle
– Parceiros infectados, multiplos parceiros, iniciação sexual precoce, sem
preservativo, outras DSTs, sexo com trauma
– HSh risco semelhante aos heterossexuais
• Parceiros
– baixa prevalência (1.5%) entre parceiros fixos
• Infecção deve ser devido ao uso comum de instrumentos
pérfuro-cortantes (e.g., injecões, uso de droga) e carga viral
elevada
– Transmissão do homem para mulher mais eficaz
• maior indicativo de transmissão sexual (15% a 20% infec.ag. e
cr.)
Transmissão Domiciliar do HCV
• Rara mas não ausente
• Pode ocorrer através de exposição percutânea/mucosa ao sangue
– Teoricamente através de artigos pessoais contaminados (barbeadores,
escovas de dente)
– Equipamentos contaminados usados para terapia domiciliar
• Injecões*
• Remédios folclóricos
Outras Potenciais Exposições ao Sangue
• Nenhum ou insuficiente dado mostrando risco aumentado
– uso cocaina intranasal,
– tatuagem,
– body piercing,
– acupuntura,
– serviço militar
Esclarecimentos sobre a Transmissão do HCV
• HCV não é transmitido pelo beijo, carícias, espirro, tosse, alimentos ou água,
compartilhando utensílios de refeição, copos, garrafas ou contato casual
• Não excluir do trabalho, escola, jogos, bercários ou outros setores baseado no
status da infecção pelo HCV
Teste para HCV recomendado em
Usuários de drogas ilícitas injetáveis
Quem recebeu fatores de coagulação antes de 1987
Quem recebeu hemocomponentes ou órgãos antes de 1992
Pacientes submetidos a hemodiálise
Evidência de doença hepática
Profissionais da área da saúde (com suspeita de exposição a sangue
contaminado com HCV)
Crianças nascidas de mães HCV positivas
Vírus da Hepatite D (Delta)
Descrição:
- Doença viral aguda que pode evoluir para forma crônica
- transmitido junto com o HBV (co-infecção), ou a portadores de HBsAg (superinfecção)
- Co-infecção: hepatite aguda benigna (recuperação em até 95% dos casos)
- Superinfecção: prognóstico é pior
- Uso de drogas injetáveis e contato sexual
Características epidemiológicas:
Amazônica Ocidental e Matogrossense, a prevalência de HDV também é alta
em pacientes infectados pelo HBV
Áreas endêmicas do HBV, o HBsAg positivo constitui-se no principal fator para
propagação do HDV, assim como grupos de risco acrescido (UDI, hemodialisados e
politransfundidos)
Agente etiológico:
Vírus da Hepatite D ou delta (HDV); vírus RNA, família Deltaviridae
•Família Deltaviridae, Gênero Deltavirus
•Vírus envelopado, 35-37nm, 1.700 nucleotídeos=1,7kb
•Menor vírus de mamíferos
•Vírus defectivo ou “agente sub-viral satélite”, que requer co-infecção com o HBV para
sua replicação.
•Genoma RNAss -circular, complexado com o Ag Delta (proteína codificada pelo
genoma do HDV)
•Envelope lipídico contém Ag superfície (HBsAg) codificado pelo genoma do HBV
Reservatório: o homem
Modo de transmissão: Semelhante ao da hepatite B
Patogênese
–Mediação por resposta imune
–Existem 2 formas de hepatite D: S e C
–(S) Superinfecção com HBV:
aquisição de hepatite D em portadores crônicos de hepatite B (70-80% versus15-30%
pcts com HBV sozinho)
–(C) Co-infecção com HBV:
Período de incubação:
De 30 a 180 dias; é menor na superinfecção
Período de transmissibilidade:
Uma semana antes do início dos sintomas da infecção conjunta (HDV e HBV);
quando ocorre superinfecção, não se conhece esse período
Diagnóstico:
Marcadores sorológicos para HBV (HBsAg/Anti-HBcIgM/Anti-HBc total)
HDV (HDAg/Anti-HDV IgM/Anti-HDV IgG)
Fatores Clínicos
• Coinfecção
– doença aguda grave
– baixo risco de infecção crônica
• Superinfecção
– infecção crônica freqüente
– alto risco de doença hepática crônica grave
Modos de Transmissão
• Exposição Percutânea
– UDI
• Exposição de mucosas
– contato sexual
Coinfecção VHB - VHD
Marcadores Típicos
• IgM anti-VHD
• anti-HBs
• VHD RNA
• AgHBs
• anti-VHD total
• ALT Elevada
Superinfecção VHB - VHD
Evolução dos marcadores
• ALT
• anti-VHD total
• RNA VHD
• anti-VHD IgM
• AgHBs
Prevenção da Hepatite D
• VHB-VHD Coinfecção
Profilaxia pré ou pós-exposição à infecção VHB
• VHB-VHD Superinfecção
Educação para reduzir o comportamento de risco entre pessoas com infecção crônica
pelo VHB
Vírus da Hepatite E
Descrição:
Doença viral aguda e autolimitada
Curso benigno (gestantes > risco forma fulminante)
Características epidemiológicas:
- Esporádica e surtos
- Áreas sem saneamento básico, instituições fechadas, baixo padrão de higiene
- Inquéritos sorológicos no Brasil: há circulação viral
Agente etiológico:
Vírus da hepatite E (HEV) vírus RNA, família Caliciviridae
• Família Caliciviridae Vírus não-envelopado RNA ss + , 27-32nm, 7,5 kb
• Cultivo fastidioso, detecção com painel de Ac específicos (ELISA)
• Fonte de contaminação fecal-oral: transmissão entérica
HEV
ORF-1:metiltransferase; domínios X, Y; cisteína protease; dobradiça de prolina;
helicase; RNA polimerase-RNA dependente
ORF-2:proteínas estruturais, sítio potencial de glicosilação
ORF-3:sobreposta às ORFs 1 e 2, proteína com função ainda não definida
Reservatório: homem
Relatos recentes de isolamento do HEV em animais = zoonose?
Modo de transmissão:
Fecal-oral
Período de incubação:
De 2 a 9 semanas, média de 6 semanas
Período de transmissibilidade:
Desde 2a sem. antes do início dos sintomas até o final da 2a sem. de doença
Diagnóstico:
-Marcador sorológico anti-HEV IgM
Tratamento:
-Não existe tratamento específico para a forma aguda
Hepatite E - Fatores Clínicos
• Período de incubação:
•
Taxa Casos-fatais:
Média: 40 dias
Variação: 15-60 dias
Em geral: 1%-3%
Gestantes: 15%-25%
•
•
Severidade doença:
Seqüelas crônicas:
Aumenta com a idade
Não identificadas
• Evolução para cura, curso benigno, severidade doença >>>> idade, sem caráter
crônico, mas que causa alta mortalidade (20%) em mulheres grávidas trimestres 2 e 3
(sem explicação) versus fatalidade geral 3%
Evolução dos Marcadores
Vírus nas fezes
ALT
IgM anti-VHE
IgG anti-VHE
Fatores Epidemiológicos
Surtos freqüentes associados com água contaminada com fecalitos
Transmissão pessoa a pessoa mínima
Viajantes para áreas endêmicas de VHE
Casos esporádicos e epidemias (f) consumo de água contaminada por fezes
HEV+.
Ex. India 2 milhões de novos casos/ano
Casos HEV+ em viajantes para áreas endêmicas: beber somente água mineral,
evitar uso de gelo, evitar comer alimentos crus (frutos do mar, vegetais e
frutas)
Brasil: mineiros da região Amazônica, pcts hemodiálise Inst.Infectologia SP,
comunidades rurais e urbanas do município do RJ.
Medidas de Prevenção e Controle para Viajantes em Regiões Endêmicas do VHE
•
•
•
•
Evitar água não potável e bebidas com gelo de pureza desconhecida; mariscos,
frutas e vegetais crus,
Imunoglobulina G não previne infecção
Desconhecida eficácia da IG preparada de doadores de áreas endêmicas
Vacina?
AIDS
SÍNDROME DA IMUNODIFICIÊNCIA ADQUIRIDA
Doença causada por um retrovírus - HIV
Reconhecida em meados de 1981 nos EUA
Número elevado de homens que faziam sexo com homens e moradores de São
Francisco ou Nova York
Sarcoma de Kaposi, pneumonia por Pneumocystis carinii e comprometimento do
sistema imunológico
Nova doença de etiologia provavelmente infecciosa e transmissível
AGENTE ETIOLÓGICO
1983 Isolamento do HIV-1
1986 Isolamento do HIV-2
ORIGEM AFRICANA
98% de similaridade entre HIV e o vírus da imunodeficiência símia (SIV) que infecta
uma subespécie de chimpanzés africanos
HISTÓRIA
Los Angeles 1967-1978: 2 casos Pneumocystis carinii pneumonia
1979 - 5 casos Todos em Homossexual
Com disseminação extra-pulmonar o Pneumocystis carinii tende a produzir
calcificações - Rim
O Sarcoma de Kaposi
Início de 1981 MMWR: 5 casos de Sarcoma de Kaposi
Idosos e Mediterrâneo
1981 - 26 Casos
• Jovens
• Masculino
• San Francisco e New York
•
Todos em homossexuais
HIV e AIDS
Duas doenças raras na comunidade gay ligadas a:
imunossupressão
Infecções oportunistas
Linfoadenopatia
Linfoma de Hodgkin’s
•
•
•
Foi chamada de:
Gay-Related Immune Deficiency
Acquired Immune Deficiency Syndrome (AIDS)
Em comum:
• Jovem
• Branco
• Masculino
• Metrópoles
• Comunidade Homossexual
Mas nem todos os gays tinham a doença
Características Únicas
• Clusters de homens infectados
• Concentrados em grupos sexualmente interativos
• Alto número de parceiros
Sugerem um agente infeccioso
Mais evidências de um agente infeccioso
Outras formas de contrair um síndrome semelhante
Transfusão
Drogas Intravenosas
Hemofilia
Mulheres parceiras Não era apenas da comunidade Gay
Agente Óbvio:
Um vírus……que está no sangue
Rota de transmissão primária: Sexo
AIDS é uma DST causada por vírus
TRANSMISSÃO
Sexual
Uso de drogas injetáveis
Exposição a material biológico de risco
Transfusão de hemoderivados
Vertical
EPIDEMIOLOGIA
• Números dos infectados com HIV correspondem ao dobro dos casos
constatados em 1995
• Na Ásia e no Leste Europeu, cresceram 25 vezes
PROLIFERAÇÃO DO HIV
• América do Norte
– 1,2 milhões de contaminados
– 43 mil novos casos e 18 mil mortes
•
Europa Ocidental
– 720 mil pessoas contaminadas
– 22 mil novos casos e 12 mil mortos
•
Europa e Ásia Oriental
– 1,6 milhões de infectados
– 270 mil casos recentes e 62 mil óbitos
•
Sul e o Sudeste da Ásia
– 7,4 milhões de doentes
– 140 mil novos casos
– 480 mil vítimas fatais
•
Norte da África
– 510 mil doentes
– 67 mil novos casos
– 58 mil falecidos
•
América Latina
– 1,8 milhão de enfermos
– 200 mil óbitos
– 66 mil novos casos
PANDEMIA = EPIDEMIA GENERALIZADA, DE PREVENÇÃO, CONTENÇÃO E CURA
•
África Subsaariana
– 28 milhões de soropositivos
– 3,2 milhões de novos enfermos
– 2,4 milhões de mortes
ACENTUADA ESCALA ASCENDENTE
EPIDEMIOLOGIA
BRASIL
• Primeiro caso de AIDS em 1980
• Até junho de 2005
• 372 mil casos da doença notificados
•
•
Até metade da década de 90
– aumento das taxas de incidência
1998: 18 casos de AIDS por 100 mil habitantes
REGIÕES DO BRASIL
• Total de casos
– >80% nas Regiões Sudeste e Sul
• Sudeste
– Alta taxa de incidência
– A região mais atingida desde o início da epidemia
–
•
Única região com tendência consistente de declínio, ainda que lento,
desde 1998
Demais regiões
– Taxas de incidência tendem a crescer, principalmente nas regiões Norte
(Roraima) e Centro-Oeste
AIDS NO BRASIL SUB-EPIDEMIA
• 19,2 casos / 100 mil habitantes: persistência da tendência de crescimento entre
as mulheres.
• Declínio em <5 anos e no sexo masculino
– Redução das taxas de incidência entre 13 a 29 anos
– Crescimento entre 40 e 59 anos
•
Sexo masculino
– Proporção estável de casos por transmissão homo/bissexual
– Aumento proporcional por transmissão heterossexual
– Redução persistente dos casos em usuários de drogas injetáveis (UDI)
•
Sexo feminino após 1998
– Estabilidade entre 13 a 24 anos
– Crescimento persistente em todas as outras faixas etárias
•
Atingiu intensamente os UDI e os homens que fazem sexo com outros homens
(HSH)
No início dos anos 80: pessoas que receberam transfusão de sangue e
hemoderivados (hemácias, plasma, plaquetas, etc)
600 mil pessoas doentes = 1/3 da América Latina
Prevalência em gestantes: 0,5%
36% dos jovens entre 15 e 24 anos: iniciação sexual antes dos 15.
• 62% sabem como a AIDS é transmitida
• 3/4 dos UDI usam seringas descartáveis
Taxas de mortalidade crescentes até meados dos anos 90
• Estabilidade em 11 mil óbitos anuais desde 1998
• 172 mil óbitos até dezembro de 2004
Após a introdução da política de acesso universal ao tratamento anti-retroviral
(HAART) com coquetel de drogas com diferentes mecanismos de ação
• Queda importante na mortalidade
A partir de 2000: taxa estabilizou em cerca de 6,4 óbitos / 100 mil habitantes,
mais evidente em São Paulo e no Distrito Federal
Crescimento persistente da proporção de óbitos nas categorias de raça / cor
“preta” e “parda” em ambos os sexos entre 1998 e 2004
• Iniqüidade no acesso aos serviços de saúde para diagnóstico e
tratamento precoces das populações menos favorecidas
socioeconomicamente
•
•
•
•
•
•
•
•
NOTIFICAÇÃO OBRIGATÓRIA DOS CASOS DE AIDS DESDE 1986
• Médicos, outros profissionais de saúde, responsáveis por organizações e
estabelecimentos públicos e particulares de saúde
ASPECTOS CELULARES
Perda de um tipo celular
Linfócito CD4+ T4 helper
A diminuição desta célula sempre precede a sintomatologia
Doença avançada: Outra célula é lesada
Linfócito CD8+ citotóxico killer
Sugere novamente um agente infeccioso
Um vírus
Difícil de isolar
O VÍRUS
O vírus só se multiplica em células CD4 que estão proliferando em resposta a um
estímulo – dificuldade de multiplicação in vitro
Detecção de atividade de transcriptase reversa em células CD4
ativadas proveniente de sangue de pacientes com AIDS
• Robert Gallo : HTLV-3
• Luc Montagnier: LAV
Aspectos celulares e imunológicos – O curso da doença
1 – Doença aguda
• Altos títulos virais
• Sintomas leves ou moderados
• Diminuição de CD4 seguido re recuperação
• Aumento de CD8 seguido de recuperação
• Alta concentração viral (mais de 10 milhões de partículas por ml)
• Infecção dos macrófagos
• No caso de transmissão sexual os macrófagos trazem o vírus para a circulação
2 - Uma forte resposta imune
O vírus quase desaparece da circulação
• Boa resposta T citotóxica
• Anticorpos solúveis contra proteínas internas e externas
• Maior parte dos vírus vem de células ativadas (dividindo) e células CD4 recém
infectadas
• A produção de células CD4 supera a perda por lise ou por ação de células CD8
citotóxica
3. Um estado Latente
Latência de Vírus e Sintomas
• Vírus persiste em tecidos extra-vasculares
• Linfonodos e células dendríticas
• Células CD4 de memória (uma população bastante estável de células) mantém
o vírus
4. O começo da doença
Queda massiva de CD4
•
estas células são alvo do vírus
•
As células que estão proliferando em resposta ao vírus são mortas por ele
• As células dendríticas apresentam antígenos e vírus para as células CD4
• A variação de epitopos permite que cada vez mais partículas escapem do
sistema imune
• Apoptose de células CD4
• Pacientes com altos níveis de CD4 não desenvolvem a doença
5. Doença avançada - AIDS
Células CD8+ destroem células CD4+
• A perda de células CD4+ significam que a replicação viral não está mais
controlada
• As células CD4+ caem para menos de 200/mm3 título viral aumenta
rapidamente e o sistema imune sofre um colapso
• queda acentuada de células CD8+
• Infecções oportunistas
• Morte em menos de 2 anos (sem intervenção)
Relação entre número de partículas e evolução da doença
Título viral prediz sobrevivência
Célula CD4 não é um bom indicador da doença
CO-FATORES
Nem todos os casos de KS são ligados a AIDS
Nem todos os pacientes infectados pro HIV tem KS
20% dos homossexuais masculinos HIV+ tem KS
Poucos usuários de drogas intravenosas ou hemofílicos HIV+ tem KS
Kaposi’s sarcoma associated herpes virus
Herpesvírus Humano tipo 8
Três visões da AIDS
1. Gallo: Infecção por HIV é suficiente para causar AIDS
2. Montagnier: HIV pode ser inócuo na ausência de cofatores
3. Duesberg / Mullis: HIV é muito quieto para ser o agente AIDS. É apenas um agente
que está superinfectando o hospedeiro
Até hoje >50% das pessoas infectadas por HIV “evoluíram” para AIDS
Não existe evidência que existe outro agente etiológico envolvido na AIDS
HIV E AIDS
• 10 Bilhões de partículas/dia
• Meia vida 6 horas
• 10 a 100 milhões de partículas/ml
• Minoria das células CD4 estão infectadas
• Vírus nos linfonodos
Vírus HIV
Retrovirus
Membrana (envelope): derivada do hospedeiro
3 genes GAG – POL – ENV
2 glicoproteínas: gp160 gp120 and gp41
gp41 é fusogênica que atravessa o envelope
Açucar: imunoevasor
Antígenos Grupo-específico
p17: superfície interna
p24: nucleocapsídeo
p9: nucleocapsídeo associado com RNA
GAG gene
Enzimas
Estrutura do HIV
Passo 1 Ataque
Passo 2 Uncoating
Passo 3 Transcrição reversa
Passo 4 Integração
Passo 5 Transcrição proviral
Passo 6 Translação
Passo 7 Clivagem
Passo 8 Assemby, Maturation, and Release
Mecanismos propostos de ligação do HIV com células CD4
Ciclo de replicação do HIV
Classificação
Células CD4
(A) Assintomático
forma aguda
PGL
Categorias Clínicas
(B) Sintomático
não A ou C
(C) Condições indicadoras
de AIDS
1) > 500
2) 200 a 499
3) < 200
A1
A2
A3
B1
B2
B3
C1
C2
C3
CATEGORIA B
Angiomatose bacilar
Candidíase orofaríngea
Candidíase vulvo-vaginal ou que responde mal à terapêutica
Displasia cervical moderada ou severa / carcinoma cervical in situ
Sintomas constitucionais
Leucoplasia pilosa
Herpes Zoster (2 episódios ou acometendo mais de 1 dermátomo)
Púrpura trombocitopênica idiopática
Listeriose
Doença inflamatória pélvica
Neuropatia periférica
CATEGORIA C
Sarcoma de Kaposi
Linfoma Burkitt
Linfoma imunoblástico
Mycobacterium avium complex ou M. Kansasii
Mycobacterium tuberculosis de outras espécies
Pneumocystis carinii
Pneumonia recorrente
Leucoencefalopatia multifocal progressiva
Salmonelose recorrente
Toxoplasmose cerebral
Síndrome conseptiva devido HIV
Candidíase de brônquio, traquéia ou pulmão
Candidíase de esôfago
Coccidioidomicose disseminada ou extra-pulmonar
Cryptosporidiose intestinal crônica (> 1 mês de duração)
Citomegalovirose
Encefalopatia do HIV
Herpes simples : úlceras crônicas (> 1 mês de duração) ou pulmonar ou
esofágica
Histoplasmose disseminada ou extra-pulmonar
Isosporíase intestinal crônica (> 1 mês de duração)
Toxoplasmose
DEFINIÇÃO: Doença ou infecção causada pelo T. gondii. O gato é o hospedeiro
definitivo e o homem o intermediário. Como fontes de transmissão temos carne crua
ou malcozida e fezes de gato. A reação para diagnostico, sensível e especifica, é a
reação de Sabin-Feldman.
ETIOLOGIA: Toxoplasma gondii . Existem três tipos, que variam na virulência e
distribuição. Taquizoítos são as formas de multiplicação rápida, sinônimos de
trofozoítos. Se apresentam nos esfregaços em forma de crescente e sua multiplicação
destrói a célula hospedeira, sendo que a conseqüente lesão depende da capacidade
regenerativa dos tecidos. São os responsáveis pela transmissão transplacentária. Os
bradizoítos são as formas de multiplicação lenta. São os responsáveis pela infecção
crônica no cérebro, retina, músculo esquelético e cardíaco. Possuem vacúolo
citoplasmático. Resistentes à digestão péptica e tríptica. Os esporozoítos são
eliminados pelo gato dentro dos oocistos, que contem 2 esporocistos e 8 esporozoítos.
Ciclo biológico: os gatos são hospedeiros completos, nos quais ocorre a reprodução
enteroepitelial e ciclo sexual, assim como o ciclo tecidual de taqui e bradizoítos. Os
humanos e aves são hospedeiros incompletos e nestes ocorre apenas o ciclo tecidual
ou extraintestinal.
EPIDEMIOLOGIA: a maioria das infecções são assintomáticas. Adquire-se a infecção
por: ingestão de oocistos do solo, que são disseminados por vetores; ou ingestão de
cistos em carne crua ou malcozida, sendo que os cistos são mortos por congelamento
ou aquecimento em temperaturas acima de 66ºC; ou transmissão transplacentária.
CLÍNICA
Formas: Febril aguda, Ocular, Linfadenopatia, Sob Imunossupressão, Na Gravidez,
Neonatal.
Febril aguda: assintomática na maioria dos indivíduos; sintomas inespecíficos e
autolimitados. Exantema não pruriginoso, que não envolve palma e planta.
Eventualmente pode acometer pulmão(pneumonia difusa, com tosse seca), fígado
(hepatite decorrente de necrose focal; é discreta e de curta duração), miocárdio
(miosite por destruição pelos taquizoitos e reação de hipersensibilidade após a ruptura
dos cistos) e cérebro (lesões difusas, pleocitose mononuclear e aumento de proteínas
no líquor).
Linfadenite toxoplasmática: linfadenite cervical ou occipital isolada, com gânglios
aumentados e dolorosos. Ocasionalmente ocorre hepatoesplenomegalia e febre.
Toxoplasmose ocular: leva a retinocoroidite, tanto por reativação da infecção
congênita, como pela infecção aguda. Há lesão de dois tipos: aguda e crônica, sendo
que a crônica leva a cegueira e é agravada por uso de corticóides.
Em imunossuprimidos: a forma cerebral é a mais comum, havendo encefalite
multifocal, lesão única, ou mais raramente, difusa. Pleocitose e conteúdo protéico
elevado no liquor.
- Extrema importância na relação com mulheres grávidas e pacientes imunodeprimidos
(infecção oportunista)
- Clínica pleomórfica (não definida)
- Zoonose universal
- Alta infectividade e baixa patogenicidade
- infecção via oral, acidental e transplancentária
► Formas Clínicas
● Toxoplasmose infecção
▪ Sem sintomatologia definida
● Toxoplasmose febril aguda
▪ Septicemia
▪ Geralmente em imunodeprimidos
● Toxoplasmose linfadenética
▪ Forma mais comum
▪ Diagnóstico diferencial com Mononucleose
▪ Sintomas “Mono-like” com aumentos dos linfonôdos universalmente
(com predomínio cervical) e características inflamatórias
▪ Dura, em média, de 2 a 3 semanas
● Toxoplasmose Ocular
▪ Ocorre basicamente na retina
▪ Em geral, é uma re-agudização de uma toxoplasmose congênita
▪ Conduta: medicação e acompanhamento com exame de fundo de olho
● Toxoplasmose na Gravidez
▪ Não há reativação da infecção prévia
▪ Problema está em mulheres soronegativas, pois são susceptíveis à
infecção
▪ Infecção deve ser prevenida (teste mensal) e, se ocorrer, deve ser
rapidamente tratada
▪ Muito importante se ocorrer no primeiro trimestre, pois a maior
chance de gravidade e da ocorrência de mal formações
▪ Tetrade de Sabin: Retardo mental, calcificação intracerebral,
corioretinite e macro/microcefalia
▪ Repercussões diminuem com o tempo de gravidez
● Toxoplasmose no imunodeprimido
▪ Re-ativação de toxoplasmose pregressa
▪ Quase patognomônica de infecção pelo HIV (principalmente a
Neurotoxo)
► Diagnóstico
▪ Sorologia (IgG, IgM de alta avidez e de baixa avidez)
▪ PCR (amplificação do DNA do T. gondii
▪ Isolamento do microrganismo
▪ Pesquisa por anticorpos
▪ Toxoplasmina
▪ Gold-standard: Reação de Sabin-Feldman
► Tratamento
▪ Esquema clássico: sulfadiazina + pirimetomina
▪ Na gravidez: Espiromicina (evita a transmissão para o feto)
▪ Outras drogas: Clindamicina e Co-trimexazol (quando há intolerância
às sulfas)
► Quando Tratar
▪ Imunodeprimidos e grávidas SEMPRE
▪ Imunocompetentes só são tratados se o quadro for muito importante
▪ Deve-se tratar a forma ocular para evitar repercussões
▪ Profilaxia nas mulheres grávidas com sorologia negativa e em
pacientes imunodeprimidos
Toxoplasmose
- Na maioria dos casos é assintomática
- Agente causador: Toxoplasma gondii
- Três formas evolutivas: taquizoítos, cistos com bradizoítos e oocistos
- Ciclo intracelular obrigatório (encontrado em qualquer célula do corpo, exceto nas
hemácias – garante grande disseminação e prevalência)
depende dos hábitos, costumes e condições
climáticas
- Grande importância em imunodeprimidos
● Taquizoíto
▪ Forma de multiplicação rápida
▪ Não resistente ao pH estomacal
▪ Encontrado em diversos tipos celulares (fígado, pulmões, ...)
▪ Desenvolve a forma mais grave da doença
▪ Relacionado com a trasmissão congênita
● Bradizoíto
▪ Estágio de multiplicação lenta
▪ Relacionado com a fase crônica da doença
▪ Encontrado no tecido muscular (esquelético e cardíaco), nervoso e da
retina
► Ciclo evolutivo
▪ Fase assexuada (tem como HI aves, mamíferos e o homem)
▪ Fase sexuada (ocorre nos HD – gatos domésticos e felídeos silvestres)
Fase Sexuada
na célula intestinal
oocistos
Origina oocistos com
4 esporozoítos
Liberação
no solo
Entrada na célula
Disseminação
Taquizoítos
Reprodução
(bradzoítos)
Ingestão ou
inalação dos
Esporozoítos
Liberados
Liberação
► Transmissão
▪ Mecanismos variados facilitam a disseminação
▪ Congênita (rompimento do cisto no endométrio ou taquizoítos livres no
líquido amniótico)
▪ Ingestão de carne crua com bradizoítos
▪ Acidentes de laboratório
▪ Leite, saliva e esperma (taquizoitos)
▪ Transplantes de órgãos
Na gravidez é um grande problema
▪ Infecção aguda
▪ Transmissão congênita
▪ Nos primeiros meses de gravidez a infecção é mais grave e a
possibilidade de transmissão é menor
► Interação Parasito-Hospedeiro
▪ Morfologicamente, taquizoítos e bradizoítos são semelhantes, mas
antigenicamente não o são (as proteínas de superfície são estágio-específicas)
▫ Taquizoítos: SAG 1 (p30)
▫ Bradizoítos: SAG 3 (p43) e SAG2C
Relacionadas com
adesão e invasão
▪ Alguns fatores levam a transformação das formas
▫ Taquizoítos Bradizoítos: variação do pH, inibição mitocondrial e presença de NO
▫ Bradizoítos Taquizoítos: falta de NO, de Interferon gama, de TNF alfa, de IL-12 e
de T cel
► Resposta Imune
▪ Celular: mais influente na fase crônica
▪ Humoral: mais influente na fase aguda
▪ IgG: na fase aguda, é de baixa avidez e nas demais é de alta avidez
▪ IgM: não é um bom marcador de fase – a IgM de persistência pode ou não
ocorrer
▪ Bons Marcadores: IgG de baixa avidez marca a fase aguda
IgG de alta avidez marca a fase crônica
IgA- infecção oral, bom pra ver infecção neonatal tb.
▪ Imunidade Celular
Macrófago
IL-12
Produz
TNF α
Linf. T CD8+
Linf. T CD4+
Células NK
IFN γ
TNF
Morte
do Parasito
▪ Hipersensibilidade tardia: reação intradérmica, semelhante à tuberculina
► Patogenia
▪ Depende da cepa (carga e virulência), do sistema imune do indivíduo e do
modo de infecção
▪ Infecção congênita: forma mais grave (causada pelo taquizoíto)
▪ Imunocomprometidos (HIV+ e Transplantes): aumento da incidência da
infecção
▪ As linhagens clonais I e II são mais freqüentes em humanos (podem ocorrer
simultaneamente)
▫ Linhagem I: lesões oculares graves e resistência ao tratamento
▫ Linhagem II: mais prevalente em pacientes com AIDS
▫ Linhagem I e II: infecções congênitas
► Testes Diagnósticos
● Sorológicos
▪ Sabin-Feldman é o padrão-ouro
▪ Triagem: HAI (hemoaglutinação indireta)
RIFI (imunofluorescência)
▪ Confirmação: ELISA
ISAGA (hemoaglutinação)
● Métodos diretos (mais utilizados em pesquisas)
▪ PCR / Sondas (biologia molecular)
▪ Cultivo de células
▪ Inoculação em animais
► Perfis Sorológicos
● Mulheres Grávidas
IgG+ e IgMIgG+ e IgM+
IgG- e IgG-
infecção pregressa
infecção aguda (ver se a
IgM é de persistência)
Susceptibilidade
Ausência de risco
Tratar?
Acompanhamento
● Feto
▪ Entre 20ª e 22ª semana: coleta e pesquisa de Ac (IgA, IgG e IgM); PCR
▪ Falsos positivos: contaminação com sg materno (IgM+ em 20 e 30%)
▪ É possível detectar marcadores (plaquetopenia, aumento do IgM total)
▪ Coriocentese: risco elevado
▪ Amniocentese: alto risco de morte pelo método (0,2 a 2%)
PCR (p30, B1 e rDNA): sensibilidade de até 100%
● Neonatos
▪ Elisa: alta sensibilidade
▪ Possibilidade de transmissão passiva (pesquisar novamente após 6
meses)
▪ Pesquisa de IgM: indicativo de infecção congênita
cuidado com contaminações pelo sangue materno
é de baixa sensibilidade
▪ IgA: principal marcador sérico
pode haver contaminação com IgA materno transplacentário
▪ Retestagem em 2 a 3 semanas
● AIDS
▪ Resultados negativos não indicam que não há infecção
▪ Marcadores: IgG e IgM
▪ Envolvimento pulmonar PCR e cultivo do lavado brônquico
▪ Pode haver neurotoxoplasmose (CD4 < 200 e aumento de IgG, E, M e
A)
▪ Pesquisar Ig no LCR
● Transplantados
▪ Biópsia do órgão Imunohistoquímica e PCR
Doador
IgG+ e IgMIgG- e IgMIgG- e IgM-
Receptor
IgG- e IgMIgG+ e IgMIgG- e IgM-
Risco de Transmissão
Risco de Reativação
Ausência de Risco
Malária
CONCEITO
Doença infecciosa, não contagiosa, crônica, com manifestações episódicas agudas,
prevalente em áreas tropicais e subtropicais.
ETIOLOGIA
Os agentes etiológicos são transmitidos aos humanos por mosquitos do gênero
Anopheles e são os seguintes:
Plasmodium vivax: mais amplamente distribuído. Plasmodium falciparum: causa maior
morbimortalidade, resistente a cloroquina e outras drogas. Plasmodium ovale.
Plasmodium malariae.
CICLO EVOLUTIVO
A forma infectante inicial é o esporozoíta, transmitido através da saliva do mosquito.
No sangue circulante ficam envoltos das proteínas circunsporozoítas (alvo de possíveis
vacinas antimaláricas). Alguns são destruídos pelos macrófagos porem outros passam
a se reproduzir por ESQUIZOGONIA no interior dos hepatócitos e formam o
esquizonte tecidual primário.
O esquizonte se rompe e liberta MEROZOÍTOS nos sinusóides hepáticos. Estes irão
para a circulação, onde infectarão eritrócitos; pra que essa infecção ocorra é
necessário que hajam receptores nos eritrócitos, como a glicoforina A para o P.
falciparum e o fator Duff para o P. vivax. Após a liberação dos merozoítos, nos P. vivax
e ovale, algumas formas, os hipnozoítos, permanecem no fígado, sendo responsáveis
por recidivas tardias da doença. Os p. malariae e falciparum recidivam por permanecer
formas eritrocíticas na circulação microcapilar tecidual.
No interior do eritrócito, o merozoíto se torna trofozoíto, o qual sofre esquizogonia e
se torna o esquizonte hemático, a partir do qual se originam os merozoítos hemáticos.
O eritrócito se rompe, libera os merozoítos que irão infectar outras hemácias. Na fase
de esquizogonia eritrocítica há metabolização da hemoglobina em hemozoína.
A periodicidade da esquizogonia varia: de 48h para P. vivax e P. ovale; 72h para P.
malarie e 36 a 48h para o P. falciparum.
Três a dez dias após o início da sintomatologia, os parasitas se diferenciam em
gametócitos. Estes amadurecem e quando a fêmea do Anopheles faz o repasto
sanguíneo ela retira os gametócitos que irão se reproduzir no estômago do inseto,
onde ocorre a fecundação e formação do oocineto. Este atravessa a parede do
estômago e se torna o oocisto. O oocisto sofre esporogonia, se rompe e libera os
esporozoítos. Estes migram para as glândulas salivares do inseto, que se torna
infectante.
Outras formas de transmissão são a transplacentária ou congênita, (que ocorre em
filhos de mães infectadas não imunes), por acidentes de laboratório,
compartilhamento de seringas e transfusional.
EPIDEMIOLOGIA
Grande subnotificação. Abrange áreas de população instável, com precárias condições
de habitação e trabalho. Pessoas de maior risco de falecer pela doença são crianças
menores de 5 anos, gestantes e pessoas primoinfectadas,além de pessoas de áreas
não endêmicas, sem imunidade adquirida, como trabalhadores, garimpeiros ou os que
tenham viajado a lazer. A gravidade aumenta por estarem em áreas onde diagnóstico e
tratamento não são suficientemente disponíveis. No Brasil, a malária incide na região
amazônica, e as espécies predominantes são P. vivax e falciparum e não há casos
autóctones de P. ovale.
Na transmissão estão envolvidos fatores biológicos, ambientais(temperatura –entre 20
e 30ºC-, umidade do ar-60%, aumenta logevi//do vetor-, altitude-até900m-, cobertura
vegetal-mata-, índice pluviométrico-aumenta umidade do ar e formação de coleções
de água.), socioeconômicos(hábitos, condições de vida, moradia e trabalho), culturais.
Dentre os hábitos, estão construções provisórias, sem paredes, e próximas a coleções
hídricas e áreas de mata; manter grande superfície corporal descoberta.
As fontes de infecção são pessoas doentes e portadoras, mas raramente macacos e
chimpanzés podem ser fontes de infecção .
O P. vivax é o mais disperso e produz a febre terça benigna. O P. falciparum produz a
febre terçã maligna. O P. malarie tem incidência mais baixa e produz a febre quartã.
Para que uma espécie de Anopheles seja vetora, são necessários alguns fatores, como:
susceptibili// a infecção por plasmódios humanos; antropofilia (preferência por sangue
humano); endofilia (presença no interior das habitações); endofagia; longevi// e
densi//. Os vetores se reproduzem em regiões com coleções de água limpa, quente,
sombreada, de baixo fluxo. Outras espécies se reproduzem em regiões litorâneas de
água salobra e em folhas de plantas bromeliáceas.
A susceptibilidade humana é universal, mas alguns fatores influenciam a resposta
imune. A falta do Ag Duff, reduz a infecção por P. vivax; a hemoglobina S, dos
portadores de anemia falciforme, reduz gravidade da infecção pelo P. falciparum. A 6glicose-fosfato-desidrogenase tem efeito protetor na infecção por P. falciparum.
Malária estável existe em regiões com alta incidência e confere altos índices de imuni//
adquirida. Malária instável ocorre em regiões com incidência variável e confere baixa
imuni//.
A classificação das áreas maláricas são: Sem risco (incidência zero), baixo risco
(incidência de 0,1 a 9 por 1000 hab), médio risco (incidência de 10 a 49 por 1000hab) e
alto risco (incidência de acima de 50 casos por 1000 hab).
PATOLOGIA
SNC: Acometido apenas por P. falciparum Edema encefálico e tecido cerebral de
coloração azulada por depósito de hemozoína. Sequestração microvascular de
hemácias (as hemácias estão aderidas ao endotélio ou formando agregados com
células não parasitadas) leva a obstrução de vasos e alteração da circulação cerebral. A
seqüestração é importante para o parasito pois mantém mais hemácias fora da
circulação geral e impede a destruição destas, e por conseguinte dos parasitos, no
baço. Há maior seqüestração e hemorragias no cerebelo que no cérebro, pois neste o
grau de vascularização é menor.
Pulmões: Em malaria por falciparum, ocorre edema pulmonar grave, formação de
membranas hialinas, hemorragia intralveolar e infecção bacteriana secundária.
Fígado: lesões mínimas produzidas por ruptura de hepatócitos infectados. Na malaria
aguda há hepatomegalia e coloração cinza-escura, hiperplasia e hipertrofia das células
de Kupffer. Na malaria grave por P. falciparum há necrose centrolobular e na malaria
crônica há fibrose discreta. A malária não causa cirrose, que é prevalente em áreas
endêmicas por condições ambientais (má nutrição, fatores tóxicos, e hepatite viral).
Baço: malaria aguda: aumentado, amolecido, sujeito a ruptura. Malária crônica:
endurecido, lenhoso, com fibrose. A esplenomegalia ocorre por hiperplasia e
hipertrofia do SRE.
Medula óssea: aguda: hiperemia, hemácias parasitadas; crônica: hipercelularidade
devido hiperesplenismo; por P. falciparum: depleção dos granulócitos.
Placenta: aborto e parto prematuros, devido seqüestração de hemácias na placenta.
TGI: mucosa congesta, por seqüestração de hemácias nos pequenos vasos sanguíneos.
Rim: é lesado por P. falciparum e malarie. Pelo primeiro, as alterações mais
freqüentes são tubulares e de intensidade variável, decorrentes de isquemia. Lesões
glomerulares podem ocorrer por depósitos de imunocomplexos e são benignas e
reversíveis com a cura da doença. Na malária por P. malarie crônica, há lesões
glomerulares proliferativas por depósitos de imunocomplexos em mesângio e
membrana basal e sua expressão clínica é de Sme nefrótica, PP/ em crianças.
QUADRO CLÍNICO
Depende do tipo de plasmódio e da imunidade do hospedeiro.
P. vivax: PI de 12 a 16 dias. Baixa parasitemia, apenas em reticulócitos. A princípio, há
duas gerações infectantes, que amadurecem em dias alternados e levam a febre diária.
Uma das gerações de parasitas declina e a febre passa a ser a cada 48h.
Acesso malárico: intensos calafrios, de curta duração, seguidos de febre de 4 a 8h. em
seguida há sudorese, por horas. Outros sintomas são palidez, icterícia, HEmegalia,
cefaléia, náuseas e vômitos. Como complicação pode haver ruptura esplênica, coma
malárico por acometimento cerebral, edema agudo de pulmão e trombocitopenia.
Esse é o Ataque primário e os parasitos desaparecem natural ou terapeutica/; As
recidivas ocorrem meses depois e se devem a permanência dos hipnozoítos no fígado.
Na recidiva, a anemia e a esplenomegalia são mais intensas. . A atividade destes se
extingue de maneira natural após cerca de 4 anos. Tratamento radical impede
recidivas periódicas neste período.
P. faciparum: PI de 8 a 12 dias. Alta parasitemia, em todas as hemácias, independente
da idade. Favorece aglutinação de hemácias, trombose e isquemia tissular. Pacientes
com infecção pregressa por vivax desenvolvem quadro menos grave. Os sintomas são
semelhantes a descrição anterior(febre, calafrios, sudorese, náuseas, vômitos, cefaléia,
icterícia, palidez, HEmegalia, podendo haver torpor, hipotensão, hemorragias e
oligúria). Existem oito modalidades de formas graves:
Malaria cerebral : sintomas não específicos, como cefaléia, desorientação, delírios,
convulsões e coma.Hiperreflexia, babinsky bilateral, líquor com hiperproteinorraquia.
Ocorre aumento da PIC, edema intersticial leve. Ocorrem hemorragias retinianas.
Malária pulmonar: é associada a hiperparasitemia, insuf. Renal, gravidez e reposição
excessiva de líquidos.a resposta terapêutica é pobre e a letalidade é elevada.
Forma biliosa remitente: icterícia originada de hepatite malárica com necrose
centrolobular. Não ocorre insuf. Hepática.
Coagulação intravascular disseminada: ocorre por ativação da cascata de
complemento, não é importante causa de morte em região endêmica. Também
ocorre hemorragias por redução da produção de fatores da coagulação pelo fígado.
Hipoglicemia: em grávidas, crianças e doentes graves, com malária cerebral. Alta
demanda de glicose (devido febre e manutenção da parasitemia); falência na
gliconeogênese e na glicogenólise; hiperinsulinemia(devido quinino e para
desenvolvimento dos plasmódios).
Septicemia: é freqüente infecção bacteriana secundária, com focos provenientes de
pulmão e trato urinário.
P. malariae (febre quartã): PI de 30 a 40 dias. Acessos febris a cada 72h,
esplenomegalia freqüente, parasitemia baixa e persistente, com infecção crônica
patente ou subpatente. A complicação mais grave é a síndrome nefrótica em crianças
que tem mau prognóstico e baixa resposta a corticoterapia, diferente/da nefropatia
por lesões mínimas.
P .ovale (febre terçã): Restrita a África, infecção benigna de cura espontânea e com
indução de imunidade.
Malária Crônica: ataques repetidos. Por vivax e malariae. Ocorrem fadiga, febre
intermitente, leve icterícia, hepatoesplenomegalia, anemia intensa.
Síndrome da esplenomegalia tropical(Sme da Malária Hiperrativa): Associada a
malária, se caracteriza por: hipergamaglobulinemia, hiperesplenismo, esplenomegalia,
anticorpos antiplasmodio, melhora dos sintomas após terapêutica antimalaria. Só
ocorre em zona endêmica para malaria, é se trata de resposta imune anormal a
malária recorrente determinada geneticamente.
DIAGNÓSTICO LABORATORIAL
Encontro dos plasmódios, por esfregaços comuns ou gota espessa, no numero mínimo
de dez plasmódios por mm³ de sangue. Testes sorológicos podem ser usados, como
imunofluorescência indireta, Elisa, radioimunoensaio, hemaglutinação.
Hemograma: anemia, leucopenia e plaquetopenia, sendo a esta comum nas formas
perniciosas da doença.
Bilirrubinemia: aumento por hemólise da fração indireta; em casos graves, com
comprometimento hepática haverá aumento da fração conjugada.
Aminotransferase: aumento discreto em formas graves causadas por falciparum.
Coagulação: há diminuição da síntese hepática de fatores da coagulação e coagulação
intravascular disseminada, com consumo destes fatores. Esses fatores somados a
plaquetopenia, levam a diminuição do tempo de protrombina.
Uréia e creatinina: na fase inical da doença, se elevam por desidratação, sudorese e
vômitos. Na doença grave, há aumento devido necrose tubular aguda.
DIAGNÓSTICO DIFERENCIAL
Malária aguda: inluenzae.
Período de estado: leishmaniose visceral, febre tifóide, D. de chagas, toxoplasmose, TB
miliar, arboviroses, endocardite e brucelose.
Forma ictérica: hepatites virais, colangites, septicemias, leptospirose, febre amarela.
Forma crônica: calazar, dooença linfoproliferativa, anemia hemolítica, hepatopatia
crônica, trombose da veia porta, hipertensão portal idiopática.
- 500 mil casos/ano no Brasil – concentrados na região amazônica (99,3% deles), com
picos em Junho e Julho
- O número de óbitos pela doença vem caindo anualmente
- Fora da Amazônia:
• 46% dos casos ocorrem na região sudeste (migração + viagens)
• 24% ocorrem na região sul
• 17% ocorrem na região nordeste
• 13% ocorrem na região cento-oeste
- Casos autóctones fora da Amazônia:
• 41,6% ocorrem no Espírito Santo
• 42,9% ocorrem no Piauí
► O Parasito
▪ Gênero Plasmodium
▪ Espécies: P. malariae, P. vivax, P. falciparum e P. ovale
▪ Habitat: no homem é a corrente sanguínea, os hepatócitos e os eritrócitos
no vetor (fêmea do Anopheles) é a matriz peritrófica, o epitélio médio,
a hemolinfa e as glândulas salivares.
▪ Transmissão: hematofagia, tranfusão sanguínea, compartilhamento de
agulhas, acidentes de laboratório e congênita
▫ Para haver a transmissão, deve haver gametócitos do parasito
circulando na corrente sanguínea do hospedeiro (o P. falciparum é o que menos possui
essa forma no sangue)
▪ Formas do parasito: trofozoítos, esquizontes e gametócitos
▫ o P. vivax e o P.ovale possuem também os hipnozoítos – forma
hepática latente que permitem recidivas da doença
▫ P. falciparum possui alta taxa de esporozoítos por esquizonte tecidual
(é um dos motivos para a maior gravidade da doença causada por ele)
▪ Pigmento malárico: oriundo do metabolismo da hemoglobina, permite a
diferenciação da espécie de plasmódio que está parasitando o hospedeiro
▪ Metabolismo da hemoglobina: Hemozoína (responsável pela ativação do SI)
Ferriprotoporfirina, metemoglobina, entre outros
▪ Primaquina: droga que elimina as formas hepáticas e teciduais
É teratogênica nas mulheres grávidas, o tratamento é
sintomático (eliminação das formas sanguíneas) até o final da amamentação
► Interação Parasito-Hospedeiro
▪ Merozoíto: anel polar, micronema, roptrias e microtúbulos Invasão
eritrocítica
região apical Adesão celular
▪ Motilidade (reorientação de proteínas): CSP- (Circunsporozoítica) e a proteína
adesiva TRAP (Trombospondina)
▪ Invasão dos hepatócitos: região II da CSP(motilidade e reorientação das
proteínas)
▪ A entrada do parasito no eritrócito está intimamente relacionada com os
grupos sanguíneos do
hospedeiro heparan-sulfato dos hepatócitos
proteoglicanos
→ Sistema Duffy (relacionado com o P. vivax)
- É determinado por dois antígenos (Fya e Fyb)
- Diferença entre os antígenos é uma única substituição de
GlyAsp no aminoácido 42 da proteína
- Indivíduos que não expressam Fy não pegariam malária do P.
vivax, pois este é o principal meio de entrada para o parasito (há pouquíssimos
casos registrados)
→ Sistema MNSs (relacionado com o P. Falciparum)
- Glicoforinas expressas na membrana dos eritrócitos e suas
variações podem comprometer a entrada do parasito na célula.
- Glicoforina A: indivíduo é fracamente infectado (qm nao
expressa A)
- Glicoforina B: Indivíduos SS são mais susceptíveis e os ss são
menos susceptíveis à doença
- Glicoforina E: resistentes
Portando o grupo MNS codifica proteínas de membrana que facilitam a entrada
do falciparum na célula!
→ Sistema ABO (relacionado com o P. falciparum)
- Não tem papel de receptor (não está ligado à susceptibilidade)
- Seu papel é ligado à formação de rosetas, ligadas à malária
grave
- Tipo A: Grande quantidade de rosetas eritrocitárias Aumento
freqüência de malária grave
- Tipo O: Não favorece a formação de rosetas Aumento da
resistência (esse tipo sanguíneo é muito freqüente nas populações indígenas da
Amazônia)- seleção natural!
da
proteínas de superfície relacionadas com a entrada do merozoíto no
eritrócito: AMA 1, MSP1 GRA 175
► Resposta Imune
▪ Anticorpos só aparecem após várias infecções e desaparecem na ausência do
parasito (não há memória imunológica)
▪ Negativação (eliminação) parasitária
▪ Regulação efetiva da resposta inflamatória
▪ Desenvolvimento de Acs para várias cepas
Fase
Resposta
Esporozoíto
Intra-hepática
Anticorpos agem na CSP (bloqueio da motilidade para a
invasão)
Liberação de IL 6, IL1 TNF-alfa IFN-gama + IL2 ativam NK, TCD8
e macrófagos( aumenta a produção de NO para matar o
parasito no macrófago)
IL12 (apresentação de antígenos) resposta Th1(Linfócitos T
CD4+ e Linfócitos T CD8+)
IL6, IL1 TNF alfa IFN gama (aumenta temp corporal=tremores)
que agem na agregação de NK, monócitos e glanilócitos.
Eritrocítica
Formas Sexuadas
(IL4--> Th2-> resposta imune humoral)
Anticorpos neutralizantes e aglutinantes
Anticorpos opsonizantes (potencializam a fagocitose)
Anticorpos citofílicos IgG1 e IgG3 (inibição do crescimento)
PF48/45 (linfócitos citotóxicos e anticorpos)
▪ Resposta Imune Adquirida (RN protegido do P. falciparum até o 6° mês)
▫ Transferência materna de IgG
▫ Eritrócito rico em Hb Fetal
▫ Dieta pobre em Ácido paraminobenzóico (PABA)
▪ Citocinas na Malária
▫ Fagocitose e produção de radicais livres e NO (TNFα e IFNγ)
▫ Processamento e apresentação (IL-12)
▫ Resposta humoral (IL-4)
▫ Citotoxicidade (NK, CD8+ e NKT)
▫ Imunorregulação (TGFβ e IL-10)
▫ Febre: TNFα, IL-6 e IL-10
▫ Hiperparasitemia: IL-1β, IL-12 e IL-10
▫ Indução, pela GPI, de citocinas pró-inflamatórias: TNFα, IL-1 e IL-6
► Fisiopatologia
● Destruição dos etritrócitos parasitados
▪ A anemia, na maioria dos casos, não se correlaciona com a parasitemia
▪ Destruição, pelo sistema imune, de eritrócitos não parasitados
▪ Auto-anticorpos com afinidade tanto para o parasito quanto para o
hospedeiro (eritrócito)
▪ Disfunção da medula óssea, estimulada pela ação de citocinas(diminiu
da hematogênise)
● Toxicidade resultante da liberação de citocinas
▪ Produtos do parasito Monócito e macrófagos
▪ GPI e Hemozoína TNF, IL-1, IL-6 e IL-8 Mal estar e febre
▪ TNFα (Pior prognóstico de malária vivax e falciparum) Endotélio
Moléculas de citoaderência Extravasamento de líquidos
▪ Citocinas Inibição da gliconeogênse Hipoglicemia
▪ Citocinas NO Inibição da função celular
● Seqüestro dos eritrócitos parasitados na rede
▪ P. falciparum PfEMP KNOBS Citoaderência
▪ Proteínas do hospedeiro
▫ CD36 (endotélio dos vasos de diferentes órgãos)
▫ ICAM 1 (Cérebro)
▫ Selectina-E
▫ VCAM 1
▫ PECAM 1 / CD31
Levam a obstrução dos vasos,
▫ CSA (vasos placentários)
principalmente na susbtância
▪ Eritrócitos parasitados e não parasitados Rosetas branca do cérebro, no coração,
no fígado, nos rins e no
interstino
III)
Resultam em anóxia,
Insuficiência
Renal,
● Lesão capilar por deposição
de imunocomplexos
(hipersensibilidade do tipo
Hepatite e hemorragias
▪ Deposição nos glomérulos levam a Glomerulonefrite (transitória ou
permanente) e Síndrome Nefrótica
► Conseqüências da Fisiopatologia da Malária Falciparum
▪ Hemácias parasitadas aderidas ao endotélio e aquelas formando rosetas
resultariam na obstrução de pequenos vasos, com conseqüente hipóxia tecidual
▪ O papel deletério de citocinas pró-inflamatórias, cuja produção seria
estimulada por moléculas do parasito liberadas localmente, ao final da esquizogonia
eritrocitária
► Diagnóstico da Malária
▪ O tratamento adequado é diferente para cada tipo de malária
▪ Diagnóstico clínico: procedência, viagens, tempo de permanência em áreas
endêmicas
▪ Diagnóstico diferencial: Doenças febris, quadros de hepatoesplenomegalia,
icterícia e colúria
▫ Hepatites virais, leptospirose, febre tifóide, febre amarela, septicemias
▪ Diagnóstico laboratorial
▫ Exames específicos
- Gota espessa
- Detecção do plasmódio em hemácias
- Detecção de componentes
- Detecção de anticorpos antiplasmodiais
- Corantes fluorescentes (ex: QBC)
- Detecção de hemozoína
- Testes imunocromatográficos (detectam histidina ou lactato
desidrogenase – não avaliam a parasitemia)
Gota espessa: detecta a espécie do plasmódio
se houver baixa parasitemia, pode dar falsos negativos
nas formas mistas da doença, pode ser difícil a detecção da espécie
▫ Exames inespecíficos
- Hemograma e Urina I
- Glicemia
- Função renal e bilirrubinas
- Coagulograma
▪ Diagnóstico sorológico
▫ Aglutinação direta, Western Blotting, Imunoenzimático.......
▫ Não são ferramentas diagnósticas úteis
▫ Em áreas endêmicas:
- Verificar a presença de transmissão da doença
- Delinear áreas malarígenas
- Medir o nível de endemicidade
- Avaliar a reintrodução de novos casos
- Avaliar programas anti-maláricos
▫ Em áreas não-endêmicas:
- Seleção de doadores de sangue
- Complemento do diagnóstico
Finalidade
Diagnóstico individual
Seleção de doadores de
Sangue
Acompanhamento
Terapêutico
Áreas Endêmicas
Áreas Não-Endêmicas
Gota Espessa + Esfregaço, QBC ou
PRC/Imunocromatográficos em locais com diagnóstico
difícil
QBC ou PCR
ELISA e confirmação com
QBC ou PCR
GE, QBC ou PCR
Malária
- Sinonímia: impaludismo, maleita, terçã, quartã, sezão, febre dos pântanos, febre
intermitente.......
- Doença infecciosa não contagiosa, de evolução crônica, mas com manifestações
agudas.
- Áreas endêmicas abrangem mais de 100 países (maior incidência na Ásia, América
Latina e Caribe, com relação estreita com condições precárias de habitação e de
trabalho)
- 42% da população mundial vive em áreas endêmicas onde há risco de transmissão
- No Brasil: maior incidência na bacia do Amazonas (99,7% dos casos)
Não é distribuída homogeneamente (altera-se com a mobilidade da
população)
► Transmissão
▪ Resultado da interação de fatores de natureza biológica, ambiental, sócioeconômica e cultural
▪ Elementos primários: parasito, vetor e homem
▪ influencias do meio ambiente (temperatura, índice pluviométrico, umidade
relativa do ar, altitude e cobertura vegetal), hábitos, condição de vida, moradia e
trabalho das populações
▪ Transmissão acidental: transfusão sanguínea, contato involuntário
(laboratórios), compartilhamento de agulhas e seringa
▪ A transmissão congênita ou perinatal é possível quando há mistura de sangue
materno com o sangue fetal
► Vetor
▪ Anopheles
▪ No Brasil, há 13 espécies naturalmente infectadas sendo as principais as
seguintes: A. darlingi, aquasalis, cruzii, bellator e oswaldoi
► Agente
▪ Protozoário: Plasmodium ssp (P. vivax, P. falciparum, P. ovale e P. malariae)
▪ P. vivax: é o que causa mais malária
▪ P. falciparum: causa maior morbi-mortalidade
▪ P. malariae: pouco freqüente no Brasil e morfologicamente parecido com o
vivax
▪ P. ovale: exclusivo da África
▪ Ciclo heteroxênico, sendo que a fase assexuada ocorre no hospedeiro humano
▫ Esporozoíto: forma que infecta o homem
▫ Ciclo hepático: formação do esquizonte, que se transforma em
trofozoíto
▫ Hipnozoíto: forma hepática latente do P. vivax
▫ Trofozoíto: Pode se diferenciar e, gametócito ou voltar a forma
esquizonte, que infectará outras hemácias
▫ Ao romper as hemácias: FEBRE
▪ Período pré-patente: intervalo da infecção até a parasitemia
▪ Período sub-patente: baixa parasitemia
▪ Período patente: parasitemia detectável
► Imunidade
▪ Fundamental para o desenvolvimento do quadro clínico
▪ Complexa: Resposta humoral ativação policlonal (IgG, IgA e IgM)
Resporta celular redução de Linfócitos T
▪ Alvos da resposta imune: esporozoítos e merozoítos
▪ Evolução intra-celular: protege dos mecanismos efetores de defesa
▪ Estágio do desenvolvimento: espécie específica e estágio específica
▪ Premunição: imunidade incompleta em indivíduos de área endêmica
(paciente assintomática com número reduzido de parasitos circulantes)
▫ Fora da área endêmica, perde-se a imunidade em até 6 meses
▪ RN: Anticorpos maternos até um ano de idade (área endêmica e mães
infectadas)
▪ A doença é um co-fator para sarampo e diarréias, o que aumenta a gravidade
do quadro e aumenta a mortalidade
▪ Imunidade do hospedeiro e virulência da cepa afetam a resposta. Idade,
gestação, grau de transmissão do local e ser primo ou reinfecção também influenciam
na resposta.
▪ Resposta imune eficiente: ataques mais leves e esparsos
▪ Persistência da parasitemia:
▫ Recrudescência em 1 mês a 2 anos P. falciparum
▫ Recrudescência em 3 anos a 50 anos P. malariae
▫ Recrudescência em 6 meses a 5 anos P. vivax e P. ovale
▪ Mecanismos de imunidade antimalária:
▫ Fagocitose
▫ Linfócitos B e anticorpos
▫ Linfócitos T (citotoxicidade e ativação de macrófagos)
▫ Linfócitos NK (citotoxicidade para os plasmódios e eritrócitos
parasitados)
▫ Citocinas (influem no desenvolvimento do plasmódio)
▪ Fatores genéticos de resistência ao plasmódio:
▫ Talassemias (α e β); HbS; HbE; HbC; HbF Resistência ao PF
▫ Deficiência da G-6-PD Redução do crescimento do PF
▫ Ovalocitose Proteção contra a malária cerebral
▫ Eritrócitos Duffy negativos Resistência ao PV
▪ Estratégias de sobrevivência do Plasmodium no hospedeiro humano
▫ Diversidade antigênica
▫ Mimetismo molecular
▫ Indução de imunodepressão – desregulação do SI através da
hiperativação
Intenso
Estímulo
Antigênico
Hiperativação
do
Sistema Imune
Anemia, Insuf.
Renal,
Comprometimento
cerebral e pulmonar
▪ Anemia Progressiva
▫ Hemólise de hemácias parasitadas
▫ Hemólise de hemácias não parasitadas (hipersensibilidade)
▫ Hiperfagocitose de hemácias, parasitadas ou não, pelo sistema
linfocítico-monocítico
▫ Mecanismos da anemia:
- Aumento da destruição das hemácias
- Alterações na eritropoiese
- Alterações no pool circulante
▪ Acometimento cerebral, secundário à:
▫ Seqüestro dos eritrócitos parasitados na microcirculação
▫ Produção aumentada de interleucinas pro-inflamatórias
▫ Aumento da expressão de moléculas de aderência no endotélio das
vênulas pós-capilares
▫ Produção aumentada de radicais de oxigênio e NO
▫ Acidose metabólica
▪ Acometimento renal:
▫ Glomerulopatia mediada por imunocomplexo nas infecções causadas
por P. malariae e, menos freqüentemente, nas causadas por P. vivax
▫ Necrose tubular aguda causada por alterações hemodinâmicas
decorrentes de elevado parasitismo eritrocitário mais freqüente nas infecções pelo
P. falciparum
▫ Nefrite intersticial aguda e glomerulonefrite proliferativa aguda
► Patologia (Malária Falciparum)
Síndrome da
Resposta
Inflamatória
Sistêmica
▪ SNC: edema encefálico e hemorragias petequiais
▪ Rins glomerulonefrite e necrose tubular aguda
▪ Pulmões: edema pulmonar
▪ Fígado: impregnação por hemozoína, hiperplasia/hipertrofia das células de
Kupffer, necrose centrolobular e fibrose
▪ Baço: aumento do volume com risco de ruptura
▪ Medula óssea: hiperemiada e com hiperplasia retículo-endotelial; acentuada
hiperplasia normo ou megaloblástica, mesmo na ausência de reticulocitose periférica
▪ Miocárdio: miocardite leve
▪ TGI: mucosa congesta e edematosa, podendo haver hemorragia
► Quadro Clínico
▪ Período de Incubação: de 9 a 40 dias
▫ P. falciparum – média de 12 dias
▫ P. vivax – média de 15 dias
▫ P. ovale – média de 17 dias
▫ P. malariae – média de 28 dias
▪ Pródromos: mal-estar, anorexia, astenia, mialgia, cefaléia, lombalgia.
Artralgia, náuses e vômitos
▪ Febre: ao final do PI e dura até o ataque primário
▪ Ataque primário: primeira infecção palúdica
▪ Ataque secundário: recidivas ou reinfecções
► Acesso Malárico
▪ Período de frio (duração de 20 minutos a 2 horas): Rápida elevação da
temperatura, tremores, taquicardia, pulso rápido e fino, pele fria e pálida (azulada vasoconstrição periférica)
▪ Período de calor (duração de 8 horas): Inicia-se de 2 a 4 horas após os
tremores e há pele quente, seca e avermelhada (vasodilatação periférica), fácies
congesta, cefaléia, mialgia, raquialgia, delírios, náuseas, vômitos, taquicardia,
taquipnéia, hipotensão arterial, boca seca, sede, tosse e dores abdominais
▪ Período de sudorese (duração de 2 horas): Suor profuso, exaustão, alívio,
sonolência, normalização da temperatura, podendo persistir a cefaléia. Pode haver,
ainda, hepatoesplenomegalia e icterícia devido à hemólise
► Quadro Clínico das Infecções por P. vivax
▪ Ataque primário
▫ Calafrios intensos e de curta duração
▫ Acessos febris (duração de 04 a 08 horas) – diários nos estágios iniciais,
com posterior aumento nos intervalos (48 horas), seguidos de sudorese profusa
▫ Cefaléia, náuseas, vômitos, mialgia, hipotensão, palidez cutâneomucosa, icterícia discreta e hepatoesplenomegalia
▫ Raras complicações: ruptura esplênica, edema pulmonar, coma
malárico e trombocitopenia
▪ Quadro pode permanecer por meses e cessar espontaneamente
▪ Recidivas podem ocorrer:
▫ Presença de hipnozoítos (formas latentes hepáticas)
▫ Tempo máximo de evolução clínica: 04 anos (após, a atividade do
parasita se extingue)
► Quadro Clínico das Infecções por P. falciparum
▪ Manifestações semelhantes a da Malária vivax
▪ Grande risco de complicações
▪ Não possui as formas latentes hepáticas (hipnozoítos)
▪ Febre biliosa hemoglobinúrica:
▫ Decorrente de hemólise intravascular aguda, decorrente do uso de
quinino, exposição ao frio e esforço físico em doentes insuficientemente
tratados
▫ Calafrios intensos, vômitos biliosos, febre, urina enegrecida e icterícia,
com duração e 12 a 48 horas, podendo levar a insuficiência renal aguda,
choque, anúria e morte!!!!
▪ Malária grave Malária cerebral, insuficiência renal aguda (IRA), Malária
Pulmonar, Forma Biliosa Remitente, CIVD, Forma Colérica e Hipoglicemia severa
► Quadro Clínico das Infecções por P. malariae
▪ Acessos febris mais espaçados: a cada 72 horas
▪ Manifestações idênticas às infecções por P.vivax
▪ Complicação: Síndrome nefrótica (mau prognóstico)
► Complicações da Doença
▪ IRA (podendo haver oligúria progressiva)
▪ Malária pulmonar Edema agudo de pulmão
▪ Malária biliosa remitente Hepatite malárica
▪ CIVD (podendo haver hemorragias)
▪ Malária colérica (com vômitos, diarréia, dor abdominal e sangramento
intestinal)
▪ Hiperpirexia (temperaturas acima de 41°C, Cianose e Sintomas neurológicos)
▪ Hipoglicemia
▪ Infecções bacterianas Sepse
► Malária Crônica
▪ Infecções cujos ataques maláricos não foram adequadamente tratados,
resultando:
▫ Fadiga crônica
▫ Surtos intermitentes de febre
▫ Anemia intensa
▫ Icterícia
▫ Hepatoesplenomegalia volumosa
► Infecções Mistas
▪ P. vivax e P. falciparum
▫ Sinais e sintomas semelhantes a da doença única
▫ Alta taxa de icterícia
▫ Reduzido percentual de complicações
▫ Ausência de hiperparasitemia
► Síndrome da malária hiper-reativa
▪ Acomete adultos jovens de raça negra
▪ Esplenomegalia volumosa
▪ Hipergamaglobulinemia acentuada
▪ Altos títulos de anticorpos contra os plasmódios
▪ Hiperesplenismo
▪ Regressão do quadro após terapêutica prolongada
▪ Decorrência da resposta imune anormal à malária recorrente
▪ Prognóstico ruim
▪ Possível evolução para linfomas linfocíticos
► Diagnóstico
▪ Gota espessa Determinação da densidade parasitária
▫ P. falciparum (elevada parasitemia) Geralmente trofozoítos são
vistos no sangue periférico
▫ P. vivax (moderada parastemia) Todas as formas evolutivas são
vistas no sangue periférico
▪ Outros métodos diagnósticos: ELISA, Radioimunoensaio, Sondas de DNA,
Parasight-F e QBC
▪ Exames complementares
▫ Hemograma (Anemia, leucopenia e plaquetopenia)
▫ Bilirrubinas (Aumento da fração conjugada)
▫ Aminotransferases (Aumento moderado)
▫ Coagulação (TP aumentado em casos muito graves)
▫ Uréia e Creatinina (aumento discreto em fases iniciais e considerável em
nas formas graves – decorrente da necrose tubular aguda)
► Diagnóstico Diferencial
▪ Início Influenza e outras viroses
▪ Período de estado Leishmaniose visceral, Toxoplasmose aguda, Febre
tifóide, Endocardite infecciosa, Brucelose e Dengue
▪ Formas complicadas Leptospirose, Hepatites virais, Febre amarela, Sepse e
Colangite
▪ Formas crônicas Hepatopatias virais crônicas, Trombose de veia porta,
Hipertensão portal idiopática, Leishmaniose visceral, Linfomas, Anemias hemolíticas
crônicas
► Tratamento
▪ Interrupção da esquizogonia sangüínea
▪ Erradicação das formas latentes do parasito no ciclo tecidual
▪ Drogas Antimaláricas:
▫ Cloroquina - esquizonticida sangüíneo e gametocitocida para P. vivax e
P. malariae
▫ Primaquina - esquizonticida tecidual para P. vivax e gametocitocida
para P. falciparum
▫ Quinina - Ação apenas contra P. falciparum
▫ Doxiciclina - Usado apenas contra P. falciparum
▫ Mefloquina - Esquizonticida sangüíneo contra
P. falciparum.
Ação contra P. malariae e P. vivax. Eficaz contra os gametócitos de P. vivax
► Esquemas terapêuticos
▪ P. vivax Cloroquina por 03 dias associada à Primaquina por 07 dias
▪ P. falciparum Quinina por 03 dias associada à Doxiciclina por 05 dias e
Primaquina no 6º dia
▪ P. malariae Cloroquina por 03 dias
▪ P. vivax e P. falciparum Mefloquina em dose única associada à Primaquina
por 07 dias
► Profilaxia
▪ Proteção individual
▫ Telar portas e dormir com mosquiteiros
▫ Uso de repelentes
▪ Proteção Coletiva
▫ Combate ao vetor adulto e às larvas
▫ Saneamento básico
▫ Melhora das condições de vida
Leishmaniose
- Ampla distribuição geográfica
- Maior incidência na zona rural
- Alta prevalência – 12 milhões de infectados no mundo
- Evolução lenta
- Pode assumir formar graves
► Habitat
▪ Homem:
▫ LTA – células do sistema fagocítico mononuclear da derme e mucosas
▫ LVA – Medula óssea, baço, linfonodos e fígado
▪ Hospedeiro invertebrado (Flebotomíneo): monócitos, histiócitos e macrófagos
► Reservatórios
▪ Domésticos:
▫ Rural – cão
▫ Urbano – homem
▪ Silvestres: raposa e marsupiais
► Transmissão
▪ LTA: picada do inseto vetor
▪ LVA: vetorial, acidentes de laboratórios, transfusão sanguínea e congênita
► Interação Promastigotas-Macrófagos
Macrófagos – Receptores
▪ CR3 (receptores De complemento)
▪ FnR
▪MFR
Parasito – Ligantes
▪ gp3 (protease)
▪ LPG (lipofosfoglicano)
▪ FN (fibronectina)
► Aspectos Imunológicos – LTA
▪ Depende da virulência da cepa e da resposta imune do hospedeiro
▪ Linfócitos T CD4+ (Th1) INFγ, IL-2 e TNF Ativação de macrófagos
▪ Linfócitos T CD4+ (Th2) IL-4, IL-5 e IL-10 Inibem macrófagos e ativam
Linfócitos B Produção de anticorpos (IgG1 e IgE) e Th1 IgG2
▪ Linfócitos T CD8+ INFγ e TNF lise das células que expressam MHC classe I
e ativação de macrófagos
MACRÓFAGO PARASITADO
(Cél. Hospedeira e apresentadora de Ag.)
CITOTÓXICIDA
DE
T CD4
PRODUÇÃO
IgG e IgM
CD4 Th1
CD4 Th2
IL-2
IL-3
IL-4
IL-5
IL6
IL-10
• IFN-
TNF-
GM-CSF
inibiçã
o
Ativação de macrófago
Ativação deficiente de macrófagos
Controle imunológico na pele
Formas clínicas da doença
► Fisiopatogenia
▪ No ponto de inoculação das promastigotas: resposta inaparente ou
inflamatória
▪ Ativação do complemento: destruição direta da promastigota através da
opsonização (fagocitose facilitada)
▪ Caso a leishmania escape do ponto de inoculação, elas irão atingir as células
do SFM das vísceras
Estágio
Histologia
Nódulo
Epiderme intacta; forte infiltrado de macrófagos e
numerosos parasitos
Ulceração inicial
Ulceração superficial; forte infiltrado de
linfócitos, macrófagos e numerosos parasitos
Úlcera estabilizada com lesão satélite
Úlcera profunda; processo inflamatório ativo na
periferia; lesões satélites; poucos parasitos
Lesão cicatrizada
Leve depressão na pele; epiderme fina; fibrose
dérmica e ausência de parasitos
► Imunopatogenia na LV
▪ Depressão da atividade linfocitária
▪ Ausência de produção de IL-12 e INFγ pelos linfócitos
▪ Ativação policlonal de Linfócitos B e aumento nos níveis plasmáticos de Igs
▪ Presença de fator imunossupressor sérico
▪ Queda da taxa de neutrófilos
▪ Alta resposta Th2 – IL-4, IL-5, IL-10 e IL-13 – e baixos níveis de Th1
▪ Produção elevada de anticorpos
▪ Migração para lifonôdos e baço Disseminação
► Diagnóstico Clínico
▪ Período de incubação de 18 dias a 4 meses
▪ Lesão papulosa, bem delimitada, algumas vezes arredondada , e a pele
eritematosa
► Diagnóstico Laboratorial
▪ Exame parasitológico direto Esfregaço
▪ Exame imunológico Reação de Montenegro
▫ Avalia reação de hipersensibilidade retardada
▫ Na fase aguda, quase sempre é negativo
▫ É positivo em 95% a 100% dos indivíduos curados
▪ Exame sorológico em alta estão as reações enzimáticas
▫ Alta sensibilidade e especificidade
▫ Utilizam antígenos específicos
▫ Ex: ELISA e teste Imunocromatográfico
▫ Em desuso: HAI, Contra-eletroforese (CIEF) e Fixação do Complemento
▪ Biologia Molecular Sondas de DNA
► Exames Complementares
▪ Hematológicos – anemia, baixos níveis de leucócitos e plaquetas
▪ Transaminases – aumento de até 3 vezes
▪ Aumento na fração de γglobulina
▪ Diminuição da albumina
► Histopatologia
▪ Identificar as formas amastigotas
▪ Diagnóstico diferencial com micoses e neoplasias
Leishmaniose Visceral
(Calazar)
- Protozoonose endêmica e/ou epidêmica
- Doença espectral – ampla gama de manifestações clínicas
- Evolução sub-aguda ou crônica
- Transmitida pela picada de flebótomos infectados
- 12 milhões de infectados no mundo em cerca de 90 países
- 2 milhões de casos novos por ano – 1,5 milhão de LT e 0,5 milhão de LV
- Nos últimos 20 anos: aumento da incidência e urbanização
– Fatores: migração rural, reservatório doméstico (cão), aumento da pobreza e
crescimento urbano desordenado
► Transmissão
▪ Picada do vetor, acidentes de laboratório, transfusão sanguínea e congênita
▪ Presença de reservatórios: Raposa, marsupiais, cão e o próprio homem
infectado
Normalmente a infecção é benigna e inaparente
▪ Presença do vetor hábitos crepusculares ou noturnos. Maior
trasmissibilidade durante e após a estação chuvosa
Fêmea do flebotomíneo corta com
suas mandíbulas o tecido
subcutâneo, iniciando o afluxo
►
sanguíneo
Sucesso na infectividade das promastigotas
Saliva possui neuropeptídeos
vasodilatadores que facilitam a
alimentação do inseto e
imunossuprimindo a resposta do
hospedeiro
Inoculação das formas
promastigotas metacíclicas
► Classificação da Doença
▪ Baseada em aspectos clínicos:
▫ Leishmaniose visceral ou Calazar - Leishmania donovani
▫ Leishmaniose cutânea - L.tropica
▫ Leishmaniose cutâneo-mucosa (úlcera de Bauru) - L.braziliensis
▪ Há, ainda, uma nova classificação, baseada em aspectos morfológicos,
imunológicos, geográficos, bioquímicos e clínicos
► Aspectos Imunológicos
▪ Macrófagos apresentam os antígenos aos linfócitos T CD4+, que podem ser
divididos em 2 populações: Th1 e Th2
▪ Resistência ao hospedeiro está associada à ativação e diferenciação dos Th1,
que secretam citocinas (IL-2, IL-2 e IFNγ)
▪ Susceptibilidade está relacionada com a resposta Th2, que secreta IL-4, IL-5,
IL-6, IL-10 e TNFα
► Patogenia
▪ No local de inoculação (pele),a resposta é inaparente ou do tipo inflamatória
▪ Ativação do complemento:
▫ Destruição direta da promastigota (opsonização)
▫ C3b – fagocitose facilitada
▪ Algumas leishmanias escapam do ponto de inoculação e chegam ao SFM das
vísceras, onde são fagocitadas por histiócitos
▪ Baço aumentado: hipertrofia e hiperplasia do SFM
► Aspectos Clínicos da LV
▪ Infecção Assintomática
▫ 30% dos adultos de área endêmica – sorologicamente positivos ou
reatores ao teste intradérmico sem evidência de doença
▪ Infecção sub-clínica ou Oligossintomática
▫ Forma mais freqüente em áreas endêmicas.
▫ Caracteriza-se p/ sintomas inespecíficos: febrícula, tosse seca, diarréia,
sudorese e discreta visceromegalia
▪ Calazar Clássico
▫ PI varia de 10 dias à 3 anos (média de 3 a 6 meses)
▫ PERÍODO INICIAL
- Pode apresentar-se de 5 formas, sendo de início gradual as
formas insiosa, assintomática e transitória e de início abrupto as formas
Entérica ou Tifóidea e Malárica
- Sintomas: diarréia, edema de MMII, hipertermia, pequena
esplenomegalia, astenia, prostração, mal-estar, inapetência, distúrbios genitais,
emagrecimento, palidez, alopécia, hemorragias, artralgias, mialgia
▫ PERÍODO DE ESTADO
- Fase em que o paciente procura o hospital, já com os sintomas
iniciais agravados
- Febre: dupla ou tripla elevações diárias
- Anemia: cor de cera velha
- Esplenomegalia: cresce como o útero gravídico e de
consistência amolecida, podendo haver dor, periesplenite ou infarto
- Hepatomegalia: freqüente, mas não tão exacerbada
- Hipotensão arterial e taquicardia
▫ PERÍODO FINAL
- Exacerbação do período de estado com algumas complicações
- Caquexia, carência vitamínicas
- Infecções: broncopmeumonia, otites, amigdalites, disenterias
- Hemorragias: frequentes e abundantes, púrpuras
- Insuficiência cardíaca
- ÓBITO
► Diagnóstico Diferencial
▪ Malária, Febre tifóide, Enterobacteriose prolongada, Esquistossomose
mansônica, Brucelose, Histoplasmose, TB Miliar e Doença de Chagas Aguda
► Diagnóstico Laboratorial
▪ Exame direto (esfregaço corado com Giemsa, Leishman ou Diff Quick) de
tecidos do baço, fígado, linfonodos, mucosa intestinal e creme leucocitário
▪ Cultivo “in vivo”
Mais utilizados em
▪ Cultivo “in vitro”
laboratórios de pesquisa
▪ Reação de Montenegro
► Tratamento
▪ Antimoniais pentavalentes (Antimoniato de Meglutamina)
▪ Anfotericina B
▪ Pentamidina (Isotianata - Mesilato)
▪ Alopurinol associado aos antimoniais
► Profilaxia
▪ Construção de casas a uma distância mínima – 500 metros – de matas
▪ Melhoria das condições de habitação e alimentação
▪ Tratamento dos indivíduos parasitados;
▪ Uso de repelentes, telas e mosquiteiros;
▪ Uso de inseticida (combate ao flebótomo);
▪ Eliminação de cães infectados
DIP – Resumo: Leishmaniose Visceral (Calazar)
CONCEITO
L. donovani age no sistema retículo-endotelial humano, produzindo febre irregular de
longa duração, emagrecimento, palidez cutâneo-mucosa, exuberante
hepatoesplenomegalia, anemia, leucopenia e trombocitopenia. Ocorre desnutrição,
hipoalbuminemia e hipergamaglobulinemia.
É uma zoonose de áreas tropicais, e os seus vetores são os insetos do gênero
Lutzomyia, nas Américas e Phlebotomus, no Velho Mundo.
HISTÓRICO
Calazar significa Febre Negra. Importância do cão e da raposa na manutenção da
endemia em áreas de maior incidência no Brasil.
ETIOLOGIA
As principais subespécies causadoras da doença no homem são L. donovani, L.
infantum e L. chagasi.
CICLO EVOLUTIVO
Amastigotas se multiplicam nos macrófagos de mamíferos até que os macrófagos se
rompam. Os protozoários livres são ingeridos pelos flebótomos. No tubo digestivo dos
flebótomos, os amastigotas evoluem para promastigotas metacíclica. Essas são
transmitidas aos humanos no repasto sanguíneo.
EPIDEMIOLOGIA
Se distribui principalmente nos continentes do Velho Mundo, na Ásia: Bangladesh,
China e Índia; na Europa, na região do mediterrâneo: em Pórtugal, Espanha e Itália; na
África: Quênia, Sudão e Etiópia. No Oriente Médio, principal/ Irã e Iraque. Nas
Américas, o Brasil é o país mais importante, tendo como estados predominantes Bahia,
Ceará Piauí Rio Grande do Norte e Maranhão (São Luís). No Brasil, a doença predomina
em crianças e adultos jovens e o cão é o principal reservatório.
FISIOPATOGENIA E IMUNOLOGIA
Alteração da imunidade visceral e celular, reversível após tratamento. A Leishmânia é
um parasita intracelular obrigatório dos macrófagos. Ocorre ativação policlonal de
linfócitos B e produção de anticorpos IgG e IgM, o que se reflete em aumento das
gamaglobulinas.
PATOLOGIA
O espectro de manifestações é variado dependendo da interação entre agente e
hospedeiro. No pólo hiperergico, a doença é autolimitada. No pólo anérgico, há
manifestações sistêmicas exuberantes. A LV se caracteriza pelo comprometimento do
SRE, que se hipertrofia e hiperplasia e os sinais e sintomas das doença são mais
pronunciados nos órgãos em que o SRE é mais proeminente, isto é, fígado, baço e
medula óssea.
Se o hospedeiro mostra resposta com citocinas tipo TH1, os macrófagos destroem as
leishmanias e há resolução do processo. Porém se a resposta é com produção de
linfocimas tipo TH2, as Leishmanias escapam do ponto de inoculação e são carregadas
pelos macrófagos por todo o organismo, com instalação nos órgãos ricos em SRE.
No fígado ocorre o Padrão Típico, com hipertrofia e hiperplasia das células de Kupffer,
repletas de formas amastigotas.O Padrão Nodular, com agregados de células
inflamatórias nos lóbulos hepáticos e espaços portais. Há discreta ou moderada
hipertrofia e hiperplasia das células de Kupffer, sem formas amastigotas. Essa forma
representa uma tentativa mais eficaz de controlar a infecção. O Padrão Fibrogênico se
caracteriza por ampliação dôo espaço de Disse com aumento da trama reticulínica e
proliferação dos feixes colágenos. Pode haver fibrose hepática intralobular difusa, a
cirrose de Rogers, que involue com o tratamento da doença.
No Pulmão, há pneumonite intersticial, o que justifica o aparecimento de tosse seca e
persistente no início dos sintomas e no período de estado que desaparece após a cura
da LV. Infecção secundária por bactérias, levando a broncopneumonia são causas
freqüentes de óbito.
No rim, relata-se anormalidades da função renal demonstrada por proteinúria,
hematúria, aumento de uréia e creatinina e diminuição do clearance de creatinina.
Ocorre nefrite intersticial, com edema e infiltrado inflamatório. Há hipertrofia e
hiperplasia das células mesangiais, com espessamento membranoso, fibrilar ou hialino
da matriz mesangial. Contudo, a alteração dos glomérulos é menos evidente que a
alteração intersticial.
No baço, ocorre reatiividade do SRE e congestão dos sinusóides, o que leva a
esplenomegalia. Polpa vermelha congesta e hipertrofia e hiperplasia do SRE,
macrófagos contendo amastigotas. Ocorre aumento de macrófagos e plasmócitos, e
redução dos linfócitos T, com isso há redução da polpa branca.
Nos linfonodos, há reatividade dos seios, hiperplasia e parasitismo dos macrófagos.
Reatividade dos centros germinativos causam discreto aumento de volume.
Na medula óssea, há hipercelularidade granulocítica e redução dos neutrófilos (por
seqüestro esplênico, reação auto-imune, ou redução da reserva medular). Há aumento
de microeritroblastos, mas ocorre anemia (por redução da produção, seqüestro
esplênico ou hemólise auto-imune). Diminuição da maturação medular e destruição
auto-imune leva a plaquetopenia. Aumento de plasmócitos e macrófagos, parasitados
No tubo digestivo, há infiltrado de macrófagos, linfócitos e plasmócitos no jejuno.
Ocorre enteropatia perdedora de proteínas e conseqüente hipoalbuminemia.
QUADRO CLÍNICO
Três respostas: 1) reação local com destruição do parasito fagocitado; 2) interação
parasito-hospedeiro e persistência do parasito no organismo de forma latente; 3)
fagocitose e multiplicação dentro dos macrófagos e disseminação para o sist. RE
Infecção assintomática: em áreas endêmicas há testes sorológico e intradérmico
positivos sem história de doença prévia.
Infecção subclínica ou oligossintomática: é a mais freqüente em áreas endêmicas,
apresenta sintomas inespecíficos, como febrícula, tosse seca, adinamia, sudorese,
diarréia e visceromegalia discreta. Pode evoluir para cura espontânea ou Calazar
clássico. A desnutrição é importante fator de risco para a progressão para o Calazar. Na
índia ocorre linfadenomegalia.
Formas agudas: Quadro séptico com febre alta, tosse e diarréia. Alterações
hematológicas discretas HEmegalia é pouco pronunciada. Elevação das globulinas com
produção de IgG e IgM.
Calazar clássico: Início insidioso que dificulta determinar com precisão o período de
incubação. Alguns estudos sugerem 2 a 8 meses. A doença tem evolução prolongada,
desnutrição calórico protéica, abdome protruso (HEmegalia), pele de coloração
pardacenta ou de “cera velha”, cabelos quebradiços e cílios alongados. Os sintomas
iniciais são inespecíficos e constituem de febre irregular, persistente, com dois a três
picos diários, ou intermitente. Distúrbios gastrointestinais como diarréia, obstipação
podem estar presentes. Adinamia, prostração, sonolência, mal estar e emagrecimento.
Manifestações hemorrágicas são incomuns (petéquias, epistaxes e sangramento
gengival). Tosse seca.
Segue-se o período de estado, com febre de 37 a 38ºC (temperaturas maiores sugerem
complicações bacterianas ou virais). Podem haver períodos de apirexia. Há caquexia,
mas o apetite está preservado. Cabelos secos e quebradiços, com o sinal da bandeira
(com duas a três colorações), cílios alongados, edema de mãos e pés, HEmagalia
gigantesca, dispnéia de esforço, mialgia, artralgia, náuseas, vômitos, retardo da
puberdade e amenorréia
No período final, há baixos níveis de Hg no sangue (5 – 6g%). É comum dispnéia aos
mínimos esforços, sopro sistólico plurifocal(anemia) e insuficiência cardíaca.
Pancitopenia com altas taxas de globulina é regra. Complicações freqüentes são
infecção bacteriana e hemorragia. Causas de óbito mais comuns são;
broncoopneumonia, septicemia, hemorragia aguda, gastrenterites, IC secundária a
anemia, caquexia e coagulopatias pós-transfusionais.
Calazar em portadores do HIV: a Leishmania age como oportunista e pode recidivar
também após imunossupressão induzida por droga ou transplante. Os sintomas mais
comuns são febre, hepatoesplenomegalia ou hepatomegalia e esplenomegalia
isoladas, linfadenomegalia e alteraçõpes da pele. Pancitopenia, redução de CD4,
hiipergamaglobulinemia, porém com poucos Ac específicos para a Leishmania e fáccil
demontração do parasito nos tecidos.
DIAGNÓSTICO:
Investigar sempre que houver febre prolongada, HEmegalia, principal/ se o paciente
vêm de zona endêmica. Há três critérios a considerar: epidemiológicos, clínicos e
laboratoriais.
Epidemiológico: Procedência de área endêmica ou viagem nos últimos doze meses.
Estando em área endêmica verificar casos caninos e presença de vetor na residência.
Clínicos: Síndrome clássica, com febre irregular e persistente, anemia, HEmegalia,
manifestações hemorrágicas. Nos casos oligossintomáticos, tosse persistente, diarréia,
adinamia, HEmegalia discreta.
Laboratoriais: No Calazar Clássico, há anemia, com Hg < 10g%,
leucopenia(<2000cels/mm³), plaquetopenia(<100000cels/mm³), albumina<3,5g% e
globulinas>5g%. Aumento de transaminases hepáticas e teste sorológico positivo com
detecção de Ac anti-Leishmania.
DIAGNOSTICO DIFERENCIAL
Malária: Nas fases não-imunes a febre é contínua e os acessos palúdicos com febre
intermitente não são observados. Porem são marcantes o calafrio intenso e a sudorese
profusa.
Febre tifóide: É semelhante na fase septicêmica. Não leva a anemia como no Calazar e
a esplenomegalia é discreta.
Salmonelose: nesta a reação de Widal é positiva.
Esquistossomose: Leucocitose e aumento de eosinofilos ajudam a diferenciar da LV.
Leucemia: nesta a anemia, esplenomegalia e manifestações hemorrágicas são de
rápida evolução.
TRATAMENTO:
Miltefosine (oral) – acompanhamento ambulatorial; Anfotericina B – tratamento
hospitalar.
Doença de Chagas
- Também chamada de Tripanossomíase americana
- Doença transmissível causada pelo T. cruzi
- Transmitida pelas fezes do “Barbeiro” (chupança, chupão, ...)
● No hospedeiro vertebrado
• Tripomastigotos no sangue periférico
• Amastigotos nos tecidos
● No hospedeiro invertebrado
• Epimastigotos no intestino médio
• Tripomastigotos metacíclicos na luz do reto
► Transmissão
▪ Barbeiro, em qualquer estágio, se infecta com sangue contaminado
▪ Tripanossoma se multiplica no intestino e é eliminado com as fezes enquanto
o sangue do vertebrado é sugado
▪Geralmente, a picada provoca coceira, facilitando a penetração do
tripanossoma pelo local da picada
▪ Outros mecanismos:
▫ Transfusão sanguínea
▫ Transmissão congênita da mãe chagásica
▫ Ingestão de carne contaminada
▫ Acidentes de laboratório
▫ Transplantes de órgãos
▫ Alimentos: cana, açaí
► História Natural
Contaminação
PI: 7 a 10 dias
Cura
Doença aguda
sintomática ou
não (de 2 a 4
meses)
Cura?
Forma Crônica
Indeterminada
Morte?
10 a 20 anos
em 10% a 30%
Morte
Doença
subaguda
Forma Crônica
Determinada
(Cardíaca,
Digestiva ou
Mista)
Morte
Evolução
Benigna
Formas
clínicas
crônicas
benignas
tem disseminação global e pode contaminar todos os órgãos
Forma▪ Tripanossoma
Crônica
Evolução maligna
Indeterminada
Morte
Permanente
▪ Forma aguda aparente em apenas 15% a 20% (na maioria é inaparente)
▪ A forma aguda pode ser arrastada (2 a 4 meses), grave (encefalite ou cardíaca
grave) e pode levar ao óbito. Mas, se tratada na mesma fase, a doença pode ser
curada!!!!
► Patogenia
▪ Resposta Inflamatória
▫ Macrófagos, fibroblastos, Células de Schawan e miócitos são alvos
▫ Inflamação local e difusa
▫ Fase aguda parasitos
▫ Fase crônica hiperensibilidade tardia e auto-imunidade (antígenos e
imunidade celular)
▪ Lesões celulares
▫ De degeneração até necrose
▪ Fibrose
▫ Inflamação, fenômenos imunitários, alterações vasculares e outros
fatores
► Diagnóstico
▪ Parasitológico
▫ Esfregaço do material coletado na biópsia do órgão
▫ Esfregaço do sangue periférico
► Quadro Clínico
▪ Fase aguda aparente
▫ Febre prolongada
▫ Edema no local de entrada do parasito
▫ Chagomas de inoculação (endurecidos e de coloração rósea-violácea)
▫ Linfoadenomegalia (complexos cutâneos e oftalmolinfonodal)
▫ Hepatoesplenomegalia (em 30% a 40% dos pacientes)
▫ Meningoencefalite
▫ Sinal de Romaña
▫ Miocardite aguda, difusa e intensa
- ICC nos casos graves
- Pericardite
- ECG normal em 50% a 70%
- BAV de 1/grau e alterações difusas da repolarização ventricular
- Rx de tórax – cardiomegalia discreta em 60%
▪ Fase aguda inaparente
▫ Maioria dos casos
▫ Cerca de 70% a 80%
▪ Forma Indeterminada
▫ Exames sorológicos ou parasitológicos positivos em 50%
▫ Ausência de sinais e sintomas da doença
▫ ECG normal
▫ Alta prevalência de dontes
▫ Importância médico-trabalhista
▫ Potencial evolutivo favorável (conduta: acompanhamento clínico,
loboratorial, ECG e RX)
▪ Forma Crônica Sintomática
▫ Baixa parasitemia com lesões típicas no coração e/ou no tubo
digestório
▫ Dentre as alterações no TGI, o megaesôfago e o megacólon são as mais
comuns – mecanismo lesão nos plexos mioentéricos do SNA
▫ Cardiopatia chagásica – perda da função e dilatação, podendo haver:
- Alteração no ritmo cardíaco
- Morte súbita se houver BAV
- Aneurisma de ponta m 55% dos que possuem o vórtice
adelgaçado
- Tromboembolism do AD e/ou VD
► Diagnóstico Diferencial
▪ Mononucleose, Febre Tifóide, Enterobacteriose prolongada, Esquistossomose,
Brucelose, Endocardite subaguda, TB Miliar
► Diagnóstico Laboratorial
▪ Fase aguda
▫ Pesquisa direta: exame a fresco, gota espessa, esfregaço, biópsia
▫ Pesquisa indireta: xenodiagnóstico
▫ Testes sorológicos: IgM (imunofluorescência) e IgG
▪ Fase crônica
▫ Pesquisa indireta: xenodiagnóstico e hemoculturas
▫ Testes sorológicos (detecção de IgG): Aglutinação, Imunofluorescência
e ELISA
► Tratamento
▪ Para todos os doentes em fase aguda
▪ Nos casos congênitos
▪ Na reativação da parasitemia por imunossupressão
▪ Em transplantados que receberem órgãos de doador infectado
▪ Droga utilizada: Benzonidazol
▫ Contra indicação: grávidas, pois não impede a transmissão congênita e
é teratogênico
▪ Nas fases crônicas, o tratamento é sintomático
► Profilaxia
▪ Melhoria das condições de habitação
▪ Controle dos doadores de sangue
▪ Combate ao vetor (barbeiro) através de campanhas
▪ Controle da infecção congênita
▪ Vacinas (ainda em fase de estudo)
Doença de Chagas
- Estima-se entre 16 a 18 milhões de infectados. No Brasil, há cera de 6 milhões, sendo
60%destes vivendo em áreas urbanas
- Estima-se em 80 milhões o número de indivíduos expostos à doença
► O Parasito (T. cruzi)
▪ No hospedeiro vertebrado:
▫ Tripomastigotas estágio sanguíneo infectante
- subformas: sanguíneo delgados – macrofagotrópicos
largos – miotrópicos
▫ Amastigotas forma intracelular
▪ No hospedeiro invertebrado:
▫ Epimastigotas formas de reprodução do parasito no vetor ou em
meios de cultura. Estão presentes em todo intestino do inseto
▫ Tripomastigotas metacíclico forma infectante para os vertebrados
► Mecanismos de Transmissão
▪ Primários
▫ Vetorial 70% a 90% dos casos
▫ Transfusional 1% a 20% dos casos
▫ Congênita 0,5% a 10% dos casos
▪ Secundários: oral, transplantes e acidental
► Interação Parasito-Hospedeiro
▪ Penetração passiva: fagocitose
▪ Penetração ativa: ativação dos receptores para citocinas TGFβ
▪ No tripomastigoto metacíclico:
▫ gp82 se liga à mucina gástrica
▫ gp85 reconhece componentes da matriz, como a laminina
▫ transialidases ligam-se a resíduos de ácido siálico e permitem a ligação
com a célula hospedeira – através de aceptores como proteoglicanos e a
laminina
► Caracterização Genética
▪ Perfil eletroforético de enzimas – Zimodemos (populações que diferem entre
si pelas propriedades eletroforéticas de algumas isoenzimas)
▫ Zimodemos I e III ciclo silvestre (raramente causam infecção
assintomática no homem)
▫ Zimodemo II ciclo domiciliar
▪ Análise de Loci enzimático
▫ Populações clonais – no T. cruzi, são multiclonais com tropismo para
diferentes tecidos, decorrete da interação parasito-hospedeiro
▪ Esquizodema – populações que diferem entre si pelos padrões eletoforéticos
de seu DNA mitocondrial ou por seqüências específicas do DNA ribossomal
▫ kDNA, DNA fingerprint, RNAr
A heterogeneidade genética garante virulência, patogenicidade, morbidade e
susceptibilidade à fármacos
Biodemas: classificação das cepas de acordo com seu comportamento biológico
(morfologia, evolução da parasitemia e tropismo tissular)
FASES
Inicial
[
Tipo I
Parasitismo dos
Macrófagos do Baço,
Fígado, Linfo
nodos, Tec. Conjun
tivo intersticial e
Adipócitos.
Tipo II
Miocárdio
Avançada Miotropismo lesões - lesões
musculares
inflamatórias:
Tipo III
Miotropismo fibras
musculares c/ inten
so processo inflama
tório.
- lesões de arterite e
periarterite
- necrose de parede
vascular
► Resposta Imune
▪ Parasito: ativação de NK, macrófagos, Linfócitos T e Linfócitos B
▪ Ação da via alternativa do complemento
▪ NK: em estágios iniciais, limitam a multiplicação e liberam IFNγ
em estágios posteriores, produzem IFNγ por LT CD4 e CD8
▪ Ativação de macrófagos com produção de IL-12, TNFα e IL-10
(imunossupressão de MAC e produção de anticorpos)
▪ Il-12 e IFNγ: resposta inata contra agentes intracelulares
▪ NO e reativos de O2: destruição dos parasitos
Cardiopatia chagásica: aumento de IgM e IgG
Forma digestiva: aumento de IgA
Forma cardíaca: aumento de IgE
P
a
r
a
s
i
t
e
m
i
a
Fase aguda
[↑parasitemia]
RI do Hosp.
(Acs)
Fase crônica
[↓parasitemia]
Dias
5
15
25
35
45
50
60
Infecção
I
n
o
c
.
P
a
r
a
s
i
t
a
Il 12
Ig G
Ig M
Fase Aguda
Fase Indeter
Fase Cardíaca e Digestiva
60 - 70%
30 - 40%
Anos
►Fisiopatogenia
▪ Resposta inflamatória, lesões celulares e fibrese (cardíaca, TGI e SNC)
▪ Fase aguda: baixa resposta proliferativa de linfócitos relacionada com a baixa
expressão de receptores para IL-2
▪ Fase crônica: Baixa parasitemia, mas o SI não é capaz de erradicar a infecção.
Há resposta celular com aumento de células T CD4+ e CD8+ ativadas, com elevada
expressão de TNFα e IL-10 em pacientes com formas cardíaca e indeterminada;
▪ Chagásico possui grandes quantidades de IL-5, IL-10, IL-13 e IFNγ em relação
aos não chagásicos
► Diagnóstico
▪ Antecedentes epidemiológicos – procedência, tipo de moradia, conhecimento
do vetor e sinais de picadas
▪ Quando solicitar o exame soroloógico:
▫ Confirmação ou exclusão da suspeita clínica
▫ Bancos de Sangue - Hemocentros
▫ Grávida evitar transmissão congênita
▫ RN de mãe infectada acompanhar por até 6 meses
▫ Medicina do Trabalho (exames admissionais)
▫ Imunossupressão (transplantes)
▫ Terapêutica Etiológica
▫ Epidemiologistas - prevalência da infecção e eficácia de medidas
profiláticas e control
▫ Ética e Processos Judiciais
► Diagnóstico Sorológico
▪ Aglutinação de hemácias (método direto – AD – ou indireto – HAI)
▪ Imunofluorescência – IFI
▪ Elisa
▪ Xonodiagnóstico (dependendo da parasitemia)
Na fase aguda: IFI, AD e Elisa
− Parasito não é encontrado
− Suspeita é clínica
− Encontra-se IgM após uma semana de infecção
− Testes sorológicos em infecções com menos de 30 dias não são confiáveis
Na fase crônica: diagnóstico confiável se forem utilizados dois métodos de
princípios distintos
Febre Tifóide
Introdução
Doença infecciosa aguda, sistêmica, contagiosa, causada pela Salmonella typhi
e paratyphi. A febre paratifóide é menos grave e menos freqüente.
Etiologia
As Salmonella typhi e paratyphi são bacilos gram (-), aeróbios de fácil cultivo.
Três antígenos são usados para identificá-las, o antígeno S (presente em todas as
salmonelas), o antígeno flagelar H (presente em todas as formas flageladas) e o
antígeno Vi (que confere virulência, encontrado apenas nas Salmonella typhi e
paratyphi ). O fagotipo E da Salmonella typhi é o mais comum e mais resistente ao
cloranfenicol.
Dentre as propriedades patogênicas da Salmonela estão sua resistência à
acidez gástrica, e a resistência aos fatores antimicrobianos intestinais produzidos pelas
células de Paneth. A Salmonela induz à endocitose as células intestinais para
atravessar a barreira de células epiteliais e tem capacidade de sobreviver dentro dos
macrófagos, o que favorece sua disseminação na corrente sanguínea.
Epidemiologia
Relação com os sistema de tratamento, distribuição e abastecimento de águas.
É uma doença cosmopolita. Há redução dos casos em áreas de boas condições
sanitárias, o que evita a reinfecção a partir de indivíduos contaminados. É mais
prevalente entre adolescentes e adultos jovens; a profissão é importante como fonte
de propagação, o que acontece com os manipuladores de alimento. Calor e umidade
favorecem a disseminação da Salmonela.
Fontes de Infecção
São os doentes e os portadores. Os portadores são indivíduos que após a
infecção clínica ou subclínica, continuam eliminando a Salmonela na comunidade.
Não existe imunidade natural adquirida, mas a doença confere diferentes graus
de imunidade, podendo haver recidivas e recrudescência.
Vias de transmissão
São duas: direta e indireta.
A direta ocorre por contato com as mãos ou fômites de um doente. O
período de contágio vai desde a 1ª semana de doença até a convalescença.
A indireta é relacionada a água contaminada e os alimentos costumam ser o
veículo de transmissão da Salmonella typhi.
Patogenia
A Salmonella typhi induz estímulo de reforço nos linfócitos de indivíduos que já
tiveram a doença. Em áreas endêmicas, as taxas de ataque diminuem com a idade,
enquanto em áreas não endêmicas, indivíduos de todas as idades são igualmente
suscetíveis. A via de entrada é a digestiva, e o primeiro mecanismo de defesa é a
acidez gástrica. Indivíduos com acloridria ou ingestão de alcalinos são mais sensíveis à
infecção. Através do ducto torácico as bactérias atingem a corrente sanguínea e se
propagam aos diversos órgãos, fígado, baço, medula, esta é a fase septicêmica. Voltam
aos intestino delgado, onde desencadeiam fenômenos necrohemorrágicos, ulcerações,
perfurações e peritonite. Nos indivíduos doentes ocorre a síndrome da coagulação
intravascular disseminada (plaquetopenia, hipofibriªªnogenemia e aumento dos
fatores de degradação do fibrinogênio)
Patologia
Há alterações semelhantes às da septicemia, comprometendo fígado e SRE.
Os folículos linfóides intestinais passam pelas fases de hiperplasia, necrose,
ulceração e cicatrização. No entanto, entre estas, fases, pode ocorrer a
complicação mais temível da febre tifóide que vem a ser a perfuração e peritonite
fecal.
Quadro clínico
O PI é de 10 dias em média. Varia de dias a semanas.
O período inicial corresponde à primeira semana e é caracterizado por
febre, diária e com aumento progressivo, acompanhada de anorexia, náuseas,
vômitos, astenia e cefaléia, com características semelhantes às da febre. No
período de estado (2ª e 3ª semanas), a febre fica em torno de 39 a 40º e os outros
sintomas se intensificam. O estado de consciência se altera, torpor, aparecem
sinais de desidratação, diarréia abundante e esverdeada, pode haver constipação
em adultos; meteriorismos e borborigmos à ausculta abdominal. Aparece a roséola
tífica em abdome e tórax, que desaparece a pressão. Úlceras de Daguet na mucosa
oral, língua saburrosa. Dissociação de pulso e temperatura, e a taquicardia é sinal
de complicações como hemorragia ou perfuração. Há HEmegalia. Anemia,
leucopenia com linfocitose, neutropenia, ausência de eosinofilos, e plaquetopenia
são os achados no hemograma. O período que se segue (4ª semana) é o de
declínio, onde a febre diminui, o estado geral e o nível de consciência melhoram. A
convalescença é demorada, pois o individuo demora a se recuperar do estado
febril prolongado, havendo neste período desnutrição e atrofia muscular.
As complicações mais temidas são hemorragia maciça e perfuração
intestinal. Ocorrem entre a 3 ª e 4ª semanas. A perfuração ocorre com maior
freqüência no íleo terminal, ocorre abdome agudo e pneumoperitônio à
radiografia. Outras complicações raras, são ruptura espontânea do baço, anemia
hemolítica e pneumonia lobar ou bronquite(na fase de recuração). Há um aforma
de febre tifóide prlongada, associada a esquistossomíase hepatosplênica, que
apresenta difícil diagnostico diferencial com o calazar. No período de
convalescença, cerca de 15 dia após terminada a febre pode ocorrer recaídas com
a volta da febre e dos sintomas e positivação das culturas. Decorre de bacilos que
permaneceram protegidos na vesícula biliar ou em gânglios mesentéricos. As
recaídas são menos freqüentes em pacientes tratados por 14 dias, em comparação
com aqueles tratados por 7 a 10 dias.
Os portadores mantém a epidemia. Há três tipos, os convalescentes
(eliminam o bacilo por 4 meses), os crônicos (eliminam o bacilo por um ano) e os
sãos (eliminam o bacilo assintomaticamente por um ano). Os portadores
costumam ser mulheres de idade avançada com doença das vias biliares, principal
local para multiplicação e eliminação do bacilo tifoídico.
Diagnostico diferencial
É feito com doenças que também levem a febre, sintomas gastrintestinais e
choque. Entre essas doenças pode-se citar, brucelose, hepatites virais, malaria por
falciparum, abscesso hepático, apendicite, leptospirose, febre reumática,
endocardite infecciosa, etc.
Diagnostico laboratorial
Pode ser microbiológico (isolamento do bacilo) ou sorológico (detecção de
anticorpos no soro).
O microbiológico inclui hemocultura (em meio à base de bile; dá o diag com
segurança, mas reduz a sensibilidade após administração do ATB), mielocultura
(mais sensível porem mais desconfortável), coprocultura (útil para detectar
pacientes crônicos), urinocultura e cultura com outras materiais, como a roséola
tífica, LCR, secreção bronquial, etc.
As provas sorológicas são a reação de Widal, fixação em superfície, contraimunoeletroforese, e ensaio imunoenzimático. A reação de Widal é a detecção dos
anticorpos H e O, existentes também em outras salmonelas. É prova importante
em áreas não endêmicas e em crianças < 10 anos. É considerado positivo com
títulos acima de 1:100. Em zonas endêmicas, os títulos devem ser de 1:160 para
que a prova tenha valor.
ENDOCARDITE
Alta incidência em usuários de droga intravenosa. É classificada clássica/ em aguda ou
subaguda dependendo do curso clinico, lesão valvar predisponente e população
afetada. Forma aguda: lesão em valvas normais por microorganismos virulentos
(Staphylococcus aureus e Streptococcus pneumoniae). Possui alta letalidade. Forma
subaguda: infecção de valvas previamente lesadas por organismos de baixa virulência
(strepto do grupo Viridans). Com base no tratamento e prognostico, outra classificação
leva em conta a lesão predisponente e o organismo infectante.
As lesões predisponentes são: prolapso de valva mitral; valvulopatia reumática;
cardiopatias congênitas, como CIV, estenose aórtica, tetralogia de Fallot,...; as lesões
degenerativas, como a estenose aórtica calcificada nos idosos.
Streptococcus bovis, enterococos e estafilococos são os mais freqüentes em não
usuários de drogas (UDI). Quando a doença é por strepto, parte dos pacientes relatam
terem participado de procedimentos dentários. Quando por enterococos, são
predispostos, indivíduos do sexo masculino que realizaram procedimentos
geniturinários, como cistoscopia, prostatectomia, e mulheres que realizaram abortos,
parto vaginal e outros procedimentos ginecológicos.os enterococos com freqüência
são multirresistentes. O S. bovis é comum em idosos com lesão estrutural do cólon.
Streptos doos grupos A e B são muito virulentos. Os do grupo B formam grandes
vegetações com tendência a embolização. Fungos acometem imunossuprimidos (por
corticóides, drogas antineoplásicas, cateteres venosos de longa permanência) e UDI.
Nos usuários de drogas a fonte de infecção vem da pele, ou das drogas, agulhas e
seringas. A valva mais afetada é a tricúspide.o microorganismo mais freqüente é o S.
aureus. Em próteses cardíacas a doença de divide em precoce (até 60 dias após
inserção da prótese) e tardia. Na precoce, o principal agente é o stafilococo
epidermidis e decorre de bacteremias transitórias ou contaminação da prótese no ato
cirúrgico. A tardia é decorrente de bacteremias transitórias, sendo os estreptococos os
principais responsáveis.
PATOGÊNESE
Três fatores: jato em alta velocidade, passagem do fluxo de uma câmara de alta
pressão para uma de baixa pressão e orifício entre as câmaras. As vegetações se
formam a jusante e são à princípio estéreis (plaquetas e fibrina) que posterior/ se
tornam infectadas após uma bacteremia. Quando em câmara esquerda tem pio
prognóstico (maior tensão de O2, menor ação das drogas, maior chance de
embolização).
FISIOPATOLOGIA
Os sinais e sintomas dependem de: sitio da infecção, formação de complexos imunes e
reação de hipersensibilidade, focos infecciosos metastáticos, embolização a distancia
(territórios mais afetados são renal, esplênico, coronário e cerebral), processo
infeccioso e inflamatório.
MANIFESTAÇÕES CLÍNICAS
Nos casos agudos há mais sintomatologia. Nos casos subagudos, predominam
sintomas constitucionais, fadiga, astenia, anorexia, perda ponderal e sudorese
noturna. Mialgia e artralgia são comuns. Febre baixa, ocorre em quase todos os
pacientes, exceto idosos, imunocomprometidos, parcial/ tratados e com insuf renal
crônica. Sopros aparecem com freqüência ou são acentuados sopros pré-existentes
(exceto em endocardite mural ou tricúspide). Esplenomegalia, petéquias e
baqueteamento digital na doença avançada. Lesões de Janeway em palmas e
plantas(hemorrágicas). Nódulos de Osler, por imunocomplexos, em quirodáctilos e
pododáctilos. Manifestações neurológicas ocorrem por embolizações, aneurismas
micóticos , abscessos cerebrais, meningite purulenta. É comum insuficieniia cardíaca
congestiva pela destruição valvar. Infarto do miocárdio é decorrente de embolização
coronária. Glomerulonefrite, abscessos renais, vasculites e infartos levam a
insuficiência renal aguda.
DIAGNÓSTICO
Ao hemograma tem-se anemia normo/normo. Aumento da VHS. Na forma aguda, há
leucocitose com desvio à esquerda. A cultura é importante exame diagnostico.
A ecocardiografia permite visualização das vegetações e do comprometimento valvar e
miocárdico.
A doença deve ser suspeitada quando há febre há mais de uma semana associada a
sopro; em UDI com febre; em portadores de próteses valvares, com febre ou
descompensação aguda; em jovens com eventos neurológicos agudos.
Os critérios clínicos para diagnóstico são:
1) Maiores: evidencia de bacteremia prolongada (duas culturas + para organismo
tipicamente causador da endocardite ou organismo normalmente nãocausador mas
que aparece em todas as amostras)/ evidencia de vegetação ou abscesso miocárdico/
regurgitação valvar de inicio recente.
2) Menores: portador de lesão valvar ou UDI/ temperatura > 380C/ fenômenos vasculares
(embolia arterial, êmbolos pulmonares sépticos, aneurismas micóticos, hemorragias)/
fenômenos imunológicos (nódulos de Osler, glomerulonefrite)/ cultura positiva mas
que não preenche critério maior.
Mononucleose infecciosa
O vírus foi primeiramente encontrado no linfoma de Burkitt. O EBV faz parte da família
herpes-vírus e leva a infecção latente em linfócitos. O vírus está relacionado a
proliferação celular. No tegumento protéico a glicoproteína gp350 liga-se ao receptor
CD21 dos LB. Existem dois tipos de EBV e o tipo 2 infecta mais os linfócitos que o tipo
1.
EPIDEMIOLOGIA
80 – 90% da população adulta mundial é infectada. Baixo nível socioeconômico está
relacionado a contato precoce com a infecção. Transmissão: saliva de indivíduos com
infecção sintomática ou assintomática e hemoderivados.
PATOGÊNESE
Os linfócitos B humanos são susceptíveis a infecção. Indivíduos infectados no passado
eliminam o vírus pela saliva de forma intermitente e apresentam LB infectados de
forma latente no sangue e em órgãos linfáticos. A infecção inicial atinge as células da
orofaringe e LB da região. Após integração do vírus com a célula há produção de
proteínas virais, entre elas os antígenos nucleares EBNA1(mantém a forma epissomal
do vírus quando latente) e EBNA 2 (transformação de LB em linfoblastos que se
proliferam continuamente). São produzidos anticorpos contra o vírus, mas a principal
defesa do sistema imune são os LT citotóxicos e as células NK. Uma estratégia do vírus
para “enganar” o sistema imune é a produção da citocina EBV BCRF1. Esta é análoga a
interleucina 10, inibe e interferon gama, o que permite que a proliferação de LB
infectados pelo EBV ocorra.
QUADRO CLÍNICO
Crianças costumam ser assintomáticas. Adolescentes e adultos tem o quadro clinico
clássico. O PI é de 4 a 7 semanas.ao fim desse período o individuo se queixa de
sintomas inespecíficos, como mal estar, cefaléia, mialgia e fadiga por três a cinco dias.
Após isso aparece a febre, acompanhada de linfadenomegalia e faringite. A febre com
freqüência é vespertina, de 39 a 40ºC, e dura de 10 a 14 dias. A linfadenomegalia mais
comum é a cervical posterior bilateralmente. Ocorre faringite com aumento das
tonsilas, exsudato e peetequias em palato, semelhnate a faringite estreptococcica.
Exantema cutâneo de características variáveis, quando administrada ampicilina ou
betalactâmicos a incidência sobe para 90%. Outros sinais freqüentes são
esplenomegalia, hepatomegalia, icterícia e edema bipalpebral (sinal de Hoagland).
COMPLICAÇÕES
Hematológicas: anemia hemolítica auto-imune; trombocitopenia e neutropenia.
Ruptura esplênica: infreqüente, mas dramática, ocorre na segunda a terceira semana
quando há aumento rápido do órgão e infiltração da capsula, trabéculas e paredes
vasculares por linfócitos. Encefalites e meningites assépticas, há recuperação em 85%
dos casos. Nefrite intersticial (hematúria microscópica e proteinúria) e IRA.
Complicações cardíacas e pulmonares são raras. Há relatos de hepatite fulminante e
cirrose na vigência de co-fatores interferentes na infecção hepática.
DIAGNOSTICO LABORATORIAL
No hemograma: linfocitose relativa e absoluta e presença de linfócitos atípicos.
Neutropenia relativa e absoluta, com discreto desvio à esquerda. Trombocitopenia
leve e anemia. Aumento sérico das enzimas hepáticas (ALT, AST e DHL) e das
bilirrubinas mais raramente.
Anticorpos heterófilos: reagem com antígenos de superfície de eritrócitos de carneiro
e de cavalo, mas não com Ag de células renais de cobaia. Foram descritos por Paul e
Brunnell, e estão presentes na 1ª ou 2ª semanas, e se mantém por até seis meses após
a infecção. O teste que detecta os anticorpos heterófilos é o Monospot que é realizado
em três etapas. Soro do paciente reage com hemácias de cavalo. Havendo aglutinação,
contata-se a presença de anticorpos heterófilos. Em seguida o soro é misturado com
células renais de cobaia, que removem os antígenos não específicos para o EBV.,
seguido por hemácias de boi, as quais removem 25 a 75% dos anticorpos específicos
da MI. Caso esse teste seja negativo, faz-se as provas sorológicas para Ac específicos.
Esse teste é usado em adolescentes e adultos. Em crianças menores de cinco anos se
utiliza as provas específicas.
Anticorpos específicos: é a detecção de anticorpos IgM e IgG. anti EBNA(Ac contra
antígeno nuclear), anti VCA (Ac contra o antígeno do capsídeo viral) e anti EA(Ac contra
antígeno precoce). O mais usado é o anti VCA. O anti-EA é útil para diagnosticar
reativação ou infecção secundária. O anti-EBNA é usado para se detectar infecção
passada e reativação.
Pesquisa do vírus por biologia molecular: em casos em que a sorologia não é ssuficinte
para o diagnostico, como passagem de Ac maternos para o lactente ou no caso de
imunossuprimidos em que a sorologia não irá positivar. Detecta-se ácidos nucléicos
virais pelos métodos de PCR, PCR em tempo real, hibridização in situ e Southern
hybridization.
DIAGNOSTICO DIFERENCIAL
Toxoplasmose, rubéola, CMV,infecção aguda pelo HIV, hepatite A, brucelose,
linfomas, leucemias, intoxicação por drogas.
TRATAMENTO
Sintomático, com uso de paracetamol para alivio da febre e odinofagia. Repouso,
afastamento de esportes de contato e levantamento de peso, por risco de ruptura
esplênica traumática. Corticóides nos casos que complicam com obstrução de vias
aéreas por hipertrofia tonsilar, trombocitopenia grave e anemia hemolítica.
PREVENÇÃO
Precaução de contato e evitar doação de sangue.
TUBERCULOSE
Doença mais comum da humanidade, sofreu recrudescimento recente devido
pandemia do HIV, ampliação da miséria e aumento da longevidade (sendo os idosos
reservatórios do bacilo que se reativaram pela queda da imunidade característica da
senescência), fatores rebaixadores da imunidade somados a diminuição dos
investimentos em saúde e na rede pública de atenção básica. Outra variante
contribuinte para o sucesso do contágio foi a associação de aglomerados humanos
com subnutrição.
Controle da TB: pela busca de casos e tratamento efetivo. A busca é feita pela
baciloscopia, em todos os sintomáticos respiratórios (tosse e expectoração há três
semanas ou mais que chegam ao serviço de saúde). A baciloscopia também é realizada
nos contatos de tuberculosos e no acompanhamento mensal durante o tratamento. A
cultura deve ser feita em suspeita clinica e radiológica da TB, porem com baciloscopia
negativa; pesquisa de resistência e suspeita de TB extrapulmonar. O RX é usado nos
sintomáticos com baciloscopia negativa; nos comunicantes de doentes e em suspeita
de TB extrapulmonar. Há três esquemas de tratamento. O primeiro esquema é o
tratamento inicial que dura 6 meses, e quando há retratamento por recidiva ou
retorno pós abandono, acrescenta-se o etambutol (esquema 1R). O esquema 2 é feito
nos casos de meningoencefalite tuberculosa, dura 9 meses e inclui corticóides no
inicio. O esquema 3 é usada em caso de falência nos tratamentos anteriores.
ETIOLOGIA E TRANSMISSÃO
O Ag etiológico é o Mycobacterium tuberculosis, bacilo resistente à descoloração por
uma solução contendo álcool e ácido, o que é evidenciado pelo método de ZiehlNielsen. É aeróbio (por isso o pulmão é o órgão preferencial para a infecção e sua
ligação com o meio externo facilita o contágio) e aumenta sua replicação dependendo
da oferta de oxigênio, acesso a nutrientes e pH do meio. A transmissão é feita por via
aérea, e as partículas contaminantes são as partículas núcleo de Wells, de tamanho
ente 2 a 10 micras.
Aumentam as chances de transmissão: doença pulmonar, maior carga bacilífera,
presença de cavitação; doente em melhor estado geral (tosse mais vigorosa); grau de
parentesco e proximidade do doente; escarro mais fluido; baixa condição sócioeconômica e precárias condições de moradia; imunossupressão; condições de aeração
do ambiente.
Reduz-se a transmissão com o tratamento e a hipersensibilidade, que ocorre em países
com alta prevalência. Assim o tratamento auxilia no controle da doença por reduzir o
tempo de transmissão e quebrar a cadeia epidemiológica da doença.
PATOGENIA E IMUNIDADE
Chegando ao alvéolo, os bacilos se multiplicam livremente na fase de crescimento livre
ou simbiótica. As células de primeira linha na defesa são os macrófagos. A bactéria
desenvolve mecanismos de defesa para não ser fagocitada ou não ser destruída pelo
lisossomo, de forma a se reproduzir dentro dos macrófagos (parasitismo intracelular
facultativo). Caso o macrófago não seja capaz de deter o bacilo, por desconhecimento
(evitado pela vacina) ou depressão imunitária, polimorfonucleares se encarregam de
fazer fagocitose, porém não destroem o bacilo, fazendo sua disseminação pela
corrente sanguínea e propiciando o surgimento de formas extrapulmonares.
Dentro dos macrófagos, o bacilo se multiplica lentamente e após 12 semanas, há
ativação da resposta imune celular e conversão do teste tuberculínico. O macrófago
se rompe e libera os bacilos. Em indivíduos com competência imune, ocorre a
formação do granuloma, um aglomerado de macrófagos e linfócitos em torno dos
bacilos, o que contem a infecção. A lesão inicial é chamada cancro de inoculação. Os
bacilos podem deixar o interior do macrófago e migrar para os linfonodos hílares, que
enfartam-se, formando o complexo primário tuberculoso: cancro de inoculação,
linfangite e adenomegalia hilar, visualizado pelo RX de tórax. A partir dos linfonodos
hílares, os bacilos atingem a região superior do pulmão e outros órgãos como rins,
ossos e cérebro, locais com boa oferta de oxigênio e menor aporte de células de
defesa.
Os linfócitos T CD4 se diferenciam em duas subpopulações: TH1, responsável pela
inibição do crescimento do bacilo, e TH2, que junto com os linfócitos T CD8, provoca
destruição de células inativadas pelo bacilo.
Os bacilos se localizam no centro do granuloma e a periferia se torna fibrótica e
caseosa. Dentro do caseo, há baixa multiplicação, pois há baixa oferta de O2, mas os
bacilos permanecem viáveis. Dependendo da resposta imune, a infecção pode
progredir ou não. A doença acontece quando: 1)no primeiro contato há alta carga
bacilar e/ou baixa resposta imune; 2) após a infecção inicial há reativação endógena
(imunossupressão e/ou aparecimento de bacilos mutantes mais virulentos) ou
reinfecção exógena, com numero excessivo de bacilos, associada ou não há
imunodeficiência. A TB doença se caracteriza pela presença de sintomas e lesões
progressivas.
A produção de enzimas por estímulo da hipersensibilidade favorece o surgimento de
liquefação de lesões e leva a maior destruição tecidual. Após a liquefação do cáseo, há
aparecimento de cavidade e estas condições são favoráveis a multiplicação do bacilo.
O desenvolvimento de lesões cavitárias é característico da TB pós-primária. Delas se
propaga o material infeccioso eliminado pelo escarro.
CLÍNICA E DIAGNÓSTICO
Doença de evolução crônica, com sintomas indolentes e de intensidade crescente, com
períodos de remissão.
Sintomas respiratórios:
1) Tosse: no inicio seca, podendo se tornar produtiva, com expectoração mucosa e
purulenta em pequena quantidade, as vezes com sangue. Com duração de três
semanas ou mais. Queixa pouco valorizada em fumantes, e nestes casos, deve-se
pesquisar modificações deste sintoma.
2) Hemoptise: em estrias misturadas ao escarro (hemoptóicos), ou hemoptise maciça
(presença de cavitações, contendo aneurismas de Rasmussen).
3) Dispnéia: sintoma pouco comum, exceto quando há atelectasias, cavidades ou
intenso processo inflamatório. Aparece na doença avançada, em decorrência da
restrição causada pelo processo fibrótico, ou pela presença de derrame pleural ou
pneumotórax. Ocorre também na forma miliar (por comprometimento intersticial
difuso). Há padrão obstrutivo quando há doença das vias aéreas e por hiperresponsividade brônquica.
4) Dor torácica: quando há comprometimento da pleura. É sintoma freqüente,
precoce e de pequena intensidade.
5) Rouquidão: quando há acometimento da laringe.
Sintomas gerais:
1) Febre e sudorese: a multiplicação dos bacilos é mais intensa no pico plasmático de
cortisol (por volta das 11 às 12h, de acordo com o ritmo circadiano). Os
macrófagos se rompem e se inicia processo inflamatório. Por isso a febre tem
caráter vespertino. A sudorese é a resposta do organismo para controle da
temperatura. A multiplicação dos bacilos é lenta, o processo inflamatório não é
muito intenso, o que desencadeia temperaturas baixas. Muda o padrão da febre
quando há intensa disseminação hematogênica ou endobrônquica (altas
temperaturas, calafrios e não respeita o horário clássico).
2) Anorexia, perda ponderal, artralgia e mialgia.
Anamnese e exame físico: pesquisar fontes de contágio, doenças imunodepressoras,
estresse, etilismo, subnutrição e uso de drogas. Ao exame físico, sinais de consumpção
(emagrecimento, palidez); os sinais específicos são estertores, em geral apicais e
posteriores, roncos e sibilos no comprometimento brônquico, diminuição do
murmúrio vesicular e da broncofonia se houver derrame pleural, condensações na
pneumonia caseosa, e sopro anfórico nas cavidades. Hepatoesplenomegalia podem
aparecer nas formas disseminadas. Podem ocorrer reações de hipersensibilidade,
como o eritema nodoso.
Diagnostico diferencial: supurações broncopulmonares inespecíficas, neoplasias,
micoses profundas, doenças sistêmicas de acometimento pulmonar.
Diagnóstico por imagem: permite diagnóstico precoce e estudo da extensão das
lesões. É de auxilio quando a baciloscopia é negativa. As manifestações radiológicas se
dividem em TB primária e TB pós-primária.
TB primária: comum em crianças. Se apresenta com: opacidade
parenquimatosa (consolidação em lobos inferiores), linfonodomegalia, derrame
pleural, atelectasias(segmentar e lobar) e doença miliar.
TB pós primária ou de reativação: caracterizada por: opacidade
parenquimatosa e cavidade, doença de vias aéreas, doença pleural e tuberculoma. As
cavidades resultam de drenagem brônquica de material caseoso, derivado de necrose
do parênquima pulmonar. Estão relacionadas com maior transmissibilidade e maior
positivação da baciloscopia. A doença inativa ocorre quando há estabilidade
radiológica por no mínimo seis meses e repetidas culturas negativas de escarro.
Exames laboratoriais: diagnostico definitivo pela localização do agente etiológico.
Bacteriologia: utiliza-se escarro, lavado gástrico em crianças, escarro induzido
por inalação de solução salina hipertônica, broncoscopia (invasivo, porém útil no
diagnóstico diferencial) e aspirado transtraqueal. Visualiza-se o bacilo por meio da
coloração de Ziehl-Nielsen. É necessária uma carga bacilar mínima para que seja
positiva e detecta além do M. tuberculosis outras micobacterias e bactérias
inespecíficas. Como a incidência de micobacterias é baixa, o exame é seguro para a
instituição do tartamento.
Cultura: indicada em casos: 1) suspeitos, com baciloscopia negativa; 2) formas
paucibacilares ou extrapulmonares; 3) pacientes HIV+; 4) suspeita de micobacteriose
atípica; 5) retratamento após falência ou abandono; 6) recidiva; 7) casos resistentes as
drogas, com realização do teste de sensibilidade. Utiliza-se meio de Lowestein-jensen.
O tempo para crescimento é de 4 semanas. Sistemas de leitura radimétrica, como
bactec, utiliza meio liquido e Midlebrook e leva menos tempo para crescimento (15
dias) e permite realização simultânea de teste de sensibilidade.
Teste tuberculínico: após 2 a 10 semanas da infecçãoo, os linfócitos T são
sensibilizados pela presença do bacilo. A injeção do Ag tuberculínico leva a reação de
hipersensibilidade tardia, que se expressa com vasodilatação, edema, e aparecimento
de nódulo 48 a 72h após a injeção. O antígeno utilizado é o PPD, derivado protéico
purificado. É feita a injeção intradermica e o individuo é classificado como : não reator
(nódulo de 0 a 4 mm); reator fraco (nódulo de5 a 9 mm); reator forte, infectado,
doente ou não (nódulo de 10 ou mais mm).
Marcadores biológicos: são dosadas a adenosina-deaminase (ADA) e o ácido
tuberculoesteárico, sendo o ultimo útil no diagnostico de meningoencefalite
tuberculosa. O ADA é enzima liberada por linfócitos T ativados, que aumenta acima de
40UI/L na TB pleural. Também se eleva no empiema, linfoma, adenoca, artrite
reumatóide. ADA>40UI/L, clinica compatível com TB, liquido pleural exsudativo, com
predomínio de linfócitos>75% e ausência de células neoplásicas são critérios para
inicio da terapêutica antituberculosa.
TRATAMENTO
Principal ferramenta no controle da doença. É útil para diminuir a mortalidade, reduzir
a transmissibilidade e prevenção do adoecimento quando usado profilaticamente.
Bases bacteriológicas: as características do bacilo são importantes para entender o
tratamento. São elas: aerobiose estrita, multiplicação lenta e alta proporção de
mutantes resistentes. No interior do macrófago a multiplicação é lenta e as drogas de
melhor ação são RMP, PZA e EBM; nas lesões fechadas o crescimento é lento e
intermitente e a ação da droga é mais demorada, há chance de se formarem bacilos
persistentes e recaídas, e as drogas uteis nessa fase são a RMP(principalmente) e a
INH. Após a liquefação do cáseo, há multiplicação é acelerada e as melhores drogas
nessa fase são RMP, INH e SM(estreptomicina).
O M. tuberculosis tem resistência natural aos medicamentos, devido a mutações
genéticas, antes da exposição às drogas. Essa resistência é rara à RMP e freqüente à
PZA. Resistência pós-primaria ou adquirida é induzida por tratamentos irregulares,
com interrupção antes da completa esterelização dos germes ou com doses
inadequadas. Se esses bacilos são transmitidos à outros indivíduos sem tratamento
prévio, já passarão a ter resistência primaria.
Para prevenir a falência do tratamento por resistência adquirida, usam-se drogas de
alto poder bactericida na fase inicial (de ataque), com o objetivo de se reduzir
rapidamente a população bacilar, incluindo-se os mutantes resistentes, além de
permitir a eliminação dos bacilos com resistência primária (reduz a transmissibilidade,
a morbidade e a resistência adquirida). Na fase de manutenção da terapia, objetiva
eliminar os germes persistentes e prevenir recaídas. A associação de drogas potentes
reduz o aparecimento de resistência. As regras fundamentais do tratamento são: Boa
associação medicamentosa; tempo de tratamento adequado(adaptado em
imunodeprimidos, formas extrapulmonares, problemas na regularidade); regularidade
no tratamento (atenção especial aos pacientes com baixa adesão).
TUBERCULOSE EXTRAPULMONAR (TB EP)
Ocorre na primoinfecção, quando não se desenvolve imunidade especifica para conter
o bacilo. Ou pós primoinfecção com queda da resistência do hospedeiro para manter o
bacilo em sua localização primária. Os locais de acometimento freqüente são: córtex
cerebral, córtex renal extremidade de crescimento dos ossos longos, vértebras
adrenais, pleura e sistema linfático. As vias de disseminação são linfo-hematogenica
(maioria das TB EP), hematogênica, por contigüidade(pleura) e intracanalicular(vias
aéreas altas a partir do pulmão, sistema urinário inferior a partir do rim). A TB EP é
pobre em bacilos, de instalação insidiosa e de evolução mais lenta.
1) Pleural : forma mais comum.disseminação por contigüidade ou hematogênica. Ocorre
dor pleurítica insidiosa, tosse, febre e com o aumento do liquido pleural, dispnéia e
propedêutica de derrame pleural. O liquido pleural é exsudato, com predomínio de
mononucleares. O ADA tem boa acurácia. A biopsia da pleura mostra granuloma.
Pode ser autolimitada, mas deve ser tratada pelo risco de vir a se desenvolver a
doença pulmonar.
2) Ganglionar: é a 2ª forma mais freqüente, acomete mais a cadeia cervical anterior, mais
em mulheres.os gânglios a principio são indolores e moveis, posteriormente
aumentam de volume, coalescem e drenam material seroso a purulento. O diagnostico
é feito preferencialmente pela punção aspirativa do gânglio, mas também pode ser
feita a biopsia.
3) Miliar: ocorre principalmente em pacientes com baixa imunidade. A radiografia de
tórax mostra o infiltrado intersticial micronodular difuso bilateral. Granulomas em
material de biópsia.
4) SNC: acometimento grave, porém raro, aumento da incidência em imunodeprimidos,
PP/ por HIV. Há duas formas de manifestação: meningoencefalite e tuberculoma
intracraniano. Ocorre hidrocefalia, HIC, alteração do comportamento, nível de
consciência diminuído, sinais de irritação meníngea, tubérculos coróides e edema de
papila de retina. O LCR apresenta pleocitose, predomínio de linfomononucleares. O
ADA é importante na diferenciação de outras meningoencefalites.
5) Renal: 3ª forma mais freqüente. Apresenta o maior período de latência. Ocorre
hidronefrose nas fases mais avançadas. A baciloscopia raramente é positiva. A cultura
de urina (meio Lowestein-Jensen) é o exame mais importante, feito com no mínimo
cinco amostras matinais, em dias consecutivos.