1
NEOPLASIA CARDÍACA SECUNDÁRIA AO MELANOMA MALIGNO: ESTUDO
INVESTIGATIVO
DE
POSSÍVEL
METASTATIZAÇÃO
EM
PACIENTES
ACOMETIDOS DE TUMOR MELANOCÍTICO ATENDIDOS NO HOSPITAL
VETERINÁRIO DA UNIVERSIDADE METODISTA DE SÃO PAULO.
1 Introdução
Com a expectativa de vida dos animais de estimação aumentando a cada dia,
a prevalência de câncer e problemas cardíacos nos mesmos está subindo a cada
dia.
Um estudo realizado nos Estados Unidos afirmou que em duas mil necrópsias
realizadas 45% dos cães que viveram até 10 anos ou mais de idade morreram de
câncer. Sem definição de idade 23% dos pacientes necropsiados
vieram a óbito devido algum tipo de tumor. Outra pesquisa realizada em 2005 por
Mark Morris (Foundation Animal Health Survey) revelou que o câncer é a maior
preocupação entre os proprietários de animais de estimação (41%) seguido de
doença cardíaca (7%) (WITHROW, 2007).
Devido o aumento e progresso no tratamento do câncer humano os
proprietários de animais vêem-se cada vez mais otimistas em relação aos
tratamentos
dedicados
também
aos
pacientes
veterinários.
Alguns
proprietários consideram seus animais de estimação mais importantes que qualquer
contato humano, então, devido a isso, os donos dos pacientes estão buscando cada
vez mais informações e tornando-se muito exigentes em relação à saúde dos
animais, não medindo esforços e custos para qualquer tipo de tratamento.
Sendo assim, os médicos veterinários precisam estar capacitados para o
atendimento, tratamento e possível cura da referida enfermidade.
O Melanoma Maligno é uma neoplasia extremamente agressiva, com alto
potencial metastático e que cada vez mais acomete os animais domésticos.
Quando um animal está acometido por qualquer tipo de câncer, inclusive o
Melanoma, pensa-se em investigar metástases em várias regiões anatômicas:
pulmão, fígado, intestino; o coração é o último órgão a pensar em uma possível
metástase.
Neoplasias cardíacas são pouco estudadas e diagnosticadas por médicos
veterinários. É muito importante ter a ideia de que o coração pode ser um possível
foco metastático para que, com tratamentos adequados, melhore-se a qualidade de
vida do paciente (atenuando os sinais clínicos) ou, dependendo do caso, ocorra uma
possibilidade de cura.
Objetiva-se com o presente trabalho identificar o coração como um possível
foco metastático do Melanoma Maligno. Além disso, deseja-se ressaltar a
importância de fazer-se uma boa anamnese, exame físico para identificação de
sinais referentes a afecções cardiológicas e realização de diversos exames
complementares, principalmente o ecocardiograma.
Para a realização deste trabalho fez-se a compilação e análise dos
prontuários dos pacientes acometidos de neoplasias melanocíticas que foram
atendidos no Hospital Veterinário da Universidade Metodista de São Paulo e
diagnosticados no Laboratório de Histopatologia da Faculdade da Saúde - UMESP
(Serviço de Patologia do HOVET-UMESP) de maio de 2001 a março de 2011.
2
2 Revisão de Literatura
2.1 Anatomia e Fisiologia Cardíaca
O coração é um órgão central o qual bombeia sangue para todo o organismo
através dos vasos sanguíneos, devido sua contração rítmica (DYCE et al., 1997).
Em animais adultos ele é constituído por 4 câmaras: átrio e ventrículos
esquerdos e átrio e ventrículo direitos; os átrios são separados entre si por septos
internos, bem como os ventrículos; entretanto o átrio e ventrículo de cada lado
comunicam-se através de válvulas específicas de cada lado (DYCE et al., 1997).
O tamanho do coração varia entre as raças e espécies; nas espécies e raças
menores o coração é relativamente maior (DYCE et al., 1997).
A estrutura, forma e posição do coração são semelhantes entre os mamíferos
(DYCE et al., 1997).
O pericárdio envolve o coração quase que completamente e adapta-se ao seu
redor com perfeição; ele constitui-se em um saco seroso fechado profundamente e
invaginado pelo coração sendo que sua luz fica reduzida a uma fenda capilar. Nesse
espaço há um líquido seroso em quantidade exata para que haja movimentação da
parede do coração contra este revestimento. O pericárdio possui duas lâminas:
parietal e visceral; estas se prolongam entre si em uma reflexão complexa a qual
segue sobre os átrios e as raízes dos grandes vasos; a lâmina visceral pode ser
chamada de Epicárdio e fica perfeitamente aderida a parede do coração tornando-se
um componente da mesma. A lâmina parietal possui um espesso revestimento
fibroso externo. Este componente fibroso impede uma distensão significativa em
curto prazo; entretanto pode distender-se por períodos mais longos como se o
coração dilatar-se por exercícios, enfermidade ou acúmulo de efusão ou pus na
cavidade pericárdica (DYCE et al., 1997).
O coração envolto pelo pericárdio está incluído no mediastino; tem o formato
cônico e está situado de modo assimétrico no tórax com uma parte maior (em torno
de 60%) à esquerda do plano mediano. A base divide em duas partes a primeira
costela, é dorsal e chega aproximandamente até o plano horizontal; algumas
espécies, por exemplo, canina, inclina-se num grau variável, voltando-se
craniodorsalmente. O ápice fica localizado junto ao esterno e é oposto à sexta
cartilagem costal; o eixo longitudinal une o centro da base ao ápice e inclina-se
caudoventralmente com um pequeno desvio para a esquerda devido à orientação
inclinada. O coração projeta-se na parede torácica entre a terceira e sexta costelas;
sendo assim, grande parte do coração fica coberta pelos membros anteriores (DYCE
et al., 1997).
Há uma incisura cardíaca na borda ventral de cada pulmão a fim de que o
coração tenha um contato restrito com a parede torácica (ocorre um maior contato
no lado esquerdo devido sua posição assimétrica) (DYCE et al., 1997).
O nervo frênico atravessa cada superfície lateral correspondente ao mesmo
(DYCE et al., 1997).
À união dos átrios esquerdo e direito (em forma de U) desemboca a origem
da aorta; essa união é interrompida craniossinistramente em que cada átrio termina
em um apêndice cego livre denominado aurícula; esta se sobrepõe à origem do
tronco pulmonar (DYCE et al., 1997).
3
Os ventrículos são a maior parte do coração; são mais firmes devido à
espessura das paredes serem maiores. Um esqueleto fibroso separa a massa
muscular da atrial, entretanto este não é visto externamente (DYCE et al., 1997).
Figura 1 Vista anterior do coração direito.
Fonte: (ANATOMIA e fisiologia do coração, s.d.).
4
Figura 2 Vista anterior do coração direito.
Fonte: (ANATOMIA e fisiologia do coração, s.d.).
O ventrículo direito possui parede mais delgada e cerca de um terço da
massa do ventrículo esquerdo. A sístole do ventrículo esquerdo também ocorre para
ajudar a ejeção do ventrículo direito (MELBIN; DETWEILER, 1996).
O ventrículo esquerdo possui a valva atrioventricular esquerda (bicúspide ou
mitral) a qual facha o óstio atrioventricular; esta possui duas cúspides principais; ste
ventrículo abriga a saída para a aorta que assume uma posição mais central no
coração; o ventrículo direito possui a valva atrioventricular direita (tricúspide) cuja
possui três cúspides que se unem em um anel fibroso o qual circunda a abertura;
neste ventrículo dá-se a abertura do tronco pulmonar o qual se situa em um nível
mais dorsal que o óstio atrioventricular e é craniossinistra à origem da aorta; esta
abertura é fechada durante a diástole (relaxamento ventricular) devido ao refluxo
sanguíneo; este fato força a valva pulmonar (formada por três cúspides que se
originam ao redor da borda da abertura) (DYCE et al., 1997).
5
Figura 3 Valva tricúspide.
Fonte: (ANATOMIA e fisiologia do coração, s.d.).
Cada cúspide é unida pelas cordas tendíneas compostas por estrias fibrosas;
estas descem pela cavidade ventricular e inserem-se em projeções das paredes que
são os músculos papilares. Frequentemente há presença de três músculos e as
cordas tendíneas são dispostas a ligarem cada cúspide a dois músculos e cada
músculo a duas cúspides; este arranjo impede a eversão das cúspides para o átrio
durante a contração ventricular (sístole) (DYCE et al., 1997).
Cada cúspide é unida pelas cordas tendíneas compostas por estrias fibrosas;
estas descem pela cavidade ventricular e inserem-se em projeções das paredes que
são os músculos papilares. Frequentemente há presença de três músculos e as
cordas tendíneas são dispostas a ligarem cada cúspide a dois músculos e cada
músculo a duas cúspides; este arranjo impede a eversão das cúspides para o átrio
durante a contração ventricular (sístole) (DYCE et al., 1997).
6
Figura 4 Sístole ventricular.
Fonte: (ANATOMIA e fisiologia do coração, s.d.).
7
Figura 5 Diástole ventricular.
Fonte: (ANATOMIA e fisiologia do coração, s.d.).
As valvas pulmonares e aórticas fecham-se durante o relaxamento ventricular;
a contração ventricular fecha as valvas atrioventriculares (DYCE et al., 1997).
O fechamento das valvas produz sons diferentes que são audíveis durante a
auscultação; Em regra geral as valvas pulmonares, aórtica e atrioventricular
esquerda são mais audíveis quando auscultadas sobre a terceira, quarta e quinta
costela do lado esquerdo; a valva atrioventricular direita sobre a quarta costela do
lado direito; a natureza dos sons fornece informações importantes sobre as
condições das valvas. Pode-se utilizar a percussão como método de avaliação do
tamanho do coração; entretanto o limite da área cardíaca não é definido com
perfeição devido à espessura do tecido pulmonar que cobre o coração mudar de
forma gradativa em torno da incisura cardíaca (DYCE et al., 1997).
Os átrios possuem a parede delgada; são um reservatório elástico e
conduzem o leito venoso para os ventrículos, executam uma ação bombeadora
propulsiva em que intensificam o enchimento ventricular e mantem baixa a pressão
atrial média além de promoverem o fechamento da valva atrioventricular antes que
ocorra a sístole ventricular; se os átrios pararem de contraírem-se e ocorrer a perda
da bomba atrial, o enchimento dos ventrículos continuam e estes funcionam de
modo razoável em condições de repouso (MELBIN; DETWEILER, 1996).
No átrio direito desembocam as principais veias sistêmicas: veia cava caudal
e cranial; o átrio esquerdo recebe veias pulmonares (DYCE et al., 1997).
8
O ventrículo direito ejeta sangue para a circulação pulmonar e este retorna
para o átrio esquerdo; neste o sangue passa para o ventrículo esquerdo; através da
circulação sistêmica o ventrículo esquerdo fornece sangue para o corpo todo (todos
os órgãos e sistemas). Então o sangue retorna para o átrio direito e após para o
ventrículo direito para fechar o ciclo (MELBIN; DETWEILER, 1996).
Figuras 6 Anatomia cardíaca.
Fonte: (ANATOMIA e fisiologia do coração, s.d.).
As circulações pulmonar e sistêmica estão ligadas em série; o fornecimento
sanguíneo pela circulação sistêmica para os vários órgãos é realizado por uma
distribuição em paralelo; os dois ventrículos, funcionalmente, estão ligados em série
(exceto por um pequeno desvio brônquico); sendo assim os débitos e fluxos
equilibram-se em estado de repouso (exceto por alguns instantes devido ao desvio
brônquico); este equilíbrio é preservado mesmo que haja ampla variação no débito
(como por exemplo durante um exercício cansativo); se houver prejuízo no equilíbrio
por disfunção cardíaca ocorrerá uma presença evidente de sinais clínicos de
desconforto respiratório devido ao acúmulo de fluídos nos pulmões (MELBIN;
DETWEILER, 1996).
Devido às baixas pressões nos átrios mesmo com aumento médio na pressão
intrapericárdica (resultante de efusões inflamatórias e hemorragias, por exemplo)
podem comprometer ou mesmo interromper o enchimento dos ventrículos
resultando em tamponamento cardíaco; também podem reduzir seriamente ou
mesmo acabar com o débito cardíaco (MELBIN; DETWEILER, 1996).
O suprimento sanguíneo realizado ao coração é conduzido pelas artérias
coronárias; estas se originam em dois dos três seios acima das cúspides
9
semilunares no início da aorta; 80% do volume sanguíneo total do corpo de um cão
passam pelo coração (DYCE et al., 1997).
Figura 7 Artérias, artérias coronárias, veias do coração.
Fonte: (ANATOMIA e fisiologia do coração, s.d.).
10
A contração cardíaca coordenada é primordial para um bombeamento eficaz;
quando a contração de fascículos musculares não tem sincronia ocorre a fibrilação;
este tipo de contração é ineficaz e fatal quando envolve a musculatura ventricular
(DYCE et al., 1997).
O nodo sinoatrial é o marcapasso do coração; dele normalmente difunde-se a
onda de excitação para todas as partes do músculo; na normalidade sua descarga é
determinada pelo tênue equilíbrio de entradas simpáticas aceleradoras e vagais
atenuadoras; quando descarregado por estímulos esternos tem o nível máximo de
atividade espontânea. A onda de excitação difunde-se do nodo sinoatrial para o
atrioventricular, situado no septo interatrial que não responde imediatamente a fim
de concluir a contração atrial; do nodo AV, o potencial de ação chega ao feixe
atrioventricular (feixe de His), que é a única conexão elétrica entre os átrios e os ventrículos
difundindo-se para a musculatura ventricular (as miofibras condutoras - fibras de
Purkinje - conduzem rapidamente o potencial de ação, primeiro para o ápice do
ventrículo e após para o restante do miocárdio ventricular. O fluxo sanguíneo tem
relação com estas atividades; o sangue entra nos átrios quando a pressão no interior
das veias é maior que a pressão no interior do coração (DYCE et al., 1997).
Figura 8 Esquema da condução elétrica cardíaca.
Fonte: (ANATOMIA e fisiologia do coração, s.d.).
11
2.2 Melanoma Maligno
O melanoma é uma neoplasia proveniente da proliferação maligna dos
melanócitos os quais são células que produzem um pigmento chamado melanina
(SOUZA et al., 2009).
Ocorre por uma proliferação atípica de melanócitos o que desencadeia no
aparecimento de lesões hiperpigmentadas de coloração cinza ao negro ou do
vermelho ao roxo (MARTA et al., 2006); pode-se também ser caracterizado como
amelanocítico em que pouca ou nenhuma melanina é produzida devido à falta de
diferenciação das células tumorais; neste caso o diagnóstico poderá ser difícil
(SANTOS et al., 2005).
As células das cristas neurais diferenciam-se em melanoblastos durante o
período embrionário; estes, por sua vez, migram para a epiderme para, enfim,
originarem os melanócitos (MOORE; PERSAUD, 1994).
Os melanócitos são responsáveis pela produção de um pigmento de
coloração marrom - escura chamada melanina; esta atua na proteção do organismo
contra os raios ultravioletas, pois os grânulos de melanina localizados na região
supranuclear formam um capuz protetor para o DNA das células epiteliais
(JUNQUEIRA; CARNEIRO, 1999).
Segundo Almeida (1999) as células melanocíticas possuem prolongamentos
dendríticos que se estendem até a epiderme entre as camadas basal e espinhosa
depositando a melanina.
Os melanócitos começam a produção de melanina antes do nascimento
sendo que este pigmento é depositado nas células das camadas basal e espinhosa
da epiderme (MOORE; PERSAUD, 1994).
Os hormônios melanotróficos (MSH, hormônio estimulante dos melanócitos),
produzido pela adeno-hipófise, e o hormônio melatonina são responsáveis pela
distribuição da melanina e estimulação da produção da mesma (ALMEIDA, 1999).
O estabelecimento do melanoma está envolvido em diversas etapas, até que,
enfim, forma-se um tumor invasivo e metastático; esta é uma neoplasia de pior
prognóstico, com alta incidência de metástases sendo mais comum em cães do que
em gatos (MANZAN et al., 2005).
Em canídeos há uma maior incidência em animais como o Boxer, Cocker
Spaniel, Springer Spaniel, Terrier Escocês, Airedale, Boston Terrier, Golden Retriver,
Setter Irlandês, Schnauzer miniatura, Doberman, Pincher, Chihuahua, Chow Chow
(SCOTT et al., 1996). É sugerido que animais com hiperpigmentação tenham uma
chance maior de serem acometidos por esta neoplasia (FERRO et al., 2004).
Nos gatos não há predileção para raça ou sexo (SCOTT et al., 1996).
Em cães o melanoma afeta principalmente animais mais velhos entre 7 e 14
anos de idade e em gatos a média é de 8 anos (DOBSON; MORRIS, 2001).
Os melanomas são relativamente comuns em cães, ocorrem em 3% de todas
as neoplasias e 7% de todas as neoplasias malignas (CAVALCANTE, 2006).
As lesões são geralmente solitárias, variavelmente circunscritas, em forma de
cúpula, placa ou polipóide e coloridas (cinza, marrom ou preta) (SCOTT et al.,
1996).
Os tumores melanocíticos malignos podem atingir maiores dimensões, conter
menos pigmentos e até ulcerar; são frequentemente lesões de crescimento lento
que seguem um curso (DOBSON; MORRIS, 2001). Este tumor pode também
12
apresentar uma superfície, além de ulcerativa, macular com bordas assimétricas e
irregulares (MARTA et al., 2006).
Os melanomas originam-se em locais que as células precursoras são
numerosas e podem ser encontrados em qualquer localização anatômica onde
existam acúmulos de melanócitos (SANTOS et al., 2005).
Santos et al. (2005) dizem que uma falha na síntese de melanina estimula a
atividade melanoblástica associada à transformação neoplásica e acarreta em uma
perda de pigmentação progressiva.
As E-Caderinas são proteínas de adesão celular produzidas pelos
melanócitos e queratinócitos e enviadas para suas respectivas membranas
plasmáticas, afim de que promovam a adesão e união entre as referidas células.
Através das E-Caderinas os queratinócitos dominam os melanócitos. A diminuição
da síntese de E-Caderinas e produção de outro tipo de molécula de adesão da
mesma família, conhecida como N-Caderina, promovem um processo de
transformação pelo qual passam os melanócitos para se tornarem cancerígenos
(MANZAN et al., 2005).
As N-Caderinas possuem uma diferença específica de ligação: não se unem
mais aos queratinócitos e sim a outras células do tecido epitelial. Sendo assim, é
observada uma inversão no processo: os melanócitos antes controlados pelos
queratinócitos começam, dessa forma, comandar o funcionamento dos fibroblastos,
células endoteliais e inflamatórias (MANZAN et al., 2005).
Citologicamente observa-se um núcleo com variações de tamanho nas
células tumorais além de alterações na sua proporção comparada com o citoplasma.
O núcleo geralmente é hipercromático. Mas, alguns núcleos podem ser
hipocromáticos, com aspecto vesiculoso e possuir cromatina frouxa. Os nucléolos
também podem variar em número e tamanho (MANZAN et al., 2005).
Algumas células podem ser binucleadas e o número de mitoses é mais
abundante (JUNQUEIRA; CARNEIRO, 1999).
O citoplasma das células cancerosas normalmente é basófilo, devido à maior
quantidade de ribossomos; essa é uma característica de células em proliferação.
Células advindas do melanoma invasor podem ser ligeiramente mais basófilas que
as células normais (MANZAN et al., 2005).
Manzan, et al. (2005) notaram também uma quantidade de proteínas mais
intensa ao redor das células em invasão.
A célula cancerosa possui proliferação exacerbada, perde a capacidade de
aderência, secreta enzimas (que atingem a matriz extracelular maleficamente),
invade os tecidos vizinhos, penetra nos vasos sanguíneos e linfáticos e espalha-se
pelo organismo, estabelecendo-se e proliferando em locais distantes de sua origem,
onde produz tumores secundários (MANZAN et al., 2005).
As células tumorais melanocíticas podem dispor em estruturas como nos
epitélios, ao redor dos vasos ou mesmo de maneira difusa (MANZAN et al., 2005).
O melanoma possui dois tipos de crescimento da massa tumoral: o radial e o
vertical. O crescimento radial está relacionado com o crescimento do melanoma de
modo horizontal no interior das camadas epidérmicas e dérmicas; ocorre na maioria
das lesões por um longo período. Nessa fase, as células do melanoma não tem a
capacidade de metastatizar-se. Após, o padrão de crescimento assume um
componente vertical, quando o melanoma cresce para baixo, penetrando nas
camadas dérmicas mais profundas na forma de uma massa em expansão, porém
sem maturação celular, sem tendência das células tornarem-se menores à medida
que descem para a derme reticular (MANZAN et al., 2005).
13
Figura 9 Histopatologia do melanoma em mucosa oral. Em A, aspecto normal do
epitélio pavimentoso estratificado queratinizado; em B nota-se lâmina própria com
conjuntivo de natureza frouxa próximo ao tecido epitelial; em C vê-se início do
processo invasivo das células provenientes do melanoma maligno; a figura D mostra
a mesma região em maior aumento. Observam-se células invasivas pigmentadas
invadindo o estroma tecidual; em E a lâmina própria conjuntiva está totalmente
invadida por células cancerígenas extremamente pigmentadas; finalmente na figura
F o tecido maligno pigmentado está ao lado do tecido conjuntivo saudável, no limite
entre a massa tumoral invasora.
Fonte: (MANZAN et al., 2005).
O conhecimento das características histológicas e histoquímicas do
melanoma é muito importante e pode levar a formas mais eficientes e seguras de
diagnóstico e tratamento (CAVALCANTE, 2006).
Macroscopicamente, o melanoma é visualizado inicialmente como uma
mácula preta que se transforma em massa firme, de rápido crescimento, com
infiltração local e metástase precoce. Contudo, o tamanho e grau de pigmentação
não são indicadores reais do potencial de malignidade das neoplasias melanocíticas
(SANTOS et al., 2005).
14
Melanomas profundamente invasivos podem mestastatizarem-se com
freqüência (SANTOS et al., 2005).
Em sua maioria, quando se diagnostica o Melanoma Maligno, poucos meses
após a cirurgia de retirada do tumor, ocorre a morte do indivíduo devido a
complicações relacionadas à metástase (SANTOS et al., 2005).
De acordo com Manzan, et al. (2005) o melanoma é assintomático, mas o
prurido pode ser uma manifestação inicialmente.
O reaparecimento da doença depois da recuperação aparentemente completa
e a metástase são comuns. Em estudos realizados a partir de Melanomas de pele
em cães que foram tratados cirurgicamente, os animais em que o tumor era
pequeno apresentaram uma média de sobrevivência de 12 meses e porcentagem de
óbito de 54% dentro de dois anos; já os que apresentavam uma neoplasia grande,
obtiveram um tempo médio de sobrevivência de quatro meses e uma porcentagem
de óbito de 100% dentro de dois anos. Os cães com Melanomas orais tratados
cirurgicamente apresentaram um tempo de sobrevivência de três meses em média
(MANZAN et al., 2005).
O Melanoma é um dos tumores de pior prognóstico e com alta incidência de
metástases para os gânglios linfáticos locais e através do sangue para os órgãos
tais como pulmões, medula, fígado, cérebro, pele e, muitas vezes, o coração
(DOBSON E MORRIS, 2001; MANZAN et al., 2005; E MARTA et al., 2006) sendo a
taxa de sobrevivência de um ano é inferior a 10% dos casos (SANTOS et al., 2005).
15
2.3 Metástases
Metástase é a transferência de uma neoplasia de um órgão para outro que
não está conectado diretamente ao primeiro (de origem), não tem relação direta com
o foco primário. Nos tumores malignos esse evento ocorre devido à transferência de
células. A disseminação generalizada de tumores torna o tratamento de remoção
cirúrgica combinada à irradiação ineficaz (FRANKS; TEICH, 1990; E INCA, 2002).
A metástase de uma neoplasia é o principal problema na prática dos
tratamentos e uma das causas mais comuns de morte devido a um tumor (FRANKS;
TEICH, 1990).
As neoplasias secundárias são relativamente comuns em relação às primárias
(CAVALCANTE, 2006).
O aspecto das neoplasias metastáticas difere de acordo com o tipo de
neoplasia tais como: nódulos escuros císticos contendo sangue são indicativos de
Hemangiossarcoma, já nódulos escuros e sólidos indicam Melanoma e nódulos
duros com espículas ósseas indicam Sarcoma osteogênico (CAVALCANTE, 2006).
Para que ocorra metástase a neoplasia deve conseguir invadir e degradar a
matriz extracelular do seu local de origem. Além disso, esta precisa também penetrar
nas membranas basais das paredes dos vasos e invadir o lúmen dos mesmos, logo
após, albergar-se em um novo sítio; precisa que haja retrocesso do processo, ou
seja, as células neoplásicas precisam emigrar dos capilares e invadir o tecido de um
novo local. Receptores de superfície celular estão envolvidos nesse processo e
reagem com componentes da matriz extracelular e membranas basais tais como:
colágeno, laminina e fibronectina (JONES; HUNT; KING, 2000).
Durante a invasão do local, pode ocorrer a penetração das células
neoplásicas no sistema linfático e, com isso, as mesmas são levadas até os
linfonodos da região onde ficarão retidas. Algumas células podem ser destruídas,
mas outras podem crescer e produzir novos tumores (FRANKS; TEICH, 1990).
A disseminação neoplásica é um processo complexo e pode ser
resumidamente dividida em cinco etapas (INCA, 2002):
1) invasão e infiltração de tecidos subjacentes por células tumorais devido a
penetração em pequenos vasos linfáticos e sangüíneos(INCA, 2002);
2) liberação na circulação de células neoplásicas, isoladas ou mesmo na
forma de pequenos êmbolos (INCA, 2002);
3) sobrevivência dessas células na circulação(INCA, 2002);
4) retenção nos leitos capilares de órgãos distantes (INCA, 2002);
5) extravasamento dos vasos linfáticos ou sangüíneos,e, a seguir,
crescimento das células tumorais disseminadas (INCA, 2002).
O tumor primário para metastatizar-se deve ser bem sucedido na proliferação
e ter uma boa resistência em apoptose (ARGYLE; KHANNA, 2007).
A maioria, se não todos os cânceres, adquirem o mesmo conjunto de
capacidades funcionais durante seu desenvolvimento para metastatização, através
de múltiplos mecanismos e estratégias (ARGYLE; KHANNA, 2007).
Após o extravasamento do tumor no espaço vascular, as células precisam
sobreviver muitas vezes em um microambiente hostil do órgão de destino. Para que
a sobrevivência seja bem sucedida há um requerimento da modulação desse
microambiente secundário, através do recrutamento de células do estroma do local,
da produção de fatores de crescimento e também de angiogênese (ARGYLE;
KHANNA, 2007).
16
Figura 10 Esquema de formação de metástases.
Fonte: (BORGES, 2006).
Células tumorais que podem metastatizar-se secretam enzimas variadas
(colagenases, elastases, proteinases, peptidades, plasmina) que degradam o
colágeno em membranas basais e matriz extracelular além de vários componentes
glicoprotéicos (JONES; HUNT; KING, 2000).
Tais enzimas possuem ações hidrolíticas e desencadeiam a clivagem de um
trajeto a fim de que ocorra a migração de células neoplásicas pelo tecido conjuntivo
intersticial de prováveis novos locais, os quais poderão ou não, serem colonizados
pelas células (JONES; HUNT; KING, 2000).
Ao longo de todo o processo de metastatização, fatores mecânicos e
imunológicos devem ser superados pelas células neoplásicas a fim de que as
mesmas consigam albergar-se em um novo órgão e terem crescimento autônomo
em relação ao tumor primário (INCA, 2002).
Os tumores podem disseminar-se através de três vias principais (INCA,
2002):
Transcavitária - podem também serem chamadas de transcelômicas e
ocorrem quando células de um tumor maligno penetram em alguma cavidade
corporal, crescendo e disseminando-se. As cavidades a peritoneal e pleural
são as mais afetadas, entretanto a pericárdica, subaracnóidea e articular
podem também ser atingidas (INCA, 2002);
Linfática - as neoplasias de origem epitelial geralmente iniciam sua
disseminação através das metástases linfáticas, podendo também ser
utilizadas por outros tipos de tumores. As células neoplásicas seguem a
drenagem linfática normal da área do tumor primário, ocupando os linfonodos
mais próximos e também os que recebem maior número de vasos linfáticos
aferentes. A disseminação linfática do câncer de pulmão, por exemplo, invade
17
inicialmente os linfonodos mediastinais e, subseqüente os supraclaviculares e
cervicais. Os canais linfáticos oferecem pouca resistência à
penetração das células tumorais em tecidos além de serem a rota mais
comum para a entrada de células neoplásicas na circulação. Por um tempo
indeterminado é possível que os linfonodos consigam impedir a disseminação
das células tumorais, pois, quando tais células chegam aos mesmos, elas
entram em contato com células do sistema imunológico e, por isso, podem ser
destruídas. Entretanto, se conseguirem resistir e encontrarem condições
favoráveis para sua permanência e vitalidade, poderão se multiplicar (INCA,
2002; E ARGYLE; KHANNA, 2007);
Sangüínea - As células tumorais invadem os vasos sangüíneos iniciando,
assim, as metástases por via hematógena. As veias e vênulas, devido suas
paredes menos resistentes, são mais facilmente penetradas do que artérias e
arteríolas. As metástases por via arterial podem ocorrer, por exemplo, quando
células metastáticas invadem o leito capilar pulmonar, quando conseguem
atravessar comunicações arteriovenosas ou quando as próprias metástases
pulmonares fazem o papel de um foco de novas células tumorais capazes de
metastatizar-se. Os órgãos que mais comprometidos por esse tipo de
disseminação no organismo são os mais vascularizados como o pulmão e
fígado, contribui para isso o fato deles receberem, respectivamente, grande
volume de sangue procedente das circulações cava e porta, ossos e cérebro.
O coração também pode ser acometido por esse tipo de disseminação (INCA,
2002).
Figura 11 Principais eventos da cascata metastática.
Fonte: (INCA, 2002).
18
A distribuição das metástases pode variar; ela depende principalmente do tipo
histológico e da localização do tumor primário. O primeiro leito capilar que as células
metastatizadas encontram é o local mais comum de metástases de vários tipos
histológicos. O câncer de pulmão metastatizando para o sistema nervoso central e o
câncer de cólon para o fígado são exemplos desse evento. No entanto, as células
tumorais circulantes parecem preferir locais específicos, como, por exemplo, o
câncer de próstata que se metastatiza para ossos. Este fato pode se denominado
tropismo seletivo em que ocorre um processo de correlação mais íntima entre a
célula tumoral e o órgão-alvo (INCA, 2002).
Para a maioria dos tumores sólidos o aparecimento de um único nódulo
metastático é logo seguido pelo desenvolvimento de novas metástases dentro do
mesmo órgão alvo e/ou sítios terciários (ARGYLE; KHANNA, 2007).
É improvável que todos os sítios metastáticos emerjam a partir de clones
distintos e únicos do tumor primário; é bem provável que também desenvolvam
metástases de outros sítios metastáticos (ARGYLE; KHANNA, 2007).
Hipoteticamente, um pequeno número de clones de sucesso podem colonizar
locais distantes. Estes clones fazem com que novas metástases obtenham êxito;
então o processo de metástase continua, resultando em metástase de metástases
(ARGYLE; KHANNA, 2007).
Então essa hipótese, o processo de metástase de metástases, sugere que
todas as etapas da cascata metastática ocorrem continuamente, tanto antes como
após a detecção de metástases em pacientes (ARGYLE; KHANNA, 2007).
A metástase sempre deve ser vista como um novo tumor, diferente do
primário, com autonomia ampla para seu crescimento e propagação (INCA, 2002).
Teoricamente, todos os tumores malignos podem metastatizar para o
coração. Os mais comuns de metastatização são os carcinomas de pulmão, mama,
do esôfago, linfoma e melanoma malignos. As taxas relativas de metastatização são
maiores nos melanomas, e, a seguir, os linfomas (MONTEIRO, s.d.).
As metástases cardíacas são diagnosticadas raramente ante - mortem porque
na maioria dos casos são clinicamente silenciosas; aparecem de preferência em
doenças oncológicas disseminadas (MONTEIRO, s.d.).
Metástases no coração são geralmente definidas como sendo uma
disseminação tumoral à distância para qualquer uma das estruturas cardíacas
(pericárdio, epicárdio, miocárdio, endocárdio, grandes vasos e artérias coronárias), e
também disseminações tumorais que afetam as cavidades do coração ou produzem
trombo neoplásico intra - cavitário (MONTEIRO, s.d.).
O miocárdio e o
pericárdio são os
locais de predileção para o
desenvolvimento do sítio secundário de um tumor (DOBSON; MORRIS, 2001).
Os tumores que mais frequentemente estão relacionados ao pericárdio são o
mesotelioma, e os carcinomas do pulmão e próstata. O epicárdio foi mais envolvido
por melanoma, carcinoma escamoso do pulmão e o broncoalveolar. O miocárdio
sediou mais os melanomas. Já o endocárdio foi afetado com mais freqüência em
melanomas, carcinoma renal e hepato-carcinoma. Os melanomas, devido à alta
propensão de disseminação hematogênica, em mais da metade dos casos
desembocam em metástases cardíacas (MONTEIRO, s.d.). Foram reportadas taxas
de metastatização do melanoma entre 30% e 75% (KISSEBERTH, 2007).
As metástases podem atingir o coração por diversas vias tais como: linfática,
hematógena, extensão direta ou extensão trans-venosa. As metástases pericárdicas
são mais comuns originarem-se através da disseminação linfática, em contrapartida
a disseminação hematógena origina preferencialmente metástases miocárdicas.
19
Depósitos endocárdicos tumorais são raramente achados. Os carcinomas
brônquicos e esofágicos, os quais se desenvolvem perto do coração, podem
disseminar-se para o mesmo por extensão direta, mas, na maioria das vezes, este
processo ocorre por via linfática bem como os carcinomas da mama. Por causa da
sua topografia os carcinomas de mama e pulmão são os tumores que mais
frequentemente causam metástases cardíacas. Devido à via de metastatização
esses dois tipos de tumores afetam preferencialmente o pericárdio. Metástases em
coração de tumores infra - diafragmáticos são menos freqüentes (MONTEIRO, s.d.).
Os tumores que geralmente disseminam-se por via hematógena são:
melanoma maligno, linfoma, sarcoma de tecidos moles e ósseos. Os tumores
cardíacos secundários que crescem parcial ou totalmente no interior da cavidade
são muito raros e, quando se manifestam, tendem a ser cobertos por material
trombótico. Também é muito rara a presença de agregados celulares tumorais nas
válvulas cardíacas (MONTEIRO, s.d.).
As metástases cardíacas podem também originarem-se por extensão transvenosa. O crescimento intra - luminal do carcinoma de células renais através da veia
renal e veia cava inferior até a aurícula direita é um exemplo desse processo.
Carcinoma hepatocelular, nefroblastoma, feocromocitoma e carcinoma do córtex da
supra-renal podem ocorrer com extensão a partir da veia cava inferior. Já o
carcinoma pulmonar pode mestastatizar-se através da veia cava superior. O
carcinoma brônquico raramente dissemina-se através das veias pulmonares até ao
coração esquerdo (MONTEIRO, s.d.).
A probabilidade de ocorrência de metástases cardíacas depende da
disseminação em larga escala do tumor de origem e da duração clínica do caso
(PASCHOAL et al., 2004).
20
3 Neoplasias Cardíacas Primárias e Secundárias e Suas Patogenias
Os tumores são fenotipicamente reconhecidos pelo fato de que suas células
apresentam padrões anormais de crescimento e não estão mais sob controle
(ARGYLE; KHANNA, 2007).
São muitas as causas de neoplasias, mas todos os tumores derivam de uma
indução de mutações nas partes de um genoma celular que controla a divisão
mitótica e a diferenciação (JONES; HUNT; KING, 2000).
Os motivos que podem acarretar estas mutações são vários tais como: erros
espontâneos na replicação do DNA (promovendo translocações cromossômicas),
várias formas de radiação, carcinógenos químicos e vírus oncogênicos; além disso,
fatores hereditários podem modular a predisposição genética para o
desenvolvimento de câncer (JONES; HUNT; KING, 2000; E ARGYLE; KHANNA,
2007).
De acordo com Jones, Hunt e King (2000) os proto-oncogenes são genes
normais presentes na divisão e diferenciação celular. Os produtos protéicos dos
proto-oncogenes são divididos em quatro categorias principais de acordo com sua
função. Estas proteínas ativam ou inativam os genes reguladores e estes expressam
ou não expressam os proto-oncogenes.
Os genes reguladores são responsáveis pela ativação e supressão da
transcrição dos proto-oncogenes. Os produtos dos genes reguladores iniciam ou
terminam a síntese de DNA e também a transcrição dos genes envolvidos no
crescimento e diferenciação celular (JONES; HUNT; KING, 2000).
Portanto os próprios proto-oncogenes podem estar envolvidos numa
manifestação neoplásica (mutação) ou os genes que regulam a expressão dos
mesmos (JONES; HUNT; KING, 2000).
Diante disso, há uma formação de produtos de genes anormais os quais não
respondem mais às vias normais de feedback da célula. Estes eventos culminam
com uma divisão celular contínua, desregulada e autônoma, ou seja, a neoplasia
(JONES; HUNT; KING, 2000).
21
Figura 12 Etapas da Carcinogênese.
Fonte: (INCA, 2002).
As células neoplásicas podem assemelhar-se ou não com as células de
origem (morfologicamente ou funcionalmente) (JONES; HUNT; KING, 2000).
Todas as neoplasias são formadas por um parênquima (com células
proliferativas transformadas em neoplasia podendo ter origem epitelial ou
mesenquimatosa) e estroma cujo não é neoplásico, sua origem é fibrovascular a
qual permite boa estrutura para o crescimento, sangue e nutrientes para a
sustentação das células neoplásicas (JONES; HUNT; KING, 2000).
O tamanho de uma neoplasia é extremamente importante em relação ao
tratamento e diagnósticos. Quanto menor o tumor, maior a sua fração proliferativa,
então mais sensível este será aos fármacos antiblásticos (quimioterápicos) e às
radiações ionizantes (Radioterapia) (INCA, 2002).
Um tumor maligno torna-se detectável pelos métodos diagnósticos quando
atinge cerca de 1 cm de diâmetro em seu crescimento; neste tamanho ele contém
cerca de 109 células. Diz-se que é necessário um período mais longo para o tumor
alcançar este tamanho, em média alguns anos. Uma neoplasia apresenta tempos e
momentos diferentes de duplicação baseado em sua história natural e, em algumas
delas, bem antes de sua detecção provavelmente já pode ter ocorrido a
metastatização hematogênica (INCA, 2002). Sendo assim, após um determinado
período de crescimento, as células recebem sinais para proliferarem-se, criar novos
vasos sanguíneos (angiogênese) ou habitar em vasos sanguíneos pré - existentes e,
em seguida, crescer com sucesso em uma lesão metastática mensurável (ARGYLE;
KHANNA, 2007).
22
Figura 13 Fases de Crescimento de um tumor maligno primário.
Fonte: (INCA, 2002).
Neoplasias Cardíacas são compostas por alguma massa neoplásica que afeta
o sistema cardiovascular seja o coração, grandes vasos ou mesmo o pericárdio
(ORTON, 2005).
As neoplasias que afetam o pericárdio (por disseminação linfática), base do
coração ou miocárdio são raras em cães e gatos (LIMA; CROTTI, 2004; E
KISSEBERTH, 2007).
Os tumores cardíacos (com exceção do linfoma) ocorrem com mais
freqüência em animais de meia idade a idosos (KISSEBERTH, 2007).
As neoplasias cardíacas metastáticas (secundárias) ocorrem de 20 a 40
vezes mais fequentemente que os tumores primários em humanos (PINHO et al.,
2009); entretanto em cães ocorre o contrário; estudos mostram que 84% das
neoplasias cardíacas tem origem no próprio coração ao passo que somente 16%
são secundários (WARE, 2002).
Os tumores cardíacos primários podem ser benignos ou malignos; a maioria
destes tumores, nos canídeos, ocorre no átrio e aurícula direitos (teoria da
disseminação hematogênica); em cerca 56% dos casos são malignos; apenas 2%
dos tumores cardíacos primários são identificados como benignos (WARE, 2002;
LIMA; CROTTI, 2004; E KISSEBERTH, 2007).
Dentre os tumores primários, hemangiossarcomas são os mais comuns que
afetam o coração dos canídeos sendo altamente malignos. Os sítios primários deste
tumor mais comuns em cães e gatos envolvem órgãos viscerais tais como baço,
átrio direito, apêndice e fígado pele, pericárdio, pulmão, rins, cavidade oral,
musculatura óssea, aparelho geniturinário e peritônio (KISSEBERTH, 2007).
Os hemangiossarcomas afetam principalmente a aurícula direita e tem origem
no endotélio vascular; decorrente dele pode ocorrer uma cardiomegalia moderada
23
com um maior aumento do lado direito do coração (WARE, 2002; E SILVEIRA et al.,
2010).
Kisseberth (2007) e Sampaio et al. (s.d.) relatam que seguidos do
hemangiossarcoma as neoplasias primárias que mais comumente afetam o aparelho
cardiovascular são os do corpo aórtico como o chemodectoma e paraganglioma. Os
tumores do corpo aórtico surgem a partir de células quimiorreceptoras (células que
são especializadas na manutenção da homeostase do sistema cárdio-respiratório;
elas funcionam tanto como barorreceptores - que promovem o aumento ou a
diminuição da freqüência cardíaca, pressão arterial, tônus vasomotor, atividade do
córtex cerebral e da liberação de adrenalina, como quimiorreceptores,quando
detectam variações do pH sangüíneo, pressão de oxigênio (PO2) e de dióxido de
carbono (PCO2)) na da base do coração.
Macroscopicamente os chemodectomas - os quais podem ser benignos
(adenomas) ou malignos (carcinomas) - formam massas grandes, com uma firme
consistência e coloração esbranquiçada; eles cercam e comprimem grandes vasos e
átrios, em especial a veia cava e o átrio direito, resultando em obstrução mecânica e
insuficiência cardíaca (MOURA et al., 2006). Pode ser chamado de tumor da base
do coração por instalar-se, também, na base da aorta ou entre a aorta e a artéria
pulmonar. Pode, às vezes, surgir perto da bifurcação da artéria carótida no pescoço
e apresentar-se como uma massa cervical cranial (DOBSON; MORRIS, 2001). Estes
tumores são principalmente de invasibilidade local, mas, ocasionalmente, pode
ocorrer metástase (KISSEBERTH, 2007).
Outros tumores cardíacos primários relatados que acometem o cão, são o
linfoma, sarcoma, mixoma, carcinoma de tireóide ectópica, fibroma, fibrossarcoma,
rabdomiossarcoma, condrossarcoma, mesotelioma, tumor de células granulares,
osteossarcoma, mixossarcoma, hemangioma, rabdomioma, condroma, lipofibroma,
linfangiotelioma, linfossarcoma, mixofibroma, neurofibroma, neurossarcoma,
teratoma, e sarcoma misto de células fusiformes e redondas conforme salientam
Dobson e Morris (2001), Farrow (2006) e Kisseberth (2007). Dentre estes citados os
malignos são: rabdomiossarcoma, sarcoma misto de células fusiformes e redondas,
hemangioma, linfossarcoma, neurossarcoma, fibrossarcoma, condrossarcoma,
osteossarcoma, mixossarcoma (LIMA; CROTTI, 2004).
24
Figura 14 Na imagem acima o coração de um canídeo apresenta um chemodectoma
(apontado por setas finas pretas) na região dos grandes vasos cardíacos; abaixo é
ilustrada uma massa tumoral penetrando na luz atrial esquerda; o ventrículo
esquerdo (apontado pela flecha maior) evidencia hipertrofia concêntrica moderada.
Fonte: (CAVALCANTI et al., 2006).
Figura 15 Exemplo de mixoma em átrio esquerdo (na seta). A fotografia foi obtida
durante a operação (intra-operatória) com realização de abertura do átrio esquerdo e
exérese do tumor cujo estava pediculado no septo interatrial; o paciente em questão
era um humano que apresentava edema agudo de pulmão.
Fonte: (LIMA; CROTTI, 2004).
As neoplasias cardíacas secundárias originam-se, principalmente, através dos
carcinomas (de glândulas mamárias, pulmonares e de células escamosas) e
melanomas, sendo este uma neoplasia com maior probabilidade para a
disseminação cardíaca e o de pior prognóstico (PINHO et al., 2009).
25
Figura 16 Microscopia de tumor melanocítico invadindo as fibras musculares do
coração; neoplasia de aspecto infiltrativo e invasivo causando destruição das fibras
do miocárdio (fato evidenciado pelas setas largas e brancas); nota-se, também, a
grande presença de melanina (setas pretas e finas).
Fonte: (LIMA; CROTTI, 2004)
Linfoma, adenocarcinoma de glândulas salivares, rabdomiossarcoma de
glândulas sudoríparas, timoma, mastocitoma e o hemangiossarcoma são outros
tipos de tumores que também podem metastatizarem-se para o coração (DOBSON;
MORRIS, 2001; KISSEBERTH, 2007 E PINHO et al., 2009).
26
Figura 17 As setas pretas indicam um timoma maligno infiltrando em estruturas do
mediastino e cardíacas; a massa tumoral oblitera por completo a valva tricúspide.
Fonte: (LIMA; CROTTI, 2004).
Figura 18 As figuras mostram o linfoma disseminando-se no coração de um cão
adulto. Acima se evidencia uma alteração na coloração e espessamento da parede
externa do lado direito do coração; abaixo o espessamento é mais visível devido ao
corte do coração.
Fonte: (PELETEIRO; ORVALHO, 2001).
Os felinos tem menor suscetibilidade a neoplasias cardíacas comparando-os
aos cães. Os carcinomas são responsáveis pela maioria dos casos de
metastatização para o coração destes animais (WARE, 2002).
O linfoma é a massa tumoral mais comum que afeta o coração dos gatos
(presente em 31% dos casos), seguido dos de corpo aórtico e mixoma cardíaco
(DOBSON; MORRIS, 2001; WARE, 2002 E KISSEBERTH, 2007).
27
Figura 19 As fotografias (da página anterior e atual) correspondem a um linfoma
mediastinal em felino com microcardia.
Fonte: (BARBIERI, 2010).
Em casos raros a metástase cardíaca pode ser a primeira manifestação de
uma neoplasia (através de sintomas clínicos) em que a origem primária é
desconhecida; em sua maioria conhece-se a origem primária da massa tumoral e a
manifestação cardíaca de metástase é tardia (PINHO et al., 2009).
28
Figura 20 Aurícula cardíaca direita evidenciando um hemangiossarcoma originado
do baço (ilustrado na parte inferior).
Fonte: (PARREIRA; KEGLEVICH, 2005).
3.1 Etiologia
A etiologia dos tumores cardíacos primários é desconhecida, embora pode-se
sugerir uma influência genética em determinadas raças ou tipos de cães (DOBSON;
MORRIS, 2001).
Apesar disso, algumas considerações podem ser feitas a respeito da etiologia
de tumores primários como a exposição do tecido cardíaco a agentes ambientais
(irritantes, mutagênicos, radioativos), facilidade técnica para abordar o órgão a fim
de realizar-se um diagnóstico, precocidade dos sintomas e mesmo fatores
intrínsecos ao sistema cardiovascular e predisposição celular ao desenvolvimento
dos tumores, sejam benignos ou malignos (LIMA; CROTTI, 2004).
Dentre os metastáticos a etiologia vê-se na dependência do tipo tumoral e
local primário da massa. No caso, por exemplo, dos melanomas malignos (primários
ou secundários), quando atingem pulmões, esôfago ou qualquer estrutura próxima
ao tecido cardíaco, podem originar metástases para o coração e seus envoltórios
(LIMA; CROTTI, 2004).
A disseminação melanocítica por via linfática ou por contigüidade é
responsável pela presença das metástases no pericárdio e miocárdio, entretanto
raramente atinge o endocárdio. Quando ocorre disseminação hematogênica o tumor
frequentemente instala-se em cavidades diretas. O melanoma maligno tem
predileção pelo miocárdio e pericárdio (LIMA; CROTTI, 2004).
O melanoma tem início primário frequentemente em tecido cutâneo, olhos e
cavidade oral dos cães (principalmente em animais mais velhos e com
hiperpigmentação); originam-se em locais em que há células percussoras
numerosas e acúmulo de melanócitos; após, devido ao seu alto grau de
disseminação pode instalar-se em qualquer órgão, tendo predileção pelo coração,
tecido nervoso e fígado; metástase de melanoma ocular para o tecido cardíaco é
bem significativa (LIMA; CROTTI, 2004; E SANTOS et al., 2005).
29
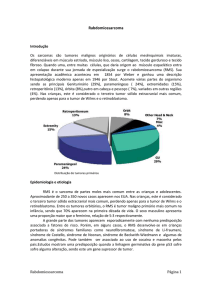
3.2 Epidemiologia
Os felinos tem menor suscetibilidade a desenvolver (ou ocorrer metástases)
tumores cardíacos do que os cães; dentre os gatos, as fêmeas tem uma maior
propensão a apresentar um tumor neste órgão do que machos; a idade é muito
significativa entre os felinos: quanto mais velho o animal maior a chance de
apresentar tumores cardíacos (ou metástases no órgão) (WARE, 2002).
Em cães as neoplasias cardíacas (sejam primárias ou secundárias) são mais
comuns em animais de meia-idade a idosos (cerca de 7 a 15 anos) (WARE, 2002).
Machos e fêmeas de canídeos tem um acometimento com proporções iguais;
entretanto a castração parece ter um efeito importante nesse fato; afirmam-se que
fêmeas castradas podem ter um risco 4 vezes maior de desenvolver tumor cardíaco
do que as não castradas; em machos, os castrados possuem um risco 1,6 vezes
maior do que os que não foram submetidos a esse tipo de procedimento; fêmeas
não castradas possuem chance 2,4 vezes menor do que machos castrados de
apresentarem tumor cardíaco; entre ambos os sexos castrados o risco é parecido
(WARE, 2002).
Com base em estudos identificaram-se 12 raças como tendo um número
significativamente maior na taxa de incidência de tumores cardíacos em comparação
com todas as outras raças; dentre elas, exemplificando, estão as Saluki, Buldogue
Francês, Golden Retriver, Boxer, Afghan Hound e Pastor Alemão são mais
predispostos a apresentarem neoplasia cardíaca; as raças menos predispostas são:
Shar Pei, Maltês, Dálmata, Poodle Toy. O Boxer e o Golden Retriver precisam de
atenção especial quanto ao desenvolvimento secundário do melanoma maligno no
coração já que possuem predisposição ao melanoma e a apresentarem neoplasia
cardíaca (primária ou secundária). Não existem relatos de neoplasias cardíacas em
Basenji, Belgian Tervuren, Bloodhound e Blue Tick Coonhound (WARE, 2002; E
KISSEBERTH, 2007).
O Pastor Alemão e o Golden Retriever são mais predispostos a
desenvolverem hemangiossarcoma cardíaco; tumores do corpo aórtico ocorrem
mais
em
cães
braquicefálicos
idosos
(principalmente
em
Boxers,
Boston Terriers, Buldogues Ingleses) além de Pastores Alemães. Sugere-se que a
hipóxia crônica poderia estimular o desenvolvimento de tumores em
quimiorreceptores de cães; esse fato poderia explicar o aumento da ocorrência de
tumores do corpo aórtico em raças de braquicéfalicos (KISSEBERTH, 2007).
30
4 Melanoma Maligno Metastático Cardíaco
O melanoma tem um comportamento biológico imprevisível e este fato pode
levá-lo a sítios metastáticos incomuns; tem propensão a metástases precoces e é
uma neoplasia com alta probabilidade para um envolvimento cardíaco; raramente é
identificado ante-mortem, devido ao fato de os sinais clínicos serem discretos e
inespecíficos em alguns casos, e / ou mascarados por outras metástases viscerais
(pode ser oligossintomática); portanto o coração deve ser incluído em exames de
rotina em pacientes acometidos por melanomas (SAVOIA et al., 2000; E MORAIS et
al., 2008).
Ainda não se sabe porque há uma alta incidência de metástases de
melanoma para o miocárdio, nos pacientes com disseminação sistêmica do
melanoma. Estudos recentes com antígenos e histocompatibilidade e com
melanocortinas e seus receptores sugerem que ocorra um tropismo das células do
melanoma pelos miócitos do coração. A “imunoatração” entre as células do
melanoma e o músculo cardíaco pode também explicar o fato de animais operados
por melanoma ocular ou de pele cujos estão livres da neoplasia no sítio primário,
apresentarem metástases de melanoma isoladas para o miocárdio. Não há
evidências na literatura de que células miocárdicas possam adquirir comportamento
maligno e síntese de melanina. Esse fato pode ser esclarecido futuramente já que
estão sendo realizados estudos com células totipotentes e implantes das mesmas
no músculo cardíaco (LIMA; CROTTI, 2004).
Futuramente critérios para grupos de riscos poderão ser adotados, por
exemplo, ao serem analisados pacientes idosos submetidos à ressecção de
melanoma da pele ou do globo ocular e que também apresentem arritmia de origem
incerta (LIMA; CROTTI, 2004).
Em humanos, metástases cardíacas de melanoma maligno são encontradas
na autópsia em mais de 50% dos pacientes com massas melanocíticas em outras
regiões do corpo, e pode envolver qualquer parte da estrutura do coração (SAVOIA
et al., 2000).
A maioria das metástases melanocíticas cardíacas são pequenas e
disseminadas até o pericárdio e miocárdio; válvulas e endocárdio são raramente
envolvidos; o lado direito do coração parece ser afetado mais comumente do que o
esquerdo; a aurícula direita e a câmara cardíaca são mais fequentemente afetadas
por um processo de disseminação hematogênea (SAVOIA et al., 2000; E PINHO et
al., 2009).
O coração quando acometido pode ser chamado vulgarmente de “coração de
carvão” e a participação de metástase no tecido cardíaco tem sido relatada mesmo
quando associada com pouca evidência de disfunção cardíaca; a maioria dos
pacientes com diagnóstico de metástases cardíacas também apresentam uma
participação extracardíacas das lesões melanocíticas (SAVOIA et al., 2000).
A metastatização tardia do melanoma maligno ao coração (pode ocorrer
vários anos após a excisão do tumor primário) não é rara nestes casos (PINHO et
al., 2009).
A metástase cardíaca do melanoma ocorre principalmente envolvida em um
contexto de uma disseminação tumoral sistêmica. A metastatização limitada ao
tecido cardíaco é rara (PINHO et al., 2009).
O envolvimento cardíaco pode ocorrer por disseminação hematogênica que é
o mais comum, invasão direta do mediastino ou crescimento dentro da veia cava
31
com extensão para o átrio direito. Devem-se considerar as metástases cardíacas ou
pericárdicas sempre que um animal com uma malignidade alta do melanoma
desenvolve sintomas cardiovasculares, em particular se estes ocorrerem em
conjunto com cardiomegalia, sopro, distúrbios de condução ou arritmias (MORAIS et
al., 2008).
32
4.1 Sintomatologia
Apesar de sua freqüência, as metástases melanocíticas cardíacas geralmente
são clinicamente silenciosa (SAVOIA et al., 2000). Os sinais clínicos podem
ausentarem-se principalmente se o melanoma cardíaco for pequeno ou se ele não
afetar com significância a função cardíaca (WARE, 2002).
Entretanto, quando ocorrem sinais clínicos decorrentes do melanoma
cardíaco invasivo, estes podem ser variados. Perturbam o funcionamento normal
dos tecidos que invadem, levando a alterações das funções cardiovasculares e
hemodinâmicas secundárias (WARE, 2002; E KISSEBERTH, 2007).
Frequentemente os sinais da presença física da massa melanocítica
obliterante do coração são a compressão do coração impedindo seu enchimento
normal e o derrame pericárdico desencadeando um tamponamento cardíaco
(WARE, 2002; E KISSEBERTH, 2007).
O tamponamento cardíaco é instalado devido a uma descompensação da
compressão cardíaca desencadeada pela elevação da pressão do fluído
intrapericárdico que ocorre descontroladamente. Ocorre redução do preenchimento
ventricular, do débito cardíaco e hipotensão arterial (WARE, 2002).
O tamponamento é recrutado devido ao baixo débito cardíaco e desembocam
em insuficiência cardíaca congestiva devido a mecanismos compensatórios
desenvolvidos pelo próprio organismo (WARE, 2002).
Figura 21 Exemplificação esquemática de um tamponamento cardíaco.
Fonte: (Síndromes paraneoplásicas, 2009).
Nos pacientes em que existe disseminação do tumor para o pericárdio, ocorre
presença de exsudato neoplásico ao redor do coração sendo este o sinal e sintoma
inicial e predominante. (LIMA; CROTTI, 2004).
O derrame pericárdico normalmente é a primeira manifestação sintomática do
melanoma cardíaco. O envolvimento do pericárdio poderá levar a uma pericardite
que dará início a um derrame pericárdico podendo este ser sero-sanguinolento ou
hemorrágico e poderá ou não estar associado a um compromisso hemodinâmico; a
pericardite, uma vez instalada, pode levar a dor reto-esternal no paciente acometido
de melanoma maligno (MONTEIRO, s.d.).
33
O excesso de fluido pericárdico impede um relaxamento adequado do
coração durante a diástole devido ao aumento da pressão intrapericárdica que
provocará um comprometimento hemodinâmico desencadeando, em sua maioria,
em insuficiência congestiva direita e quando em pressões altamente elevadas
insuficiência congestiva esquerda (PASCON; CAMACHO, 2009).
Infiltração no miocárdio (desencadeante de uma isquemia ou não) da massa
melanocítica cardíaca ou o tumor aderido à parede do coração pode auxiliar no
desenvolvimento de perturbação do ritmo cardíaco normal e contratilidade anormal
do coração. Diversos tipos de arritmias como a taquiarritmia (supraventricular e
ventricular) são comuns na presença de massa cardíaca melanocítica e podem ser
considerados a principal forma de manifestação do tumor. A fisiopatologia dessas
arritmias pode estar relacionada ao estímulo mecânico cuja massa pode gerar, bem
como ao edema que pode ocorrer ao redor no tumor. Afirma-se que tumores
pediculados possam ser mais arritmogênicos que os tumores sésseis na fase inicial
da doença. Infiltração tumoral melanocítica no sistema de condução pode
desencadear distúrbios de condução do sistema elétrico do coração tais como
bloqueio de um ramo importante do sistema Hiss-Purkinje e seus ramos ou do nodo
atrioventricular; também são manifestações primordiais. Focos de estimulação
cardíaca ectópicos também foram mencionados. Esses fenômenos podem
desencadear falência cardíaca, podendo ocorrer morte súbita (WARE, 2002; LIMA;
CROTTI, 2004; FARROW, 2006; E KISSEBERTH, 2007).
Fibrilação atrial (que é caracterizada por contrações atriais desorganizadas,
comprometendo, assim, o débito cardíaco e podem ser detectadas ao exame
eletrocardiográfico), flutter atrial, extrasístoles ventriculares isoladas ou freqüentes,
bloqueio de ramo direito (e de suas divisões) são geralmente observados em
pacientes que possuem uma massa cardíaca (LIMA; CROTTI, 2004; E
CAVALCANTI et al., 2006).
Os melanomas malignos cardíacos que acometem a região atrial podem
predispor à taquicardia atrial e/ou fibrilação atrial devido a mecanismos de
automaticidade anormalmente alterada ou de reentrada miocárdicas; o mecanismo
de automaticidade anormalmente alterada acontece quando miócitos com potencial
de membrana em repouso são alterados para potencial próximo do limiar de
disparo/contração. Essa alteração do potencial de membrana em repouso ocorre em
miócitos isquêmicos e com alterações iônicas (CAVALCANTI et al., 2006).
O mecanismo de reentrada ocorre quando um estímulo elétrico encontra uma
área cardíaca cuja condução elétrica está retardada, desencadeando, assim,
reexcitação miocárdica ao sair dessa área e atingir miócitos fora do período
refratário. O mecanismo de reentrada pode ocorrer na região de transição entre o
tecido tumoral e o miocárdio normal (CAVALCANTI et al., 2006).
Os sinais clínicos produzidos por tumores cardíacos são mais estreitamente
relacionados com a sua localização anatômica exata. Sintomatologia específica
observada em um paciente individual é influenciada pelo tamanho do tumor e sua
localização precisa além da presença de derrame pericárdico (WARE, 2002; E
KISSEBERTH, 2007).
Os sintomas podem estar relacionados também a presença física da massa
tumoral em um grande vaso ou anel valvular desencadeando obstrução do fluxo
sanguíneo (WARE, 2002).
Sintomas de insuficiência cardíaca congestiva ou de baixo débito em
diferentes graus podem ocorrer principalmente devido ao melanoma cardíaco
34
obstruir o fluxo sanguíneo ou induzir arritmias (mais do que por causar efusão
pericárdica) (WARE, 2002).
Quando o tumor melanocítico cardíaco obstrui o fluxo sanguíneo do átrio ou
ventrículo direito ou quando causa efusão pericárdica e tamponamento cardíaco
desenvolve-se, no paciente, sintomas de insuficiência cardíaca congestiva direita
que podem ser, dentre outros: ascite, efusão pleural, distensão da veia jugular,
pulsos jugulares anormais, edema subcutâneo (às vezes), intolerância ao exercício,
déficit de pulso, edema periférico, sons abafados, anasarca dentre outros como
relatam Ware (2002), Farrow (2006) e Monteiro (s.d.).
Figura 22 Animal apresentando anasarca; detalhe na ilustração à direta para o
edema dos membros inferiores.
Fonte: (HAGE et al., 2008).
O paciente pode apresentar, também, fraqueza e síncope, dispnéia,
desmaios, convulsões após esforço físico ou excitação. Estes são sintomas
inespecíficos e com pequena freqüência como também a dor torácica e/ou
precordial. Tamponamento cardíaco, obstrução do fluxo sanguíneo, arritmias ou o
prejuízo da função do miocárdio são os sinais clínicos do baixo débito cardíaco
(LIMA; CROTTI, 2004; E WARE, 2002).
Devido às massas tumorais melanocíticas causarem, em alguns casos,
tamponamento cardíaco os sons cardíacos podem apresentar-se abafados; os
pacientes podem apresentar sons brônquicos atenuados (NELSON, 2003).
Dobson; Morris (2001) e Kisseberth (2007) relatam que quando a massa
neoplásica atinge o corpo da aorta ou o átrio direito cardíaco/aurícula direita, os
sinais mais comumente relatados são: edema, ascite, tosse, dispnéia, perda de peso
e êmese (sinais associados à insuficiência cardíaca congestiva direita).
Pode ocorrer também diástese hemorrágica devido à coagulação
intravascular disseminada DOBSON; MORRIS (2001)
Massas que se metastatizam para a base do coração causam,
freqüentemente, a síndrome da cava superior a qual desencadeia edema da cabeça,
pescoço e membros anteriores devido à pressão do tumor na veia mencionada
(KISSEBERTH, 2007).
35
Figura 23 Desenho esquemático exemplificando a Síndrome da Veia Cava Superior.
Fonte: (Síndromes paraneoplásicas, 2009).
Metástases melanocíticas quando intra-cavitárias do lado direito do coração
podem dar origem a êmbolos pulmonares; quando tais metástases ocorrem no lado
esquerdo cardíaco, a tendência é que a embolização seja sistêmica (MONTEIRO,
s.d.).
Quando a metástase limita-se ao miocárdio resulta em sintomas pouco claros
que tendem a não desencadear uma sintomatologia, mas quando a massa
melanocítica atinge o pericárdio de forma mais difusa ou outros locais cardíacos a
probabilidade é que os sinais clínicos sejam mais graves, causando, portanto,
emergências médicas (MONTEIRO, s.d.).
Os êmbolos tumorais melanocíticos que ocluem a vascularização podem
também desencadear múltiplos acidentes vasculares encefálicos (MONTEIRO, s.d.).
De acordo com Kisseberth (2007) algumas vezes os tumores melanocíticos
cardíacos podem estar presentes sem causarem sinais clínicos, sendo achados de
necropsia.
36
4.2 Métodos de Diagnóstico
O diagnóstico de neoplasia cardíaca no cão e gato é geralmente baseado na
história clínica, exame físico, radiográficos e, principalmente, ecocardiográficos
(KISSEBERTH, 2007).
Entretanto exames físicos e laboratoriais podem ser inespecíficos e
inconclusivos (MONTEIRO, s.d.).
Hemograma completo, coagulograma, perfil bioquímico são mais indicados
para talvez evidenciar outro sítio primário da doença; não são muito eficientes para
diagnóstico de massas cardíacas, embora tais investigações possam ser úteis para
afastar diagnósticos diferenciais (DOBSON; MORRIS, 2001 E KISSEBERTH, 2007).
Quando ausculta-se o paciente, em casos de melanoma cardíaco
intracavitário, podem ser constatados sopros sistólicos e diastólicos, dependendo da
expressão, localização, tamanho e mobilidade do melanoma; um abafamento dos
ruídos cardíacos também pode ser detectado (devido à intensa efusão pericárdica)
(WARE, 2002 E MONTEIRO, s.d.).
Quando o animal apresenta insuficiência cardíaca pode ser detectável o ritmo
de galope; em pericardite surge o som do átrio pericárdico que é característico
(MONTEIRO, s.d.).
Em alguns casos não ocorrem alterações que sejam auscultáveis
(MONTEIRO, s.d.).
A biópsia do tumor é realizada quando nenhum outro método diagnóstico de
imagem for conclusivo ou quando houver ausência de acometimento de outros
órgãos pela neoplasia. Nessas ocasiões a determinação do tipo histológico do tumor
cardíaco é importante para direcionar o tratamento mais eficaz (LIMA; CROTTI,
2004).
Ozyuncu et al. (2006) descreveram uma técnica de biópsia transvenosa
guiada por ecocardiografia transesofágica para retirada de tecido e posterior
avaliação histológica; eles consideram essa técnica como bem sucedida.
Mas precisa-se de cautela em pacientes cuja massa ocupe mais de 90% da
cavidade do ventrículo direito, pois Ozyuncu et al. (2006) afirmaram que pode
ocorrer um tamponamento cardíaco durante a biópsia transvenosa.
A biópsia é contra-indicada em casos cujo tumor esteja alojado em átrio
esquerdo (o que é mais raro) ou que o paciente apresente trombos intramurais,
devido o risco de embolia e disseminação do tumor para outros órgãos (LIMA;
CROTTI, 2004).
A angiografia pode também ser realizada nesses casos; se o melanoma
maligno atingir a base do coração, entre os achados sugestivos desta técnica
diagnóstica estão: identificação de vasos aberrantes e retorcidos no local anatômico
mencionado. Lesões cardíacas também podem ser identificadas pela angiografia
(ORTON, 2005).
A tomografia e ressonância magnética são raramente utilizadas na Medicina
Veterinária; mas seriam de grande valia já que estes métodos diagnósticos permitem
obter seções das estruturas cardíacas, pulmonares, mediastinais e torácicas em
qualquer plano desejado, sem que ocorram sobreposições (MONTEIRO, s.d.).
Nestas duas técnicas citadas acima, é possível fazer uma diferenciação
parcial dos tecidos entre sólidos, líquidos, sangue e gordura, assim como é muito
mais demarcada a detecção de metástases miocárdicas; estas duas técnicas
também propiciam a avaliação de estruturas circunvizinhas ao coração e, desta
37
forma, determinar se a neoplasia originou-se em órgãos intratorácicos ou não; o
diagnóstico feito por tomografia seria muito importante para estadiar um tumor que
tenha sido recentemente diagnosticado (LIMA; CROTTI, 2004 E MONTEIRO, s.d.).
A ressonância magnética define o local e implantação do tumor, avalia o
envolvimento de estruturas mediastínicas, e detecta o envolvimento do miocárdio;
esta técnica pode auxiliar na caracterização etiológica de modo não invasivo das
massas cardíacas por meio das características de sinais obtidas nas diferentes
sequências realizadas e no comportamento do tumor após administração do
contraste (PINHO et al., 2009).
A maioria dos tumores apresenta-se hipointenso nas imagens ponderadas em
T1; os melanomas mostram-se brilhantes (hipersinal) nestas sequências. Este efeito
é característico re resultante da capacidade de ligação da melanina a alguns metais
paramagnéticos; portanto a ressonância cardíaca demonstra ser um ótimo exame de
seguimento dos pacientes acometidos por este tipo de neoplasia (PINHO et al.,
2009).
O tumor melanocítico, bem como a maioria das massas, é realçado após
administração de gadolínio; isto se deve ao fato de que o espaço vascular e
intersticial esteja aumentado (PINHO et al., 2009).
Figura 24 Tomografia computadorizada de tórax humano evidenciando lesão
expansiva, hipodensa, com limites bem definidos, com acometimento da parede
anterior do coração (mostrada pela seta fina preta na imagem à direita).
Fonte: (LIMA; CROTTI, 2004).
Pode-se, também, fazer um exame do líquido pericárdico. Normalmente não é
possível diferenciar efusões neoplásicas de pericardite hemorrágica benigna
38
somente com exame citológico pelo fato de que há células mesoteliais reativas na
efusão; contudo certos tumores em algumas ocasiões podem ser diagnosticados
através da avaliação do fluido pericárdico; o fluído pericárdico com pH igual ou
superior a 7 pode indicar uma neoplasia ou outra causa não inflamatória. Células
neoplásicas presentes no espaço pericárdico confirmam o diagnóstico de metástase
pericárdica. Uma citologia negativa não exclui uma malignidade no líquido
pericárdico; sendo assim pode fazer-se necessária a realização de uma biópsia
pericárdica para elucidar o diagnóstico (WARE, 2002 E MONTEIRO, s.d.).
Se realizada a exérese da massa em cirurgia para biópsia, pode-se fazer um
exame anatomo-patológico do tumor retirado, verificando suas características
macroscópicas e microscópicas (PINHO et al., 2009).
Figura 25 Aspecto macroscópico de uma massa melanocítica retirada parcialmente
da aurícula cardíaca de um paciente.
Fonte: (PINHO et al., 2009).
A formação representada acima é nodular, ao corte compacta de aspecto
heterogêneo, com áreas de necrose e infiltração hemorrágica (PINHO et al., 2009).
Ao exame microscópico foi observado um tumor de padrão sólido, constituído
por células poligonais, contendo pseudo-inclusões nucleares e elevado índice
mitótico. Em estudo imuno-histoquímico detectou-se imunorreatividade das células
melanocíticas para a substância vimentina, proteína S-100 e HMB-45, o que
clarificou o diagnóstico de metástase de melanoma cardíaco (PINHO et al., 2009).
39
Figura 26 Exame histológico do tumor realizado com hematoxilina-eosina em
aumento 400x.
Fonte: (PINHO et al., 2009).
Figura 27 Representação da análise imunohistoquímica com presença de células
neoplásicas reativas para HMB-45 em aumento 400x.
Fonte: (PINHO et al., 2009).
40
4.2.1 Raio-X
Em animais em que o tumor melanocítico atingiu a base do coração, pode-se
visualizar na planície radiográfica torácica uma massa de tecido mole que se
estende da base do coração ao mediastino cranial provocando uma elevação dorsal
da traquéia terminal; técnicas de contraste, como a angiografia, podem facilitar uma
melhor definição da massa tumoral; radiografias também evidenciam derrames
pleurais ou pericárdicos, edema pulmonar ou aumento da densidade peri-hilar
(ORTON, 2005 E KISSEBERTH, 2007).
Grandes neoplasias nesta mesma região anatômica cardíaca podem também
gerar protuberâncias não comuns na visualização dorsal da sombra cardíaca, seja a
efusão pericárdica presente ou não (WARE, 2002).
A radiografia torácica também evidencia em sua maioria um aumento da área
cardíaca; mas dificilmente sugere-se uma suspeita clínica de neoplasia em
miocárdio. O tamponamento cardíaco é a sintomatologia a qual traz sinais
radiográficos que mais se sugere uma neoplasia cardíaca (WARE, 2002).
Em efusão pericárdica, devido ao acúmulo de fluído, há um aumento na
silhueta cardíaca; esta se apresenta, geralmente, arredondada, globosa, sem
evidência da dilatação da câmara; pode-se também verificar distensão na veia cava
caudal, baixa circulação pulmonar, efusão pleural, hepatomegalia e ascite (WARE,
2002).
A radiografia torácica permite identificar o crescimento para e pericardial do
tumor e também a visualização de metástases pulmonares (MONTEIRO, s.d.).
Radiografias de tórax são mais indicadas para visualização de metástases
(KISSEBERTH, 2007).
Figura 28 Radiografias da cavidade torácica nas projeções latero-lateral esquerda
(acima), latero-lateral direita (abaixo) evidenciando um acentuado e generalizado
aumento da silhueta cardíaca, com contornos arredondados, elevação da traquéia e
efusão pleural discreta.
Fonte: (HAGE et al., 2008).
41
Figura 29 Radiografia do tórax de um cão, demonstrando uma grande massa de
tecido mole situado na base do coração, que está se estendendo para o mediastino
cranial e causando elevação da traquéia.
Fonte: (KISSEBERTH, 2007).
42
4.2.2 Eletrocardiograma
Um eletrocardiograma pode ser normal em pacientes com tumores cardíacos
ou podem evidenciar uma variedade de arritmias como ventriculares ou
supraventriculares ou defeitos de condução (KISSEBERTH, 2007 E MONTEIRO,
s.d.). A taquicardia supraventricular pode desencadear um padrão de alternância
elétrica; infiltrações tumorais podem causar taquiarritmia atrial ou ventricular com
complexos precoces (WARE, 2002).
Estas arritmias podem estar correlacionadas com o sítio do tumor metastático,
ou pode ser secundária a hipóxia, isquemia ou infarto local (KISSEBERTH, 2007).
Infiltração no sistema de condução átrio ventricular podem causar variados
graus de bloqueio átrio ventricular e bradicardia (WARE, 2002).
Complexos QRS de baixa amplitude e alternância elétrica podem ser vistos
em animais com efusão pericárdica; ondas R de baixa amplitude podem ocorrer
quando há um atraso na transmissão do impulso elétrico cardíaco para o tecido
cutâneo; isso ocorre em efusão pleural e pericárdica; a alternância elétrica apesar de
ser vista mais comumente em efusão pericárdica pode também associar-se a efusão
pleural grave; taquicardia sinusal é comum em pacientes que apresentam
tamponamento cardíaco (WARE, 2002 E KISSEBERTH, 2007).
O fluxo do ventrículo direito obliterado por uma neoplasia intracardíaca pode
desencadear desvio do eixo direito e um padrão de hipertrofia ventricular direita no
eletrocardiograma (WARE, 2002).
A pericardite às vezes é demonstrada por elevações típicas do segmento ST.
Frequentemente são detectadas apenas elevações ST não específicas. Ondas Q
podem surgir como consequência de infiltração tumoral e remodelação miocárdica
(MONTEIRO, s.d.).
Entretanto a presença de alterações do ritmo cardíaco ou da condução do
estímulo, detectadas no exame de eletrocardiograma, também podem ser
inespecíficas e darem margem a vários diagnósticos diferenciais (LIMA; CROTTI,
2004).
Figura 30 À direita eletrocardiograma de um paciente com melanoma de ventrículo
direito. Observam-se alterações inespecíficas: há ritmo sinusal; PR=0,16 ms; eixo
QRS=30º; alterações inespecíficas da repolarização ventricular em parede anterior
(“R” amplo e “T” negativa em V1); à esquerda eletrocardiografia de um cão
43
evidenciando fibrilação atrial (ondulações na linha da base) e extra-sístole ventricular
apontada pela seta.
Fonte: (LIMA; CROTTI, 2004 E CAVALCANTI et al., 2006).
Pode-se detectar em um eletrocardiograma de paciente acometido por
melanoma cardíaco um bloqueio átrio-ventricular (WARE, 2002).
Figura 31 Eletrocardiograma evidenciando um bloqueio átrio-ventricular completo.
Fonte: (OZYUNCU et al., 2006).
44
4.2.3 Ecocardiograma
O ecocardiograma uni e bidimensional com estudo dos fluxos intracavitários,
por via transtorácica ou esofágica é o melhor, mais valioso e sensível método para
diagnosticar neoplasia cardíaca bem como presença ou não de efusão pericárdica
(WARE, 2002; LIMA; CROTTI, 2004 E KISSEBERTH, 2007).
Acentua-se a visualização do tumor melanocítico cardíaco devido à
ecodensidade do sangue intracardíaco circunvizinho (WARE, 2002).
A efusão pericárdica é observada como sendo um espaço livre de eco entre o
pericárdio parietal e o epicárdio; esta evidência pode ajudar a identificar tumores que
se alojaram base do coração os quais se estendem no espaço do pericárdio (WARE,
2002).
A ecocardiografia pode evidenciar densas bandas pericárdicas que refletem o
espessamento sofrido pelo pericárdio devido à inflamação ou infiltração neoplásica;
metástases em pericárdio podem demonstrar-se sob a forma de uma “couve-flor” no
espaço pericárdico (MONTEIRO, s.d.).
O ecocardiograma é importante para avaliar o tumor cardíaco bem como suas
relações intracardíacas; pode-se, através dele, estimar o local de implantação e
extensão do tumor melanocítico (superficial ou profundo, quando já invadiu o
miocárdio adjacente), local de origem, acometimento ou não dos folhetos valvares
ou aparelho valvar (espessura da parede e movimento valvular) por lesões
vegetativas, pediculadas ou sésseis, obstrução do fluxo sanguíneo intracavitário e
sinais de invasão ao músculo cardíaco e pericárdio; além disso, visualizam também
alterações secundárias no tamanho, forma e função das câmaras cardíacas (WARE,
2002 E LIMA; CROTTI, 2004).
Obtêm-se mais informações através do método ecocardigráfico
transesofágico do que o transtorácico por ele ser mais sensível na caracterização do
tumor em relação ao tamanho, mobilidade e local de implantação (PINHO et al.,
2009).
O ecocardiograma com o modo Doppler, principalmente este sendo colorido,
é importante para facilitar a identificação de alterações cardíacas mais discretas,
que, no modo M ou bidimensional, podem ser difíceis de serem detectadas como em
caso de massas ainda muito pequenas (CASTRO et al., 2009).
O Doppler permite, também, estimar alterações do fluxo sanguíneo de modo
quali e quantitativamente (WARE, 2002).
Em grandes metástases do miocárdio as anormalidades de contração da
parede cardíaca podem ser observadas através da ecocardigrafia (MONTEIRO,
s.d.).
O ecocardiograma é um instrumento muito útil não apenas no diagnóstico da
neoplasia, mas também para determinar uma provável ressecção cirúrgica ou
biópsia (WARE, 2002).
45
Figura 32 Ecocardiograma na posição transtorácica evidenciando massa em
ventrículo direito.
Fonte: (MORAIS, 2008).
46
Figura 33 Ecocardigrafia de cão evidenciando a presença de efusão pericárdica e
tamponamento ventricular direito durante a sístole.
Fonte: (PASCON; CAMACHO, 2009).
Figura 34 Ilustração de um ecocardiograma seccional evidenciando massa tumoral
melanocítica (TM) em átrio direito colidindo com valva tricúspide; (LV) ventrículo
esquerdo; (RV) ventrículo direito; (RA) átrio direito.
Fonte: (GOSALAKKAL; SUGRUE, 1989).
47
4.2.4 Diagnóstico Diferencial
Tumores cardíacos melanocíticos devem ser diferenciados de outras
patologias que causam derrame pleural além de insuficiência cardíaca congestiva ou
arritmias cardíacas (ORTON, 2005).
Melanomas malignos na base do coração devem ser distinguidos de
linfadenopatia, aumento de tamanho atrial esquerdo, tecidos paratireoidianos ou
tireoidiano aberrantes, pleurite ou pericardite fibrosante (ORTON, 2005).
Deve-se haver cautela a respeito de sons abafados cardíacos, pois estes
podem ser decorrentes de outros problemas como obesidade, derrame pleural de
origem não cardiológica, respirações rasas, consolidação do parênquima pulmonar
ou pneumotórax (NELSON, 2003).
A fibrilação atrial que pode ocorrer em neoplasias cardíacas melanocíticas
geralmente são secundárias a um aumento do átrio esquerdo; outras afecções
também podem causar estes mesmos sintomas e devem ser diferenciadas, tais
como: cardiomiopatia dilatada, degeneração mixomatosa crônica de valva mitral e
degeneração mixomatosa crônica de valva tricúspide (CAVALCANTI et al., 2006).
Trombose de veias supra-hepáticas, trombose de veias cavas superior,
síndrome de compressão de veia cava superior, tumores do mediastino, estenose
pulmonar (quando o animal apresenta insuficiência cardíaca congestiva direita),
afecções orovalvares e os quadros agudos da aorta (nos casos em que o paciente
apresenta desmaios, tonturas, síncopes e convulsões, dentre outros sintomas
inespecíficos) precisam ser considerados também na diferenciação de tumores
cardíacos (LIMA; CROTTI, 2004).
Deve-se ter cautela também com o aumento da área cardíaca devido ao
acúmulo de líquido pericárdico, pois o lúpus eritematoso sistêmico, hipotireoidismo,
desnutrição, insuficiência renal crônica, insuficiência hepática, quadros infecciosos
agudos em pacientes imunossuprimidos podem causar o aumento (além de massas
cardíacas) (LIMA; CROTTI, 2004).
É extremamente importante realizar um diagnóstico diferencial com outras
afecções cardiopulmonares especialmente quando o animal apresenta sinais e
sintomas inespecíficos (LIMA; CROTTI, 2004).
48
4.3 Tratamento
O primeiro passo para o tratamento dos pacientes com tumores melanocíticos
cardíaco consiste em melhorar o aspecto clínico cardiológico do animal, tratar as
arritmias (se houver) os sinais de insuficiência congestiva ou de baixo débito
cardíaco (KISSEBERTH, 2007).
Precisa-se fazer uma terapia sintomática que inclui uma redução da atividade
física e diminuição da ansiedade e estresse, melhora da oxigenação sanguínea e
tecidual, redução do edema, aumento do débito cardíaco e controle das arritmias
(BONAGURA; RUSH, 1998).
O Verapamil é um medicamento que pode ser utilizado para redução da
condução nodular átrio ventricular; é uma terapia aguda em casos de taquicardia
supraventricular; para arritmias cardíacas em geral recomenda-se medicamentos
como a Lidocaína ou Amiodarona; para fibrilação atrial o Diltiazem é indicado; ele
reduz a condução nodular átrio ventricular, melhora o relaxamento ventricular e é um
vasodilatador arterial; Enalapril é um inibidor de ECA e vasodilatador; outro
medicamento importante que poderia ser utilizado ao invés do Enalapril é o Lotensin,
também vasodilatador; medicamentos vasodilatadores são utilizados quando o
animal apresenta sintomas de insuficiência cardíaca congestiva; quando
demonstram baixo débito cardíaco, choque cardiogênico devido a edema pulmonar
associado com hipotensão administra-se Dobutamina; esta é uma droga inotrópica
positiva potente que é utilizada no tratamento de emergência de insuficiência
cardíaca com risco de vida; em casos de ascite, derrame pleural, edema pulmonar
pode-se utilizar diuréticos como a Furosemida somente ou associada à
Espironolactona (dependendo da gravidade do edema) (BONAGURA; MUIR III,
1998 E BONAGURA; RUSH, 1998).
As drogas cardíacas administradas não curam as lesões ocasionadas pela
neoplasia melanocítica, mas podem prolongar e melhorar a qualidade de vida do
paciente devido ao alívio obtido dos sinais de insuficiência cardíaca congestiva,
diminuição do débito cardíaco ou tamponamento (REED; CROW, 1998).
Infelizmente, muitas vezes, sem o tratamento tumoral eficaz o tratamento
clínico das alterações hemodinâmicas cardiológicas torna-se refratário
(KISSEBERTH, 2007).
Necessita-se fazer pericardiocentese sempre que ocorrer tamponamento
cardíaco no paciente. Pode-se fazer uma pericardectomia parcial para prevenir a
recorrência de tamponamento; não é recomendada a abertura cirúrgica de uma
pequena janela pericárdica e é preferível remover o saco pericárdico ventral aos
nervos frênicos; em alguns doentes utiliza-se cateter para a criação de uma janela
pericárdica; este procedimento é menos invasivo (WARE, 2002).
Dependendo da evolução e tamanho do tumor aliviar o tamponamento
cardíaco pode proporcionar boa qualidade de vida ao paciente durante algum tempo
(NELSON, 2003).
Não há comprovação do benefício da utilização de glicocorticóide em dose
antiinflamatória (WARE, 2002).
A quimioterapia, embora não muito eficaz, pode tornar-se aconselhável
quando não for possível a extirpação cirúrgica do tumor (REED; CROW, 1998).
A Ciclofosfamida e a Melfalana são boas escolhas terapêuticas, devido seu
uso oral ser permitido (REED; CROW, 1998).
49
A instilação intratorácica de Trietilenotiofosforamida (tioTEPA) ou de
Cisplatina após a pericardectomia para tratamento de derrame maligno causado
pela massa tumoral tem tido destaque (REED; CROW, 1998).
Infelizmente nenhuma droga antineoplásica tem mostrado uma grande
efetividade contra o Melanoma cardíaco, tanto como na terapia adjuvante (após a
exérese cirúrgica do tumor) ou no tratamento avançado. Em tumores mais
avançados e já metastatizados, pode-se utilizar uma quimioterapia com a
associação das seguintes drogas: DTIC e Metil-CCNU; DTIC + BCNU e Vincristina;
DTIC + BCNU e Hidroxiuréa; entretanto os resultados são precários, a resposta ao
tratamento é baixa e a sobrevida também. Uma melhor resposta no tratamento com
regressão tumoral foi observada na associação de DTIC + BCNU + Cisplatina e
Tamoxifen (GOMES, 1997 E DOBSON; MORRIS, 2001).
Alguns protocolos terapêuticos imunoterápicos tem sido utilizados como
adjuvantes do Melanoma Maligno ou em tumores mais avançados como:
Interferonalfa (adjuvante), Interleucina-2 e anticorpos monoclonais em associação a
agentes citotóxicos, radioisótopos ou imunotoxinas que são direcionados contra os
antígenos de superfície das células melanocíticas (GOMES, 1997).
Quando ocorre um comprometimento de forma difusa do órgão, a utilização
de quimioterapia é questionável; nestes casos a cirurgia de ressecção do tumor
pode ser uma boa opção de tratamento (MORAIS, et al., 2008).
A extirpação cardíaca do tumor é indicada em casos de metástases solitárias
no coração, com ausência de metástases em outros órgãos; também pode ser
realizada para aliviar a obliteração das câmaras cardíacas ou obstrução valvular; se
os tumores de origem não tiverem sido retirados com sucesso e o animal não tenha
um bom prognóstico a cirurgia não é indicada (MONTEIRO, s.d.).
A opção de cirurgia não deverá ser anulada mesmo que a ressecção não
possa ser realizada por completo (PINHO et al., 2009).
Em casos de melanomas pediculados, sésseis, pequenos e que possam ser
extirpados, a exérese é a melhor indicação; a ressecção cirúrgica de melanomas
que infiltram nas paredes do coração tem maior taxa de morbidade e mortalidade;
apesar do tratamento cirúrgico ser mais aconselhável, tem que ser levada em
consideração as condições do coração e da neoplasia, a fragilidade do órgão
acometido e a faixa etária do paciente; estes fatos determinam a alta mortalidade
pós-cirúrgica (LIMA; CROTTI, 2004).
Dobson e Morris (2001) afirmaram que há poucos relatos sobre o uso da
radioterapia no tratamento dos tumores cardíacos em animais, apesar da radiação
poder ser utilizada como medida paliativa em pacientes humanos com tumores
inoperável ou recorrente.
50
4.4 Prognóstico
O melanoma apresenta um comportamento clínico imprevisível; além disso
quando ocorre a metastatização cardíaca provavelmente o paciente apresenta
também uma participação extracardíacas, fazendo-se necessário o uso de
quimioterapia que nem sempre surti efeitos (SAVOI A et al., 2000).
O prognóstico depende principalmente da terapêutica disponível para o tumor
e da extensão do envolvimento do coração (MONTEIRO, s.d.).
Melanomas cardíacos pediculados, sésseis e pequenos podem ter um bom
prognóstico quanto à exérese dos mesmos. Melanomas que infiltram a parede do
coração tem péssimo prognóstico, e altos índices de mortalidade e morbidade
(LIMA; CROTTI, 2004).
A faixa etária do paciente acometido pelo melanoma (em geral idosos) e a
fragilidade do coração tornam o prognóstico bem reservado (LIMA; CROTTI, 2004).
Animais com melanoma disseminado e com metástases cardíacas
apresentam sobrevida extremamente baixa, com ou sem tratamento. A evolução
clínica normalmente é desfavorável; pacientes com melanoma cardíaco morrem em
média dentro de 46 dias a 5 meses após o diagnóstico ou menos (LIMA; CROTTI,
2004; KISSEBERTH, 2007 E MONTEIRO, s.d.).
51
5 Metodologia
Para a realização deste trabalho analisou-se os prontuários de pacientes
acometidos com neoplasias melanocíticas mediante a compilação de casos
atendidos no Hospital Veterinário da Universidade Metodista de São Paulo e
diagnosticados no Laboratório de Histopatologia da Faculdade da Saúde - UMESP
(Serviço de Patologia do HOVET-UMESP) no período de maio de 2001 a março de
2011.
Analisou-se os seguintes dados nos prontuários dos animais: idade, sexo,
raça, localização anatômica primária da neoplasia, anamnese e semiologia do
sistema cardiovascular, se os pacientes apresentavam sinais clínicos de
cardiopatias, se ocorreram recidivas e/ou metástases do tumor, raio –x da região
torácica e eletrocardiograma.
52
6 resultados
Dos 1490 exames histopatológicos analisados (entre maio de 2001 a março
de 2011), 68,2% deles foram diagnosticados como neoplasias (diversas como
carcinomas, linfomas, hemangiossarcomas, dentre outras; benignas ou malignas e,
dentre estas, com vários graus de malignidade e em órgãos distintos como por
exemplo pulmão, fígado, mamas).
Porcentagem das Neoplasias noTotal de Exames
Histopatológicos Realizados no Laboratório de Patologia
HOVET Metodista entre março de 2001 a maio de 2011
31,8%
Diversas afecções (em
órgãos variados)
68,2%
Neoplasias variadas,
benignas ou malignas em
órgãos distintos
Figura 35 Gráfico representando a porcentagem de animais acometidos por diversos
tipos de neoplasias diagnosticados no Laboratório de Patologia do HOVET
Metodista.
Fonte: (Arquivo Pessoal, 2011)
53
Do total destas neoplasias 1,28% foram diagnosticadas como melanoma
maligno.
Porcentagem de Pacientes que Apresentaram
Melanoma dentre Várias Neoplasias
Diagnosticadas
1,28%
Neoplasias Diversas
Melanoma Maligno
98,72%
Figura 36 Porcentagem dos pacientes estudados acometidos por melanoma
maligno.
Fonte: (Arquivo Pessoal, 2011).
61,5% dos pacientes diagnosticados com este tipo de tumor apresentavam
alguma alteração cardiológica (evidenciada no raio-x, eletrocardiograma ou através
do exame clínico); 15,4% dos pacientes com melanoma tinham indícios de
metástase pulmonar e 15,38% apresentaram recidiva do tumor.
Porcentagem de Pacientes com Melanoma que
Apresentaram Alterações Cardiovasculares
Porcentagem
80.00%
Pacientes com
alterações
cardiovasculares
60.00%
40.00%
Pacientes sem
alterações
cardiovasculares
20.00%
0.00%
Categoria do Paciente
Figura 37 Porcentagem de pacientes com ou sem alterações cardiovasculares.
Fonte: (Arquivo Pessoal, 2011).
54
Porcentagem de Pacientes com Melanoma que Apresentaram
Metástase Pulmonar
Porcentagem
100.00%
80.00%
60.00%
Pacientes sem metástase
pulmonar
40.00%
Pacientes com metástase
pulmonar
20.00%
0.00%
Categoria do Paciente
Figura 38 Porcentagem de Pacientes que Apresentaram ou não Metástase
Pulmonar
Fonte: (Arquivo Pessoal, 2011).
Animais que Apresentaram Recidiva do Tumor
90.00%
80.00%
POrcentagem
70.00%
60.00%
50.00%
Animais que apresentaram
recidiva do tumor
40.00%
Animais sem recidiva
30.00%
20.00%
10.00%
0.00%
Categoria do Paciente
Figura 39 Porcentagem de animais que apresentaram ou não recidiva do tumor.
Fonte: (Arquivo Pessoal, 2011).
55
Quadro 1
Casos diagnosticados com Melanoma Maligno no Laboratório de Histopatologia da
Faculdade da Saúde - HOVET-UMESP de maio de 2001 a março de 2011
*RI
Raça
Idade
sexo
Localização
tumoral
Diagnóstico
Histopatológico
17374
Rottweiler
7
Fêmea
conduto
auditivo
direito
Melanoma
Dérmico
21273
Rottweiler
10
Macho
a-olho
esquerdo
b-1° dígito
a- Melanoma
maligno
Epitelióide
b- Melanoma
maligno
Epitelióide
17258
Rottweiler
10
Fêmea
região
gengival
superior
direita
Melanoma
melânico
maligno padrão
misto
moderadamente
diferenciado
11111
Poodle
13
Fêmea
cavidade
oral
Melanoma
melanótico
maligno
composto
diferenciado
14829
Poodle
11
Macho
formação
em
mandíbula
Melanoma
19393
Poodle
11
Fêmea
formação
em gengiva
Melanoma
melanótico
composto
maligno padrão
epitelióide bem
diferenciado
2112
*SRD
11
Fêmea
pálpebra
esquerda
Melanoma
padrão
epitelióide
21220
SRD
14
Macho
formação
em
pálpebra
Melanoma
melanocítico
maligno dérmico
56
inferior
direita
moderadamente
diferenciado
17429
Cocker
spaniel
11
Fêmea
cavidade
oral
Melanoma misto
2101
Beagle
6
Macho
formação
em
pálpebra
inferior
direita
Melanocitoma
dérmico
12659
Pinscher
12
Macho
formação
em região
de palato
mole,
orofaringe e
gengiva
Melanoma
Fusiforme
15847
Mastiff
6
Fêmea
2° falange
em membro
pélvico
direito
Melanoma
amelânico
composto
padrão
epitelióide
23360
Pit bull
8
Macho
cutâneo
Melanoma
melanótico
composto
Fonte: (Arquivo do Laboratório de Patologia do HOVET-UMESP, 2011).
*RI: registro interno do Hospital Veterinário Metodista; *SRD: sem raça definida.
57
Incidência do Melanoma por Sexo
46,2%
53,8%
Fêmeas
Machos
Figura 40 Gráfico representando a porcentagem da incidência do melanoma de
acordo com o sexo.
Fonte: (Arquivo Pessoal, 2011).
Incidência do Melanoma por Idade
7,69%
7,69%
7,69%
15,38%
6 anos
7,69%
7,69%
7 anos
8 anos
10 anos
30,76%
15,38%
11 anos
12 anos
13 anos
14 anos
Figura 41 Gráfico representando a incidência do melanoma por idade do paciente.
Fonte: (Arquivo Pessoal, 2011).
58
Incidência do Melanoma por Raças
7,69%
7,69%
Rottweiler
23,7%
Poodle
7,69%
SRD
7,69%
Cocker Spaniel
7,69%
23,7%
Beagle
Pincher
15,38%
Mastiff
Pit bull
Figura 42 Gráfico representando a incidência do melanoma por raças.
Fonte: (Arquivo Pessoal, 2011).
Regiões acometidas pelo Melanoma
Conduto auditivo
7,69%
15,38%
7,69%
Formação em mandíbula
7,69%
7,69%
23,07%
38,46%
Formação em olho
Formação em cavidade
oral, gengiva e pálato
Formação em Pálpebra
Formação em dígito e
falange
Formação Cutânea
Figura 43 Gráfico representando as regiões acometidas pelo melanoma.
Fonte: (Arquivo Pessoal, 2011).
Em relação à realização de exames 61,5% dos pacientes analisados fizeram
eletrocardiograma; 38,46% realizaram raio-x. Nenhum foi submetido ao
ecocardiograma.
59
Animais Acometidos por Melanoma que Realizaram
Eletrocardiograma
70.00%
Porcentagem
60.00%
50.00%
40.00%
30.00%
20.00%
Animais que realizaram
eletrocardiograma
Animais que não
realizaram
eletrocardiograma
10.00%
0.00%
Pacientes que realizaram ou não eletrocardiograma
Figura 44 Gráfico representando a realização ou não de eletrocardiograma.
Fonte: (Arquivo Pessoal, 2011).
Animais acometidos por Melanoma que realizaram Raiox do Tórax
70.00%
Porcentagem
60.00%
50.00%
40.00%
30.00%
20.00%
Animais que realizaram
raio-x
Animais que não
realizaram raio-x
10.00%
0.00%
Pacientes que realizaram ou não raio-x de tórax
Figura 45 Gráfico representando a realização ou não de raio-x de tórax.
Fonte: (Arquivo Pessoal, 2011).
60
7 Discussão
Como se pôde observar nos resultados e na literatura, o melanoma inicia-se
com maior frequência no tecido cutâneo, olhos e cavidade oral dos cães e,
principalmente, em animais mais velhos, em torno dos 11 anos na maioria das vezes
e com hiperpigmentação, como, por exemplo, o Rottweiler. Machos e fêmeas
tiveram um acometimento de proporções praticamente iguais.
A porcentagem de animais com melanoma que apresentaram alterações
cardiovasculares foi alta.
O animal de RI (registro interno) 21273 fez eletrocardiograma de rotina para
cirurgia de retirada do tumor melanocítico em olho esquerdo e dígito; apresentou um
bloqueio átrio ventricular de 1º grau além de distúrbio de condução no ramo
descendente sugestivos de massa cardíaca como descrito na literatura. Após a
retirada do tumor o paciente não voltou mais ao hospital.
O paciente 17429 realizou raio-x torácico pois desconfiava-se de metástase
pulmonar; apresentou silhueta cardíaca no limite máximo de tamanho, traquéia com
discreto desvio dorsal na porção pré terminal; em incidência ventro dorsal observouse aumento da câmara atrial direita; quando em decúbito lateral direito verificou-se
hepatomegalia (que poderia ter sido causado por uma Insuficiência Cardíaca
Congestiva direita decorrente de um tumor secundário cardíaco). Também foi notada
uma área de maior opacificação localizada em lobo pulmonar caudal no terço
próximo do 10º espaço intercostal; não foi afirmado se era uma metástase pulmonar
ou sobreposição. O animal também fez eletrocardiograma para a realização de
exérese do tumor primário em que apresentou desvio de eixo acentuado à direita e
bloqueio fascicular (infiltrações tumorais melanocíticas no sistema de condução
podem desencadear distúrbios de condução no sistema elétrico do coração). Ao
exame físico e anamnese detectou-se dispnéia, animal ofegante mesmo em repouso
e cansaço fácil. Houve recidiva (no mesmo local de origem) do tumor em torno de 15
dias após o procedimento cirúrgico; o crescimento foi progressivo; o paciente não
fez quimioterapia e não voltou mais ao hospital.
O
animal
2112
apresentou
metástase
pulmonar
evidenciada
radiograficamente; ao exame físico foram auscultadas bulhas hipofonéticas
irregulares (tamponamento cardíaco devido a tumores pode provocar abafamento
dos sons do coração). O melanoma do paciente apresentava grau I de malignidade.
O paciente 14829 possuía uma formação de crescimento progressivo e
agressivo; realizou um eletrocardiograma o qual sugeriu que o animal apresentava
uma sobrecarga do ventrículo esquerdo e hipóxia do miocárdio (que pode ser
causada por alterações hemodinâmicas secundárias ao tumor mestastático).
O animal de RI 19393 fez uma radiografia torácica em que foi evidenciada
traquéia deslocada à direita em sua porção pré terminal (massas secundárias
presentes na base do coração podem causar o deslocamento dorsal da traquéia); ao
eletrocardiograma observou-se taquicardia sinusal com contrações ventriculares
prematuras (taquiarritmias ventriculares são comuns quando há presença de massa
cardíaca melanocítica e podem ser consideradas a principal forma de manifestação
tumoral; essas arritmias podem estar relacionadas ao estímulo mecânico gerado
pelo tumor ou ao edema que pode ocorrer ao redor da massa).
O paciente 29418 realizou um raio-x em que apresentou uma silhueta
cardíaca aumentada de tamanho havendo um maior contato com o esterno e a
traquéia com deslocamento discreto dorsal na região da carina traqueal (terminal);
61
foi verificado hepatomegalia e esplenomegalia e campos pulmonares de padrão
misto – intersticial difuso com brônquios apresentando paredes espessadas. O
exame físico e anamnese evidenciaram bulhas hipofonéticas irregulares com sopro
grau III e IV/ VI em foco mitral (o comprometimento hemodinâmico desencadeado
por uma massa quando em pressões altamente elevadas podem levar a
Insuficiência Cardíaca Congestiva Esquerda e degeneração de valva mitral) e tosse
seca (pode ocorrer quando a massa neoplásica atinge o corpo da aorta ou o átrio
direito).
O animal 12659 apresentou recidiva após exérese do tumor; não retornou ao
hospital.
O paciente 15847 realizou uma radiografia do tórax para pesquisa de
metástase pulmonar (a qual foi confirmada); evidenciou-se, também, desvio dorsal
discreto da traquéia em porção terminal.
O animal de RI 2101 apresentou recidiva do tumor após extirpação cirúrgica;
quando realizado o exame físico auscultou-se bulhas hipofonéticas irregulares; a
anamnese demonstrou que o paciente apresentava engasgos constantes. Tumores
melanocíticos em pálpebra são extremamente agressivos e comportam-se de
maneira semelhante ao melanoma oral com uma alta incidência de metástases para
os gânglios linfáticos locais e, através do sangue, para os pulmões e outros órgãos
como o coração (DOBSON; MORRIS, 2001).
As metástases cardíacas ou pericárdicas devem ser levadas em consideração
sempre que um animal cujo apresente um melanoma maligno desenvolve sintomas
cardiovasculares, principalmente se esses ocorrerem em comunhão com
cardiomegalia, sopro, distúrbios de condução ou arritmias (MORAIS et al.,2008).
Pode-se não haver sinais clínicos, principalmente se o melanoma cardíaco
for pequeno, sendo este apenas achado de necropsia. Por isso faz-se necessária a
realização do ecocardiograma em melanomas mais agressivos.
62
8 Conclusão
Pode-se concluir com o trabalho apresentado que com o aumento da
expectativa de vida dos animais domésticos doenças cardíacas e neoplasias vem
tornando-se cada vez mais comum na rotina da Clínica Médica Veterinária.
Os melanomas e demais tumores cardíacos podem manifestar-se através de
arritmias e distúrbios do ritmo cardíaco, obstruindo ou não o fluxo sangüíneo ao
coração; quando ocorre a obstrução, tumores melanocíticos podem causar diversos
sintomas de insuficiência cardíaca congestiva direita ou esquerda devido ao
tamponamento cardíaco, efusão pericárdica ou pleural, dentre outras anormalidades.
Em contrapartida, dependendo do tamanho da massa ou da localização cardíaca o
paciente pode não apresentar sinais clínicos (o que ocorre na maioria das vezes),
sendo apenas achados de necropsia futuramente.
Portanto em pacientes com melanomas agressivos faz-se necessária a
inclusão do ecocardiograma nos exames de rotina para que ocorra um diagnóstico
precoce, caso haja presença de massa cardíaca metastática, e seja possível um
tratamento prematuro. Embora neoplasias cardíacas (dentre elas o melanoma)
acarretem um prognóstico sombrio, podem ser ressecadas (total ou parcialmente) se
ainda pequenas, mesmo que de modo paliativo. Além de que se pode tentar um
tratamento quimioterápico para, talvez, obter-se a regressão total ou parcial do
tumor. Pensando-se na melhoria da qualidade de vida dos pacientes, o Médico
Veterinário também tem a possibilidade de medicar animais contra os efeitos
deletérios dos sinais clínicos, mesmo sem a possibilidade de cura do tumor.
63
Referências
ALMEIDA, J. M. Embriologia Veterinária Comparada. Rio de Janeiro: Editora
Guanabara Koogan S.A, 1999.
ANATOMIA e fisiologia do coração. [S.I]. s.d. Disponível em:
<http://www.misodor.com/CORACAO.php>. Acesso em: agosto de 2011.
ARGYLE, D.J.; KHANNA, C. Tumor Biology and Metastasis. In: WITHROW, S.J.;
MACEWEN’S. Small Animal Clinical Oncology, 4. ed. Missouri: Saunders Elsevier,
2007. p. 42-43.
BARBIERI, G. Linfoma Mediatinal em um gato com microcardia - Relato de
caso. In clinicafarobarbieri.blogspot.com. 2010. Disponível em:
< http://clinicafarobarbieri.blogspot.com/2010/11/linfoma-mediatinal-em-um-gatocom.html>. Acesso em: abril de 2011.
BONAGURA, J.D.; MUIR III, W.W. Drogas para Tratamento de Doenças
Cardiovasculares. In: BICHARD, S.J.; SHERDING, R.G. Manual Saunders: Clínica
de Pequenos Animais. São Paulo: Roca, 1998. p.493-500.
BONAGURA, J.D.; RUSH, J. Insuficiência Cardíaca. In: BICHARD, S.J.; SHERDING,
R.G. Manual Saunders: Clínica de Pequenos Animais. São Paulo: Roca, 1998.
p.501-509.
BORGES, J. Migração de células não tumorais ‘anuncia’ os locais de formação de
futuras metástases. Ciência Hoje, UOL, 17, fevereiro de 2006. Ciência. Disponível
em:< http://cienciahoje.uol.com.br/colunas/por-dentro-das-celulas/as-emissarias-damorte>. Acesso em: março de 2011.
CASTRO, M.G.; VEADO, J.C.C.; SILVA, E.F.; ARAÚJO, R.B. Estudo Retrospectivo
Ecodopplercardiográfico das Principais Cardiopatias Diagnosticadas em Cães.
Arquivo Brasileiro de Medicina Veterinária e Zootecnia, v.61, n.5, p.1238-1241,
2009. Disponível em:< http://www.scielo.br/pdf/abmvz/v61n5/a32v61n5.pdf>. Acesso
em: maio de 2011.
CAVALCANTE, J.A. Avaliação da Incidência do Melanoma em um Estudo
Retrospectivo de 37 Cães (canis familiaris) com Neoplasias, Atendidos na
Clínica Escola de Medicina Veterinária da Universidade Castelo Branco e na
Clínica Veterinária Ossian. 2006. 69 f. Trabalho de Conclusão do Curso de Pós Graduação (Curso de Especialização em Clínica Cirúrgica de Pequenos Animais) Coordenação de Pós - Graduação “lato sensu” em clínica cirúrgica em pequenos
64
animais, Universidade Castelo Branco, Rio de Janeiro, 2006. Disponível em:
<http://www.qualittas.com.br/documentos/Avaliacao%20da%20Incidencia%20do%20
Melanoma%20-%20Jose%20Alberto%20Cavalcante.PDF>. Acesso em: abril de
2011.
CAVALCANTI, G.A.O.; MUZZI, R.A.L.; BEZERRA JÚNIOR, P.S.; NOGUEIRA, R.B.;
VARASCHIN, M.S. Fibrilação Atrial em Cão Associada ao Quimiodectoma Infiltrativo
Atrial: Relato de Caso. Arquivo Brasileiro de Medicina Veterinária e Zootecnia,
Lavras, v.58, n.6, p.1043-1047, 2006. Disponível em:
<http://www.scielo.br/pdf/abmvz/v58n6/11.pdf>. Acesso em: janeiro de 2011.
DOBSON, J.; MORRIS, J. Small Animal Oncology. Iowa: Blackwell Science Ltd,
2001. p. 266-269.
DYCE,K.M.; SACK, W.O.; WENSING, C.J.G. Tratado de Anatomia Veterinária. Rio
de Janeiro: Guanabara Koogan, 1997.p.171-180.
FARROW, C.S. Veterinária Diagnóstico por Imagem do Cão e Gato. São Paulo:
Roca, 2006.p. 553-555.
FERRO, D.G.; LOPES, F.M.; VENTURINI, M.A.F.A.; CORREA, H.L.; GIOSO, M.A.
Prevalência de neoplasias da cavidade oral de cães atendidos no Centro
Odontológico Veterinário – Odontovet®-SP – entre 1994 e 2003. Arquivo de
Ciência Veterinária e Zoologia, Umuarama, vol. 7, n.2, p. 123-128, jul./dez. 2004.
Disponível em:
<http://tapajo.unipar.br/site/ensino/pesquisa/publicacoes/revistas/revis/view03.php?a
r_id=1589>. Acesso em: abril de 2011.
FRANKS, L.M.; TEICH, N.M. Introdução à Biologia Celular e Molecular do
Câncer. 5 ed. São Paulo: Roca, 1990.
GOMES, R. Oncologia Básica. Rio de Janeiro: Revinter, 1997.p.123-129.
GOSALAKKAL, J.A.; SUGRUE, D.D. Malignant Melanoma of the Right Atrium:
Antemortem Diagnosis by Transvenous Biopsy. British Heart Journal, [S.L.], vol.
62, n. 2, p. 159-160, ago. 1989. Disponível em:<
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1216751/>. Acesso em: fevereiro de
2011.
HAGE, M.C.F.N.S. et al. Efusão Pericárdica Causada por Neoplasia de Células
Mesenquimais – Aspectos Radiográficos, Ultra-Sonográficos e Citológicos. 2008. In:
65
CONBRAVET, 2008, Minas Gerais. Anais... Minas Gerais: Universidade Federal de
Viçosa, 2008. p.1-6. Disponível em:
< http://www.sovergs.com.br/conbravet2008/anais/cd/resumos/R0575-3.pdf>. Acesso
em julho de 2011.
INCA. Fisiopatologia do câncer. 2. ed. Rio de Janeiro: INCA, 2002. p. 55-81.
Disponível em: <www.inca.gov.br/enfermagem/docs/cap2.pdf>. Acesso em: maio de
2011.
JONES, T.C.; HUNT, R.D.; KING, N.W. Patologia Veterinária. 6 ed. São Paulo:
Manole. 2000. p. 95-103.
JUNQUEIRA, L. C .; CARNEIRO, J. Histologia Básica. 9 ed. Rio de Janeiro:
Guanabara Koogan, 1999.
KISSEBERTH, W.C. Neoplasia of the Heart. In: WITHROW, S.J.; MACEWEN’S.
Small Animal Clinical Oncology, 4. ed. Missouri: Saunders Elsevier, 2007. p. 810814.
LIMA, P.R.L.de; CROTTI, P.L.R. Tumores Cardíacos Malignos. Revista Brasileira
de Cirurgia Cardiovascular, Cuiabá, v.19, n.1, p. 64-73, Jan./Mar.2004. Disponível
em: <http://www.rbccv.org.br/detalhe_artigo.asp?id=374>. Acesso em: janeiro de
2011.
MANZAN, R.M.; SANTOS JÚNIOR, A.R.; PERINELLI, S.C.; BERTONCELLI, M. de
F.; ZICA, V.P. Considerações Sobre Melanoma Maligno em Cães: Uma Abordagem
Histológica. Bol. Medicina Veterinária, Espírito Santo do Pinhal, v. 01, n. 01, p. 4147, jan./dez. 2005. Disponível em:
<http://189.20.243.4/ojs/bolmedvet/viewarticle.php?id=4>. Acesso em: janeiro de
2011.
MARTA ,G.N. Melanoma de Mucosa Oral. Revista Brasileira de Cancerologia. São
Paulo, v.53, n.1, p.35-39, 2006. Disponível
em:<http://www.inca.gov.br/rbc/n_53/v01/pdf/relato_caso2.pdf>. Acesso em: abril de
2011.
MELBIN, J.; DETWEILER, D.K. Sistema Cardiovascular e Fluxo Sanguíneo. In:
SWENSON, M.J. (edição); REECE, W.O. (edição). Dukes: Fisiologia dos Animais
Domésticos. 11 ed. Rio de Janeiro: Guanabara Koogan, 1996. p.57.
66
MONTEIRO, F.J.M. Revisão da metastatização cardíaca a propósito de dois
casos clínicos de metástases cardíacas de origem em tumores germinativos
do testículo. s.d. 27p. Mestrado Integrado em Medicina, Artigo de Revisão -Instituto
de Ciências Biomédicas Abel Salazar, Universidade do Porto, Cidade do Porto, s.d.
Disponível em:
<http://repositorioaberto.up.pt/bitstream/10216/21044/2/TESEfinal.pdf>. Acesso em:
maio de 2011.
MOORE, K. L.; PERSAUD, T.V.N. Embriologia Clínica. 5 ed. Rio de Janeiro:
Guanabara Koogan, 1994.
MORAIS et al.Tumor em Ventrículo Direito em Paciente com Melanoma. Arquivo
Brasileiro de Cardiologia, Porto Alegre, v. 91, n. 03, p. 21-24, 2008. Disponível em:
<http://www.scielo.br/scielo.php?pid=S0066782X2008001500012&script=sci_arttext>
Acesso em: abril de 2011.
MOURA, V.M.B. de et al. Quimiodectoma Como Causa de Morte Súbita em Cão –
Relato de Caso.Notícias Veterinárias, Uberlândia, v. 12, n. 1, p. 95-99, jan./jun.
2006. Disponível em: <http://www.vetnot.famev.ufu.br/viewarticle.php?id=47>.
Acesso em: fevereiro de 2011.
NELSON, O.L. Small Animal Cardiology. ed. Ilustrada. Missouri: ButterworthHeinemann, 2003. p. 136-137.
ORTON, C. Cirurgias Cardiovasculares. In: FOSSUM, T.W. et al. Cirurgia de
pequenos animais. 2.ed. São Paulo : Roca, 2005. p. 706-708.
OZYUNCU, N. Cardiac Metastasis of Malignant Melanoma: A Rare Cause
of Complete Atrioventricular Block. Europace, Turquia, v. 08, n. 07, p. 545-548, abr.
2006. Disponível em: <http://www.ncbi.nlm.nih.gov/pubmed/16798769>. Acesso em:
julho de 2011.
PARREIRA, I.M.; KEGLEVICH, E. As Neoplasias em Cães. Enciclopédia Biosfera,
1 ed. [S.L.]: [s.n.], 2005. ISSN 1809-0583.
PASCHOAL, A.T. et al. Metástase tumoral de pulmão com invasão cardíaca: relato
de um caso e revisão da literatura. Pulmão RJ, Rio de Janeiro, v.13, n.03, p.195199, jul./ago./set. 2004. Disponível em:
<http://www.sopterj.com.br/revista/2004_13_3/08.pdf>. Acesso: em fevereiro de
2011.
67
PASCON, J.P.E.; CAMACHO, A.A. Diagnóstico, Tratamento e Sobrevida em Cães
com Efusão Pericárdica: Relato de Dois Casos Infrequentes de Linfossarcoma. ARS
Veterinária, Jaboticabal, v.25, n.1, p. 04-08, 2009. Disponível em:
<http://www.arsveterinaria.org.br/index.php/ars/article/view/250/166>. Acesso em:
abril, 2011.
PELETEIRO, M.P.; ORVALHO, J.S. Anatomia Patológica Veterinária. In
Faculdade de Medicina Veterinária – Universidade Técnica de Lisboa. 2001.
Disponível em:<
http://www.fmv.utl.pt/atlas/cardiovascular/paginas_pt/cardio_013.htm>. Acesso em:
maio de 2011.
PINHO, T. et al. Metástase Cardíaca de Melanoma de Origem Primária
Desconhecida. Revista Portuguesa de Cardiologia, Porto, v. 28, n. 5, p. 633-639,
mai. 2009. Disponível em: <http://cat.inist.fr/?aModele=afficheN&cpsidt=21702093>.
Acesso em maio de 2011.
REED, J.R.; CROW, S.E. Pericardiopatia e Neoplasia Cardíaca. In: BICHARD, S.J.;
SHERDING, R.G. Manual Saunders: Clínica de Pequenos Animais. São Paulo:
Roca, 1998. p.544-548.
SAMPAIO et al. Efusão pleural secundária a tumor de corpo aórtico em cães: relato
de 3 casos. Pesquisa Veterinária Brasileira, Uberaba, v.1, n.1, p. 1-17, s.d.
Disponível em:
<http://www.uniube.br/hv/pesquisas/arquivos_cientificos/efusao_rs.pdf>.Acesso em:
abril de 2011.
SANTOS, P.C.G. dos; COSTA, J.L.O. MIYAZAWA, C.R.; SHIMIZU, F.A.
Melanoma Canino. Revista Científica Eletrônica de Medicina Veterinária, Garça,
periodicidade semestral, n.5, p.1-4, jul.2005, ISSN 1679-7353. Disponível em:
<http://www.revista.inf.br/veterinaria05/relatos/relato08.pdf>. Acesso em: janeiro de
2011.
SAVOIA, P.; FIERRO, M.T.; ZACCAGNA, A.; BERNENGO, M.G. Metastatic
Melanoma of the Heart. Journal of Surgical Oncology, Torino, Itália, v. 75, p. 203207, 2000. PubMed – indexado por MEDLINE.
SCOTT, D.W ; MULLER, G.H.; KIRK, R.W.; GRIFFIN, C.E. Muller & Kirk:
Dermatologia de Pequenos Animais. 5 ed. Rio de Janeiro: Interlivros, 1996.
SÍNDROMES paraneoplásicas. In Cancro: Factores de Risco. 2009. Disponível
em:< http://dsecxxicancro.blogspot.com/2009_05_01_archive.html>. Acesso em: abril
de 2011.
68
SILVEIRA, M.P. et al. Insuficiência Cardíaca Congestiva Direita Secundária a
Hemangiossarcoma Ventricular Primário em um Cão- Relato de Caso. Revista de
Veterinária e Zootecnia, São Paulo, v. 17, n. 1, supl 41, mar. 2010, ISSN 01025716. Resumo. Disponível em:
<http://www.fmvz.unesp.br/revista/volumes/vol17_n1_supl/Suplemento_v17_n1_supl
_41.pdf>. Acesso em: maio de 2011.
SOUZA, R.J.S.A.P. et al. Estimativa do Custo do Tratamento de Câncer de Pele Tipo
Melanoma no Estado de São Paulo- Brasil. Anais Brasileiros de Dermatologia,
Ribeirão Preto, v. 84, n. 3, p. 237-243, set., 2009. Disponível em:<
http://www.scielo.br/pdf/abd/v84n3/v84n03a04.pdf>. Acesso em: abril de 2011.
WARE, W.A. Neoplasias Cardíacas. In: GOODWIN, J.; TILLEY, L.P. Manual de
Cardiologia para Cães e Gatos.3 ed. São Paulo: Roca, 2002. p. 249-258.