Química Aplicada à Engenharia Civil
Ciné
Cinética Quí
Química
Ciné
Cinética Quí
Química
Profa. Geisamanda Pedrini Brandão Athayde
Ciné
Cinética Quí
Química
O conhecimento e o estudo da velocidade das reações
são muito importantes em termos industriais, e também
estão relacionados ao nosso dia-a-dia, como por
exemplo, quando colocamos um alimento na panela de
pressão para acelerar seu cozimento.
Ciné
Cinética Quí
Química
No foguete quando o combustível é oxidado
na câmara de combustão, libera-se calor
aumentando a energia cinética de suas
moléculas. Assim que os gases quentes são
expelidos pelo escapamento, essa energia é
utilizada para lançar o projétil.
As reações químicas ocorrem com velocidades diferentes e
estas podem ser alteradas, porque além da concentração de
reagentes e produtos, as velocidades das reações dependem
também de outros fatores como:
Ciné
Cinética Quí
Química
Ciné
Cinética Quí
Química
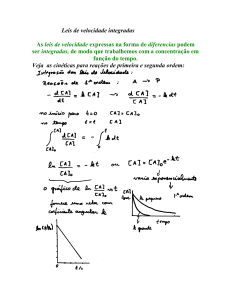
Velocidade de uma reaç
reação
Velocidade média de uma reação
A velocidade de uma reaç
reação é definida como a
variaç
variação da concentraç
concentração de produtos ou de
DeterminaDetermina-se
medindo
a
diminuiç
diminuição
Br2(aq) + HCOOH (aq) → 2Br-(aq) + 2H+(aq) + CO2 (g)
velocidade
reagentes que ocorrem por unidade de tempo.
Consideremos a reaç
reação:
média = −
[Br 2 ]final
− [Br 2 ]inicial
∆ [Br 2
=
t final − t inicial
∆t
]
da
concentraç
concentração dos reagentes ou o aumento da
concentraç
concentração dos produtos.
A diminuição da concentração de bromo à medida que o tempo
passa manifesta-se por uma perda de cor da solução.
8
Velocidade de uma reação
Velocidade média de uma reação
A→B
Supondo a reação:
o Para t = 0 (início da reação) há 1,00 mol de A (100 esferas pretas) e B
não está presente.
Para t = 20 min, existem 0,54 mol A e 0,46 mol B
Para t = 40 min, existem 0,20 mol A e 0,80 mol B
A velocidade média da reação depois de 20 e de 40 min será
(0,54 - 1,00) (0,46 - 0)
=
= 0,023 mol/min
20
20
(0,20 - 1,00) (0,80 - 0)
=−
=
= 0,020 mol/min
40
40
Velocidade média t 20 = −
Velocidade média t 40
tempo
A→B
Velocidade instantânea
C4H9Cl(aq) + H2O(l) ⎯⎯→ C4H9OH(aq) + HCl(aq)
A velocidade média diminui com o tempo
Estequiometria
e velocidade de reação
Consideremos a seguinte reacção:
2A→B
A velocidade da reação
num
determinado
instante
(velocidade instantânea) é o
declive da tangente à curva
do gráfico concentração vs.
tempo nesse instante.
A velocidade instantânea
é diferente da velocidade
média.
Consomem-se duas moles de A por cada mole de B
que se forma, ou seja, a velocidade com que A se
consome é o dobro da velocidade de formação de B.
Escrevemos a velocidade da reacção como:
velocidade = −
1 ∆[ A]
2 ∆t
ou
velocidade =
∆[ B]
∆t
Velocidade de uma reaç
reação
aA + bB Æ cC + dD
∆[C]
vmédia de formação de C = ———
∆t
−∆[A]
vmédia de consumo de A = ———
∆t
Equação de velocidade ou
Lei cinética de uma reacão
Consideremos a reação:
NH4+ (aq) + NO2- (aq) → N2 (g) + 2 H2O (ℓ)
−∆[A]
−∆[B]
∆[C]
∆[D]
vmédia da reação = ——— = ——— = ——— = ———
a·∆t
b·∆t
c·∆t
d·∆t
Equação de velocidade ou
Lei cinética de uma reacção
Utilidade das equações cinéticas
Verifica-se que
o quando a [NH4+] duplica, mantendo a [NO2-] constante, a velocidade
duplica;
o quando a [NO2-] duplica mantendo a [NH4+] constante, a velocidade
também duplica;
Logo, v ∝ [NH4+][NO2-]
Equação de velocidade ou Lei cinética da reacção:
+
v = k [ NH 4
Rate
][ NO−2 ]
1- Calcular a velocidade de uma reação
a partir do conhecimento da constante de
velocidade e das concentrações de
reagentes;
2- Calcular a concentração de
reagentes em qualquer instante durante o
decorrer de uma reacção.
onde k é a constante de velocidade da reação.
Ordem de reação
Consideremos a reaç
reação geral:
aA + bB → cC + dD
A equaç
equação da velocidade assume a forma:
Velocidade = k[A]x[B]y
Ordem de reação e concentração
Uma reação é de:
o ordem zero em relação a um reagente se a alteração da
concentração desse reagente não causa alteração à sua
velocidade.
x,y,k – determinados experimentalmente
x e y – ordem de uma reacç
reacção;
ão; x é a ordem de A e y é a
ordem de B.
o primeira ordem em relação a um reagente se, duplicar a
concentração, duplica a velocidade da reacção também.
A reaç
reação tem ordem global x+y
o é de ordem n em relação a um reagente se, duplicar a
concentração aumenta de 2n a velocidade da reacção.
Chama-se ordem de uma reacção (ordem global) à soma dos valores das potências a que
as concentrações de reagentes se encontram elevadas a equação cinética da reação
A reação pode ser de ordem zero, 1 (1.ª ordem), 2 (2.ª ordem), ...
Reações de ordem zero
Reações de ordem zero
Reaç
Reações de ordem zero são raras.
A velocidade de uma reacç
reacção de ordem zero é
Tempo de de meia-vida
(t1/2): é o tempo necessário
para que a concentração de
uma reagente diminua para
metade do seu valor inicial.
constante e independente das concentraç
concentrações de
reagentes.
A equaç
equação ciné
cinética é: velocidade =
A equaç
equação de concentraç
concentração pelo tempo é:
−
d [A]
=k
dt
t½ =
k[A]0=k
[A]0
2k
Gráfico da concentração [A] em função do tempo
[A] = [A]0 – k t
para uma reação de ordem zero.
Reações de 1ª ordem
Comportamentos característicos de
uma reação de primeira ordem
Uma reação de primeira ordem é uma reação
cuja velocidade depende da concentração do
reagente elevada à potência unitária.
a) Diminuição da concentração do
reagente com o tempo.
21
Tempo de meia-vida
Reações de 1ª ordem
A → produto
velocidade
b) Utilização da representação
gráfica da relação linear de ln[A] 22
em
função do tempo para calcular a
constante de velocidade.
∆ [A ]
∆t
= k [A ]
= −
velocidade
∆ [A ]
∆ [A ] 1
−
= k [A ] ⇔ k = −
×
( s −1 )
[A ] ∆ t
∆t
[A ]0 = kt ⇔ ln [ A ] − ln [ A ] = kt
⇔ ln
0
[A ]
⇔ ln [ A ] = − kt + ln [ A ]0
23
Tempo de meiameiavida (t1/2):
1 [ A]0
t = ln
k [ A]
Por definição de tempo de
meia-vida, quando t=t1/2,
[A] = [A]0/2
Variação da concentração de
um reagente com o número de
tempos de semi-transformação
para uma reação de primeira
ordem
[A]0 ⇔ t = 1 ln 2 ⇔ t = 0,693
1
t1/ 2 = ln
1/ 2
1/ 2
k [A]0 / 2
k
k
Tempo de meia-vida (t1/2) na
reação de 2ª ordem
Reações de 2ª ordem
É
a
reaç
reação
cuja
velocidade
depende
da
Podemos
obter
uma
equação para o tempo de
meia-vida da reação de 2ª
ordem, se fizermos
[A] = [A]0/2 na equação:
concentraç
concentração de reagente elevada ao quadrado ou
de concentraç
concentrações de dois reagentes diferentes,
cada um deles elevada à unidade.
1
1
=
+ kt
[ A] [ A]0
1º Caso: A → produto
Obtém-se
2º Caso: A + B → produto
1
=
1
[A]0 / 2 [A]0
+ kt1/ 2 ⇔ t1 / 2 =
1
k [A]0
25
Reações de 2ª ordem
1º Caso: A → produto
velocidade
= −
velocidade
= k
−
k
∆
[A ]
∆ t
= −
= k
Reações de 2ª ordem
2º Caso: A + B → produto
∆
[A ]
∆ t
velocidade
[A ]2
−
[A ]2
[A ] ×
[A ]2
∆
∆ [A ]
∆ [B
= −
∆t
∆t
= k [ A ][B ]
= −
velocidade
1 ⎛ 1
⎜
∆ t ⎝ Ms
1
[A
⎞
⎟
⎠
∆ [A
∆t
]
=
]=
−
1
[A 0
]
∆ [B
∆t
]=
k [A
][B ]
+ kt
27
28
Resumo da cinética de reações de
ordem zero, 1ª ordem e 2ª ordem
Equação
Ordem
Equação cinética
0
Velocidade =k
[A] = [A]0 - kt
1
Velocidade = k [A]
ln[A] = ln[A]0 - kt
2
Velocidade = k [A]2
concentração-tempo
1
[A]
=
1
[A]0
+ kt
Efeito da temperatura
na velocidade de reação
Tempo de
meia-vida
t½ =
t½ =
t½ =
[A]0
2k
ln2
k
1
k[A]0
Para a maioria das reações, a
velocidade aumenta com um
aumento da temperatura.
]