Plano de aula 2º ano
Conteúdos
Temperatura, escalas termométricas e calor.
Objetivos
- Relacionar o modelo atomista da matéria com os conceitos de calor, temperatura e energia
interna.
- Compreender fenômenos naturais ou sistemas tecnológicos, identificando e relacionando as
grandezas envolvidas.
Recursos
Quadro branco, data show e imagens.
Estratégias
Aula expositiva, explicação, diálogo e promoção de debates e palestras.
Avaliação
A avaliação será continuada no aprendizado do aluno, sendo observada a construção do
entendimento do conceito por parte do aluno.
Bibliografia
Sites: Brasil escola, cola da web e só física.
Livros: Física, Alberto Gaspar e Física conceitual, Paul G. Hewitt.
Quantidade de aulas
4
Observações
Calor
Quando colocamos dois corpos com temperaturas diferentes em contato térmico, podemos
observar que a temperatura do corpo "mais quente" diminui, e a do corpo "mais frio"
aumenta, até o momento em que ambos os corpos apresentem temperatura igual. Esta reação
é causada pela passagem de energia térmica do corpo "mais quente" para o corpo "mais frio",
a transferência de energia é o que chamamos calor.
Chamamos de contato térmico a região no espaço onde é possível haver troca de calor entre
dois corpos, não há necessidade de estarem em contato físico, quando um corpo não esta em
contato térmico com nenhum outro corpo dizemos que esta isolado termicamente.
Calor é a transferência de energia térmica entre corpos com temperaturas diferentes. Esse
fluxo de energia cessa quando os corpos alcançam o equilíbrio térmico, mesma temperatura.
A unidade mais utilizada para o calor é caloria (cal), embora sua unidade no SI seja o joule (J).
Uma caloria equivale a quantidade de calor necessária para aumentar a temperatura de um
grama de água pura, sob pressão normal, de 14,5 °C para 15,5 °C.
A relação entre a caloria e o joule é dada por:
1 cal = 4,186J
Partindo daí, podem-se fazer conversões entre as unidades usando regra de três simples.
Como 1 caloria é uma unidade pequena, utilizamos muito o seu múltiplo, a quilocaloria.
1 kcal = 10³cal
Consequências do calor
Um corpo ao receber calor é acometido por dois fenômenos, o aumento de temperatura que é
devido ao que chamamos de calor sensível e a mudança de estado da matéria devido ao calor
latente.
Calor sensível
É denominado calor sensível, a quantidade de calor que tem como efeito apenas a alteração
da temperatura de um corpo.
Este fenômeno é regido pela lei física conhecida como Equação Fundamental da Calorimetria,
que diz que a quantidade de calor sensível (Q) é igual ao produto de sua massa, da variação da
temperatura e de uma constante de proporcionalidade dependente da natureza de cada corpo
denominada calor específico.
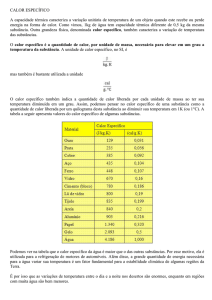
Onde Calor específico é uma grandeza que relaciona quanta energia (caloria) é necessária para
que um grama de uma substância varie sua temperatura em um grau Celsius.
Assim:
Onde:
Q = quantidade de calor sensível (cal).
c = calor específico da substância que constitui o corpo (cal/g°C).
m = massa do corpo (g ).
Δθ = variação de temperatura (°C).
Substância c (cal/g°C)
É interessante conhecer alguns valores de calores específicos:
Alumínio
0,219
Quando:
Água
1,000
Álcool
0,590
Cobre
0,093
Chumbo
0,031
Estanho
0,055
Ferro
0,119
Gelo
0,550
Mercúrio
0,033
Ouro
0,031
Prata
0,056
Vapor
d'água
0,480
Zinco
0,093
Q>0: o corpo ganha calor.
Q<0: o corpo perde calor.
Exemplo:
Qual a quantidade de calor sensível necessária para aquecer uma barra de ferro de
2kg de 20°C para 200 °C? Dado: calor específico do ferro = 0,119cal/g°C.
2 kg = 2000 g
Calor latente
Nem toda a troca de calor existente na natureza se detém a modificar a temperatura dos
corpos. Em alguns casos há mudança de estado físico destes corpos. Neste caso, chamamos a
quantidade de calor calculada de calor latente.
A quantidade de calor latente (Q) é igual ao produto da massa do corpo (m) e de uma
constante de proporcionalidade (L).
Assim:
A constante de proporcionalidade é chamada calor latente de mudança de fase e se refere a
quantidade de calor que 1 g da substância calculada necessita para mudar de uma fase para
outra.
Além de depender da natureza da substância, este valor numérico depende de cada mudança
de estado físico.
Por exemplo, para a água:
Calor latente de fusão
80cal/g
Calor latente de vaporização
540cal/g
Quando:
Q>0: o corpo funde ou vaporiza.
Q<0: o corpo solidifica ou condensa.
Exemplo:
Qual a quantidade de calor necessária para que um litro de água vaporize? Dado: densidade da
água=1g/cm³ e calor latente de vaporização da água = 540 cal/g.
Curva de aquecimento
Ao estudarmos os valores de calor latente, observamos que estes não dependem da variação
de temperatura. Assim podemos elaborar um gráfico de temperatura em função da
quantidade de calor absorvida. Chamamos este gráfico de Curva de Aquecimento: