CALOR ESPECÍFICO
A capacidade térmica caracteriza a variação unitária de temperatura de um objeto quando este recebe ou perde
energia na forma de calor. Como vimos, 1kg de água tem capacidade térmica diferente de 0,5 kg da mesma
substância. Outra grandeza física, denominada calor específico, também caracteriza a variação de temperatura
das substâncias.
O calor específico é a quantidade de calor, por unidade de massa, necessária para elevar em um grau a
temperatura da substância. A unidade de calor específico, no SI, é
mas também é bastante utilizada a unidade
O calor específico também indica a quantidade de calor liberada por cada unidade de massa ao ter sua
temperatura diminuída em um grau. Assim, podemos pensar no calor específico de uma substância como a
quantidade de calor liberada por um quilograma desta substância ao diminuir sua temperatura em 1K (ou 1°C). A
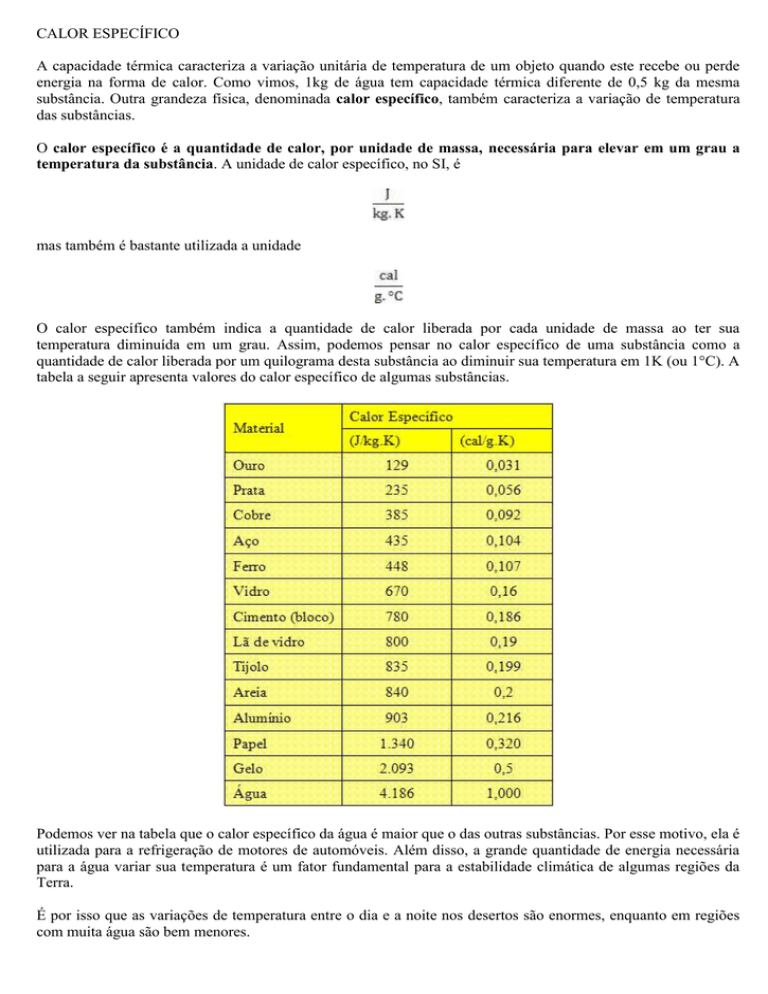
tabela a seguir apresenta valores do calor específico de algumas substâncias.
Podemos ver na tabela que o calor específico da água é maior que o das outras substâncias. Por esse motivo, ela é
utilizada para a refrigeração de motores de automóveis. Além disso, a grande quantidade de energia necessária
para a água variar sua temperatura é um fator fundamental para a estabilidade climática de algumas regiões da
Terra.
É por isso que as variações de temperatura entre o dia e a noite nos desertos são enormes, enquanto em regiões
com muita água são bem menores.
Como a capacidade térmica é definida por C = Q/ΔT, e o calor específico é c = C/m, podemos escrever
Q=C.∆T=(mc).∆T
Q=m.c.∆T
Através dessa expressão podemos calcular a quantidade de calor, Q, cedida por um corpo de massa m e calor
específico c ao ter sua temperatura diminuída em ΔT graus.
Calor Sensível (CALOR ESPECÍFICO)
Sabemos que calor é energia térmica em trânsito que flui entre os corpos em razão da diferença de temperatura
entre eles. Dessa forma, imagine uma barra de ferro que receba ou perca certa quantidade de calor Q. Esse calor
que a barra ganhou ou perdeu é denominado de calor sensível, pois ele provoca apenas variação na temperatura
do corpo, sem que aconteça mudança no seu estado de agregação, ou seja, se o corpo é sólido continua sólido e o
mesmo acontece com os estados líquidos e gasosos.
Também chamado de calor específico, o calor sensível, determinado pela letra c (minúscula), é avaliado da
seguinte forma: cal/g. °C. Essa relação informa a quantidade de calor que um grama de substância deve receber
ou ceder para que nela aconteça a variação de um grau de temperatura. Essa é uma unidade prática, ou seja, a que
é mais utilizada no dia a dia. Contudo, no Sistema Internacional de Unidades (SI) o calor específico pode ser
dado de duas formas: J/kg. K ou em J/kg. °C.
Calor Latente
Diferente do calor sensível, quando fornecemos energia térmica a uma substância, sua temperatura não varia,
mas seu estado de agregação se modifica, esse é o chamado calor latente. Essa é a grandeza física que informa a
quantidade de energia térmica (calor) que uma unidade de massa de uma substância deve perder ou receber para
que ela mude de estado físico, ou seja, passe do sólido para o líquido, do líquido para o gasoso e assim por
diante.
Determinado pela letra L, o calor latente de uma substância é calculado através da razão entre a quantidade de
calor (Q) que a substância deve receber ou ceder e a massa (m) da mesma, ou seja, matematicamente temos:
L = Q/m
O calor latente pode ser positivo ou negativo. Quando positivo indica que o material está recebendo calor e
quando negativo, indica que está perdendo calor. No Sistema Internacional de Unidades (SI), a unidade de calor
latente é o joule por quilograma (J/Kg), mas na prática utiliza-se muito a caloria por grama (cal/g).












