Apresentação dos seminários
1 – Apresentação de cada grupo:
• Tempo de apresentação: 10 a 15´.
• Perguntas ao final de cada apresentação: máximo 5´.
• 2 – Avaliação dos grupos:
• Preencher uma ficha por grupo.
• Preencher a ficha de autoavaliação.
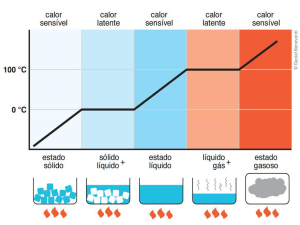
Calor
SENSÍVEL:
TEMPERATURA do corpo
LATENTE:
ESTADO FÍSICO do corpo
Quantidade de Calor Sensível (Q)
trocada entre dois ou mais corpos
Q = m.c.T
Onde
Q é a quantidade de calor recebido (Q>0) ou cedido (Q<0);
m é a massa do material;
T é a variação de temperatura;
c é o CALOR ESPECÍFICO DA SUBSTÂNCIA.
Num determinado estado físico
Para um objeto...
MAIÚSCULO
Capacidade Térmica (C)
Q = m.c.T
c é o calor específico característico do
material (elemento ou substância).
Capacidade Térmica
Quanta energia (calor) é
necessária para variar a
temperatura de um
determinado sistema
(objeto).
Q
C
m.c
T
Sistema Térmicamente Isolado
Um Sistema Térmicamente
Isolado é aquele que NÃO troca
calor com o meio externo
Sistema Térmicamente Isolado
Para isolar o sistema utiliza-se um
CALORÍMETRO
Calorímetro é um aparelho utilizado com
o objetivo de minimizar as trocas de calor
com o meio externo.
Capacidade Térmica
Q
QC C . T
T
Cobertura
METÁLICA
Dizemos que o
calorímetro
ideal é aquele
que tem
CAPACIDADE
TÉRMICA
desprezível
(próxima a
zero!)
TROCAS DE CALOR
Num Sistema Térmicamente
Isolado
Sistema Térmicamente Isolado
Energia Térmica se conserva
Q = 0
Q1 + Q2 + ... + Qn = 0
Avaliando a aprendizagem (pg. 289) 11 a 13.
Revisando o conteúdo (pg. 290)
1, 2, 5, 7 e 8
Misturam-se 2kg de água a 10oC
com 3kg de água a 60oC. Qual é a
temperatura final da mistura?
Calor específico da água = 1,00 cal/g oC
QUANTIDADE DE
CALOR LATENTE
A quantidade de calor latente que um
objeto qualquer deve receber (ceder)
para mudar de estado físico depende:
Da massa do objeto (m);
Do material do qual o objeto é feito (L)
Q=m.L
onde L é o calor latente do material.
Que = MaLa!
CALOR LATENTE
Q=m.L
Q
L
m
Q
L
m
Q
L
m
cal
J
L
ou
g
kg
T (oC)
CALOR
TEMPERATURA
CONSTANTE!
LATENTE
CALOR
LATENTE
TEMPERATURA
CONSTANTE!
LÍQUIDO + VAPOR
CALOR
TEMPERATURA
VARIA
SENSÍVEL
CALOR SENSÍVEL
SÓLIDO + LÍQUIDO
Q(cal)
CALOR SENSÍVEL
Qual a energia necessária para
transformar 10g de gelo a -20oC
em vapor d’água, a 110oC ?
Esquentando
o gelo
Derretendo o
gelo
Esquentando
a água
Fervendo a
água
Esquentando
o vapor
d’água
Q1=m.c.T
Q1 = 10.0,5.20
Q1 = 100cal
Q2 = m.L
Q2 = 10.80
Q2 = 800cal
Q3 = m.c.T
Q3 = 10.1.100
Q3 = 1000cal
Q4 = m.L
Q4 = 10.540
Q4 = 5400cal
Q5 = m.c.T
Q5 =
10.0,48.10
Q5 = 48cal
LÍQUIDO + VAPOR
T (oC)
Q = 7348 cal
SÓLIDO + LÍQUIDO
Q(cal)
O gráfico abaixo mostra como varia a temperatura de 200g
de uma substância submetida a aquecimento com uma fonte
térmica de potência constante 100cal/s. Determine:
a) Os pontos de fusão e ebulição dessa substância;
b) Os calores específicos dessa substância nos estados
sólido, líquido e gasoso;
c) os calores latentes de fusão e evaporação dessa
substância.
Lição de
casa
TRAZER LIVRO
Livro: Capítulo 20: Mudanças de estado
• Ler e resumir pg. 294 a 296.
• Avaliando o aprendizado (pg 296) 1 e 2.