Reações inorgânicas – Atividades 1
Introdução
Indicamos abaixo uma série de exercícios do conteúdo de reações inorgânicas, com os principais
tipos dessas reações, para que você possa verificar seu aprendizado. Faça cuidadosamente cada
um, seguindo os exemplos, dicas e comentários.
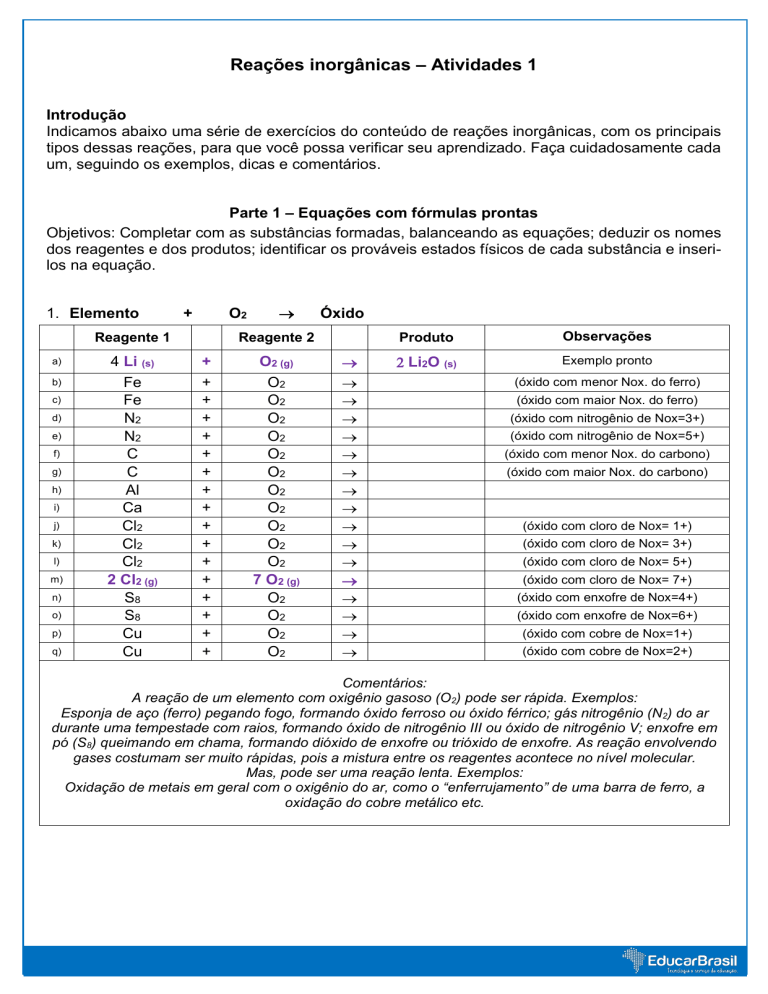
Parte 1 – Equações com fórmulas prontas
Objetivos: Completar com as substâncias formadas, balanceando as equações; deduzir os nomes
dos reagentes e dos produtos; identificar os prováveis estados físicos de cada substância e inserilos na equação.
1. Elemento
+
O2
Reagente 1
a)
b)
c)
d)
e)
f)
g)
h)
i)
j)
k)
l)
m)
n)
o)
p)
q)
4 Li (s)
Fe
Fe
N2
N2
C
C
Al
Ca
Cl2
Cl2
Cl2
2 Cl2 (g)
S8
S8
Cu
Cu
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
Óxido
Reagente 2
Produto
Observações
O2 (g)
O2
O2
O2
O2
O2
O2
O2
O2
O2
O2
O2
7 O2 (g)
O2
O2
O2
O2
Li2O (s)
Exemplo pronto
(óxido com menor Nox. do ferro)
(óxido com maior Nox. do ferro)
(óxido com nitrogênio de Nox=3+)
(óxido com nitrogênio de Nox=5+)
(óxido com menor Nox. do carbono)
(óxido com maior Nox. do carbono)
(óxido com cloro de Nox= 1+)
(óxido com cloro de Nox= 3+)
(óxido com cloro de Nox= 5+)
(óxido com cloro de Nox= 7+)
(óxido com enxofre de Nox=4+)
(óxido com enxofre de Nox=6+)
(óxido com cobre de Nox=1+)
(óxido com cobre de Nox=2+)
Comentários:
A reação de um elemento com oxigênio gasoso (O2) pode ser rápida. Exemplos:
Esponja de aço (ferro) pegando fogo, formando óxido ferroso ou óxido férrico; gás nitrogênio (N2) do ar
durante uma tempestade com raios, formando óxido de nitrogênio III ou óxido de nitrogênio V; enxofre em
pó (S8) queimando em chama, formando dióxido de enxofre ou trióxido de enxofre. As reação envolvendo
gases costumam ser muito rápidas, pois a mistura entre os reagentes acontece no nível molecular.
Mas, pode ser uma reação lenta. Exemplos:
Oxidação de metais em geral com o oxigênio do ar, como o “enferrujamento” de uma barra de ferro, a
oxidação do cobre metálico etc.
2. Metal alcalino ou alcalino terroso (IA ou IIA) + H2O Hidróxido + H2
R1
a)
b)
c)
d)
e)
f)
g)
2 Na (s)
Mg
Ba
K
Rb
Li
Ca
+
+
+
+
+
+
+
R2
P1
2 H2O (l)
H2O
H2O
H2O
H2O
H2O
H2O
2 NaOH (aq)
+
P2
Observações
H2 (g)
Exemplo pronto
+
Elementos da IIA têm Nox 2+
+
+
Elementos da IA têm Nox 1+
+
+
+
Comentários:
As reações dos metais alcalinos com água são umas das mais interessantes, pois costumam ser violentas
e até explosivas. O sódio e o potássio, por exemplo, reagem tão violentamente com a água, liberando gás
hidrogênio, que o calor liberado na reação costuma incendiar o hidrogênio produzido, fazendo-o reagir com
o oxigênio do ar. A reação do potássio é mais violenta que a do sódio com água, porque ele possui uma
camada eletrônica a mais que o sódio, sendo mais eletropositivo; ou seja, perde elétrons para o oxigênio da
molécula de água com mais facilidade que o sódio.
A explosão que se vê é a queima do hidrogênio; uma reação secundária, que pode ou não acontecer.
Devido ao calor liberado, o gás hidrogênio produzido pode incendiar-se: 2H2(g) + O2(g) → H2O(V)
3. Hidreto metálico (IA ou IIA) + H2O Hidróxido + H2
R1
a)
b)
c)
d)
e)
f)
2 RbH (s)
BaH2
CaH2
NaH
MgH2
LiH
+
+
+
+
+
+
R2
P1
H2O (l)
H2O
H2O
H2O
H2O
H2O
2 RbOH (aq)
+
+
P2
Observações
H2 (g)
Exemplo pronto
Elementos da IIA têm Nox 2+
+
+
Elementos da IA têm Nox 1+
+
+
Comentários:
Hidretos metálicos são sempre sólidos, pois são substâncias iônicas, em que o ânion é o hidrogênio com
carga 1- (ânion hidreto, H1-). A reação provoca a oxidação do hidreto para hidróxido (OH1-), e o hidrogênio
passa para nox 1+, já eu o oxigênio está com nox 2-. Outros átomos de hidrogênio passam para nox zero,
formando gás hidrogênio (H2).
4. Óxido básico + H2O Hidróxido
R1
a)
b)
c)
d)
e)
f)
MgO (s)
Ag2O
CaO
Na2O
MgO
PbO2
+
+
+
+
+
+
R2
Produto
Observações
H2O (l)
H2O
H2O
H2O
H2O
H2O
Mg(OH) 2 (aq)
Exemplo pronto
Comentários:
Essa reação é muito usada no meio rural para a fabricação de sabão caseiro com as cinzas de madeira,
que são ricas em óxidos de sódio e de potássio. Molhando as cinzas, produz-se hidróxidos desses
elementos, reagentes fundamentais para a fabricação do sabão.
5. Óxido ácido + H2O Ácido (chuva ácida)
R1
a)
b)
c)
d)
e)
f)
g)
h)
i)
j)
N2O3 (g)
SO2
Cl2O
Br2O5
CrO3
Mn2O7
Cl2O3
N2O5
CO2
SO3
+
+
+
+
+
+
+
+
+
+
R2
Produto
Observações
H2O (l)
H2O
H2O
H2O
H2O
H2O
H2O
H2O
H2O
H2O
2 HNO3 (aq)
Exemplo pronto
A “chuva ácida” acontece por poluição do ar por óxidos ácidos, geralmente produzidos por indústrias,
automóveis e queima de combustíveis fósseis em geral. A chuva, mesmo em locais não poluídos, é
levemente ácida, devido ao gás carbônico (CO2) da atmosfera que reage com a água produzindo o ácido
carbônico (H2CO3 ), que é um ácido fraco. Além disso, o ácido carbônico se decompõe facilmente em gás
carbônico e água novamente, não oferecendo grandes riscos ao meio ambiente.
No entanto, os óxidos de enxofre (S) e os óxidos de nitrogênio (N) formam óxidos bastante perigosos pois
reagem com água formando ácidos bem mais fortes, em especial os ácidos sulfúrico e nítrico. Como se
sabe, basta ter pH abaixo de 7 para um meio aquoso qualquer seja ácido, mas a “chuva ácida” poluída
acontece quando o pH está abaixo de 5,5. Quando a concentração dos íons hidrogênio (H+) na água das
chuvas produz um pH abaixo desse nível, a chuva é, então, considerada “chuva ácida”.
Metais com nox acima de 5 também são capazes de formar ácidos por reação com água, como o caso do
manganês (Mn) e o cromo (Cr).
Experimento: a fumaça produzida pela queima de enxofre em pó (S8, um pó amarelo comprado em
farmácia) é rica em óxidos de enxofre (SO2 e SO3). Coloque um pouco de enxofre em uma tampinha
metálica (de cerveja, por exemplo) coloque fogo, deixando derreter e começar a queimar. Depois,
rapidamente, coloque a tampinha metálica dentro de um vidro de maionese já contendo algumas pétalas de
azaléia e tampe o frasco. Você notará que as pétalas começam a descolorir rapidamente na presença da
fumaça de óxidos de enxofre. As pétalas de azaléia contêm indicadores ácido-base em meio aquoso, que
são incolores em meio ácido e vermelhos em meio neutro.
6. Óxido ácido ou anfótero + Base Sal + água
R1
a)
b)
c)
d)
e)
f)
g)
h)
2 NaOH (aq)
Ba(OH)2
Mg(OH)2
Fe(OH)2
KOH
Al(OH)3
Ca(OH)2
Ca(OH)2
+
+
+
+
+
+
+
+
R2
P1
SO3 (g)
N2O3
P2O5
N2O5
CO2
Cl2O7
CO2
SO3
Na2SO4 (aq)
+
+
+
+
+
+
+
+
P2
Observações
H2O (l)
Exemplo pronto
Óxidos ácidos também
podem neutralizar bases.
Experimento:
Pegue um pouco de cal virgem (óxido de cálcio) ou cal hidratada (hidróxido de cálcio) em uma loja de
material de construção. Coloque uma colher desse pó em meio copo com água e misture. Despreze o
excesso que não dissolveu, despejando o líquido para outro copo. Pegue um canudinho e sopre o ar de
sua respiração, borbulhando no líquido. Em alguns minutos, a água com hidróxido de cálcio ficará turva,
indicando a presença de carbonato de cálcio em suspensão, que é muito pouco solúvel em água. O
carbonato (CO32-) se formou pelo borbulhamento de gás carbônico (CO2) na água, que reage como
hidróxido, formando o sal de cálcio, no caso o carbonato de cálcio (CaCO3).
7. Ácido + Base Sal + água (neutralização total)
R1
a)
b)
c)
d)
e)
f)
g)
h)
i)
j)
2 NaOH (aq)
Ba(OH)2
Mg(OH)2
Fe(OH)3
KOH
Fe(OH)3
Ca(OH)2
Al(OH)3
Al(OH)3
Pb(OH)4
+
+
+
+
+
+
+
+
+
+
R2
P1
H2SO3 (aq)
H2MnO4
HCl
HClO4
H3PO4
H2SO4
H3PO4
H3PO4
H2SO4
HNO3
Na2SO3 (aq)
+
P2
Observações
2 H2O (l)
Exemplo pronto
+
Cada H+ liberado pelo ácido
neutraliza um OH- liberado
pelo hidróxido, formando uma
molécula de água. Então, se
um diácido (2 “H” na fórmula)
reage com uma tribase (3
“OH” na fórmula), deve-se
multiplicar o ácido por 3 e a
base por 2, para formar 6
moléculas de água.
+
+
+
+
+
+
+
+
Comentário:
As reações de neutralização são extremamente importantes na química, seja industrial, seja no nosso dia a
dia. Isso porque os ácidos e os hidróxidos estão presentes no nosso cotidiano o tempo todo. Por exemplo:
A acidez estomacal (ácido clorídrico, HCl); a produção de conservantes (ácido fosfórico, H3PO4); o uso do
ácido sulfúrico (H2SO4 ) na metalurgia; o uso de hidróxidos fortes como a soda cáustica (hidróxido de sódio,
NaOH) e a potassa (hidróxido de potássio, KOH ) na produção de sabões; a produção de medicamentos; o
tratamento de água; a chuva ácida; a acidez das frutas etc são alguns poucos exemplos. Questões sobre
esse assunto são muito comuns nas provas de vestibulares em geral e do ENEM. É importante lembrar que
os ácidos podem ser neutralizados não só por hidróxidos, mas também por óxidos básicos, por carbonatos
e por bicarbonatos; e ainda diluídos com muita água para perderem sua força.
8. Óxido básico ou anfótero + Ácido Sal + água
R1
a)
b)
c)
d)
e)
f)
Li2O (S)
Na2O
K2O
MgO
CaO
BaO
+
+
+
+
+
+
R2
P1
H2SO3 (aq)
HMnO4
HCl
H2S
HNO3
H3PO4
Li2SO3 (aq)
+
+
+
+
+
+
P2
Observações
H2O (l)
Exemplo pronto
Como já dissemos, óxidos
podem neutralizar ácidos,
especialmente os óxidos
básicos.
Comentário:
O uso de “cal virgem” ou “cal ativa” (óxido de cálcio, CaO) para neutralizar ácidos é bastante comum,
principalmente em tratamento de água, para correção da acidez. A água com pH ácido, mesmo leve, pode
corroer encanamentos metálicos. No meio agrícola também se usa cal para neutralizar solos muito ácidos.
9. Óxido básico + Óxido ácido Sal
R1
a)
b)
c)
d)
e)
Na2O (aq)
K2O
MgO
CaO
BaO
+
+
+
+
+
R2
Produto
Observações
Br2O5 (aq)
Mn2O7
N2O5
CO2
Cl2O7
2 NaBrO3 (aq)
Exemplo pronto
Óxidos básicos reagem como bases,
enquanto óxidos ácidos reagem como
ácidos. A reação de um com outro pode
ser considerada como de neutralização,
pois formou um sal neutro.
10. Metal + Ácido Sal + H2 (gás hidrogênio)
R1
a)
b)
c)
d)
e)
f)
Ca (s)
Al
Mg
Fe
Fe
Zn
+
+
+
+
+
+
R2
P1
H2SO4 (aq)
H2MnO4
HCl
HNO3
H2CO3
HClO4
CaSO4 (aq)
+
P2
Observações
H2 (g)
Exemplo pronto
+
+
+
Sal com ferro de nox 3+
+
Sal com ferro de nox 2+
+
Comentário:
Sugerimos um experimento sobre esse tipo de reação.
Experimento: pegue um prego ou parafuso de ferro ou de alumínio; pode ser até mesmo um pedaço de
“papel” alumínio. Coloque dentro de um copo com vinagre ou suco de limão ou de abacaxi. Observe a
produção de pequenas bolhas, que se formam e se desprendem da superfície metálica, depois de alguns
minutos: é o gás hidrogênio (H2). Essa é uma reação típica dos metais. A reação será bem mais rápida se
usar “ácido muriático” (ácido clorídrico diluído em água, HCl), que pode ser encontrado em lojas
especializadas em produtos de limpeza ou lojas de material de construção (é usado para limpeza pesada
de pisos e paredes de pedra). Mas, cuidado! O ácido clorídrico é forte, mesmo diluído em água, sob o
nome comercial de “ácido muriático”. Seu manuseio é arriscado, devendo-se tomar cuidado para não inalar
seus vapores e não deixar entrar em contato direto com a pele! Se isso acontecer, lavar com muita água.
11. Sal1 + Ácido forte Ácido fraco + Sal2
R1
a)
b)
c)
d)
K2S (s)
Ca(NO2)2
FeS
Au2(SO3)3
+
+
+
+
R2
P1
H2SO4 (aq)
HClO4
HCl
HI
H2S (aq)
+
P2
Observações
K2SO4 (aq)
Exemplo pronto
+
+
+
12. Carbonato ou bicarbonato + Ácido Sal + H2O + CO2
R1
R2
P1
2 KCl (aq)
a)
K2CO3 (s)
+
HCl (aq)
b)
CaCO3
NaHCO3
Mg(HCO3)2
Al2(CO3)3
+
+
+
+
H2SO4
H3PO4
H3BO3
H2S
c)
d)
e)
P2
+
H2O (l)
P3
+
+
+
+
+
+
+
+
+
CO2 (g)
Comentário:
Os ácidos podem ser neutralizados não só por hidróxidos e por óxidos básicos; mas também por
carbonatos e bicarbonatos (hidrogenocarbonatos).
Sempre, nessas reações, é produzido gás carbônico, além de um sal e água.
Experimento: pegue uma quantidade qualquer de suco de limão ou de abacaxi e jogue uma pitada de
bicarbonato de sódio (NaHCO3) no suco. Observe a produção de bolhas: é o gás carbônico. Cascas de
ovos e conchas marinhas são ricas em carbonato de cálcio (CaCO3), que também podem ser usadas para
neutralizar ácidos. Sempre nesses casos haverá produção de bolhas, que é o gás carbônico (CO2).
13. Base forte + Sal1 Base fraca + Sal2
R2
P1
2 AgNO3 (s)
FeS
Fe(NO3)2
Al2(SO3)3
ZnCl2
2 AgOH (aq)
R2
P1
2 AgNO3 (aq)
CoSO3
AuCl3
Pb(NO3)2
PtCl2
2 Ag (s)
R1
a)
b)
c)
d)
e)
Ca(OH)2 (aq)
KOH
LiOH
NaOH
Ba(OH)2
+
+
+
+
+
+
P2
Observações
Ca(NO3)2 (aq)
Exemplo pronto
P2
Observações
Ca(NO3) (aq)
Exemplo pronto
P2
Observações
+
+
+
+
14. Metal1 + Sal1 Metal2 + Sal2
R1
a)
b)
c)
d)
e)
Ca (s)
Al
Fe
Na
Zn
+
+
+
+
+
+
+
+
+
+
15. Sal1 + Sal2 Sal3 + Sal4 (Reação de precipitação)
R2
P1
AgNO3 (aq)
Pb(NO3)2
Na2SO4
NH4Cl
AgI (aq)
R1
a)
b)
c)
d)
KI (aq)
NaI
Ba(NO3)2
Ag2SO4
+
+
+
+
+
+
+
+
KNO3 (aq)
Leia nossa
publicação sobre
reações de
precipitação.
16. Reações de síntese
R1
a)
b)
c)
d)
NH3 (g)
H2
MgO
CaO
+
+
+
+
R2
Produto
HCl (aq)
Cl2
CO2
CO2
NH4Cl (aq)
Observações
“Reações de síntese” são aquelas em
que dois ou mais reagentes formam um
único produto.
17. Reações de decomposição ou “análise”
Reagente
d)
CaCO3 (s)
H2O2
KClO3
HgO
e)
NaHCO3
a)
b)
c)
Produto 1
Produto 2
Observações
CaO (s)
CO2 (g)
As reações de “análise” ou de
“decomposição” são as que têm um reagente
produzindo dois ou mais produtos. Muitas
vezes, é necessário fornecer calor, luz ou
radiação para que aconteçam. Não confundir
a ”decomposição” inorgânica com o
“apodrecimento” de materiais orgânicos,
produzidas por bactérias e fungos.
Observação geral: Uma substância ácida, em geral, não reage com outra também ácida. O
mesmo ocorre com substâncias básicas, que em geral não reagem entre si. Em toda reação
em que aparece ácido como reagente, aparecerá sal como produto.