Termodinâmica
Profa. Me. Danielle Evangelista Cardoso
www.profadanielle.com.br
[email protected]
2°Lista: Substância Puras
1) Considere a água como fluido de trabalho e os estados termodinâmicos
definidos por: a) 120°C e 500kPa; b) 120°C e 0,5 m3/kg; c) Considere os
fluido no estado: Amônia a 30°C e 1000kPa. Determine a fase de cada um
dos estados utilizando as tabelas do Apêndice B.
2) Determine a temperatura e o título (se aplicável) para a água nos seguintes
estados: a) volume específicos e pressão iguais a 0,5m3/Kg e 300 kPa; b)
volume específicos e pressão iguais a 1m3/kg e 300kPa
3) Um tanque rígido contém 50 kg de água líquida saturada a 90 °C.
Determine a pressão no tanque e o volume do tanque.(Resp.: 70,14 kPa;
0,0518 m3)
4) Um tanque rígido contém 10 kg de água a 90°C. Se 8 kg de água estiverem
na forma líquida e o restante estiver na forma de vapor, determine (a)
pressão no tanque e (b) o volume do tanque.(Resp.:70,14 kPa; 4,73m3)
5) Um recipiente estanque contém uma mistura saturada de fluido refrigerante
R-134ª a 30°C. Sabendo que o volume ocupado pela fase líquida é 0,1m3 e
que o volume ocupado pela fase de vapor é 0,9m3, determine o título da
mistura contida no recipiente. (Resp.: 0,221)
6) Considere o nitrogênio como fluido de trabalho. Determine a) o volume
específico e o título (se aplicável) se a temperatura e a pressão são iguais a
-53,2°C e 600 kPa (Resp.:0,1078 m3/kg); b) a pressão e o título (se
aplicável) se a temperatura e o volume específico são iguais a 100°C e
0,008m3/kg. (Resp.:0,22)
7) Determine a massa de ar de uma sala de dimensões 4mx5mx6m a 100 kPa
e 25°C.(Resp. 140,2Kg)
8) Um tanque com capacidade de 0,5m3 contém 10 kg de um gás perfeito que
apresenta peso molecular igual a 24. A temperatura no gás é 25°C. Qual é
a pressão no gás?(Resp. 2,07.103 kPa)
1/4
Termodinâmica
www.profadanielle.com.br
Profa. Me. Danielle Evangelista Cardoso
[email protected]
3
9) Um tanque rígido com um volume de 1,8 m contêm vapor d’água a 220oC.
Um terço do volume está na fase líquida e o restante sob a forma de vapor.
Determine: a) O Título da mistura saturada (Resp.: 0,0269); b) A Densidade
da Mistura. (Resp.: 287,8 kg/m3).
10) Calcule o volume específico das substâncias abaixo:
a) CO2 10°C, 80% b) Agua 4 MPa, 90% c. Nitrogenio 120 K, 60%;
11) Se 1 L de amônia está em uma sala com pressão e temperatura
controlada (100kPa, 20°C), qual será a massa da amônia? (Resp.: 7,06.10-4
kg).
12) Um tanque com volume interno de 1m3 contém um gás a 20°C e 100kPa.
Qual é a massa contida no tanque se o gás é a) ar. B) Ne ou propano? (
Resp.: 1,189 kg; b) 0,828 kg; c) 1,809 kg).
13)
Considere um sistema que consiste em uma mistura bifásica líquido-
vapor de água a 100°C e título de 0,9. Determine o volume específico da
mistura. (Resp.: 1,50 m3/kg)
14)
Um sistema é composto por água líquida em equilíbrio com uma
mistura gasosa de ar e vapor d’água. Quantas fases estão presentes? O
sistema consiste em uma substância pura? Explique. Repita a questão para
um sistema composto por gelo e água líquida em equilíbrio com uma
mistura gasosa de ar e vapor d’água.
15)
Um sistema composto por oxigênio líquido em equilíbrio com vapor de
oxigênio. Quantas fases estão presentes? O sistema passa por um
processo durante o qual parte do líquido é evaporada. O sistema pode ser
considerado uma substância pura durante o processo? Explique
Determine a massa em kg, de 0,1 m3 do refrigerante 134a a 4 bar,
16)
100°C. (resp.:1,36 kg)
Um tanque com capacidade de 0,5 m3 contém 10 kg de um gás perfeito
17)
que apresenta
peso molecular igual a 24 kg.kmol-1 . A temperatura no gás
2/4
Termodinâmica
Profa. Me. Danielle Evangelista Cardoso
www.profadanielle.com.br
[email protected]
é 25°C. Qual é a pressão do
18)
gás. (Resp.: 2065kPa).
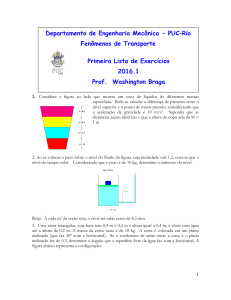
Considere os dois tanques, A e B, e a tubulação com válvula mostrada
na figura abaixo.
Os dois tanques contém água. O volume do tanque A é
3
igual a 1 m e a água armazenada neste tanque apresenta pressão igual a
200 KPa e v.: 0,5 m3 /kg. O tanque B contém 3,5 kg de água a 0,5 Mpa e
400°C. A válvula que liga os tanque é então aberta e espera-se até que a
condição de equilíbrio seja atingida. Determine o volume específico no
estado final do processo. (resp.: 0,57 m3/kg)
3
19)
Hélio armazenado num tanque de aço de 0,1 m a 250 kPa e 300K é
utilizado para encher um balão. Quando a pressão cai para 150 kPa, o fluxo
de hélio é interrompido. Se todo o hélio ainda estiver a 300 K, qual terá sido
o volume do balão produzido (R:
20)
3
0,066m ).
Um balão esférico com diâmetro de 6m é preenchido com hélio a 20°C
e 200kPa.
Determine o números de mols (moles) e a massa de hélio no
balão (Resp.: 9,28 kmol;
21)
37,15 kg)
Um tanque cilíndrico vertical contém 4,0 kg de monóxido de carbono
gásà temperatura de -50°C C. O diâmetro interno do tanque é, D=0,2 m e o
comprimento,L=1,0 m. Determinar o volumen específico molar e a pressão,
em bar exercida pelo gás (resp.: 0,2199 m3/kmol; 84,31 bar).
22)
Um recipiente tem 5 kg de água saturada a 120◦C com título de 0,6.
Determine o volume da água líquida , o volume do vapor no recipiente , o
volume total e a pressão. (Resp.: 2,12.10-3 m3; 2,676 m3; 2,678 m3)
23)
Determine o volume total da água do recipiente do problema anterior
3/4
Termodinâmica
www.profadanielle.com.br
Profa. Me. Danielle Evangelista Cardoso
[email protected]
utilizando o volume específico médio (v)
24)
A água a uma pressão de 1600kPa tem título de 0,4. Determine a
temperatura, a energia interna e a entalpia medias para essas misturas.
(Resp.: 1553 kJ/kg; 1633 kJ/kg )
25)
A água superaquecida existe a 1,86MPa e 420°C. Determine a entalpia
específica.
26)
O vapor de água saturada é comprimida de 200°C para 2MPa e 600°C.
Determine a variação de volume específico e a entalpia.
27)
O nitrogênio existe a 4MPa e 130K. Aproxime o volume específico
utilizando a) a lei do gás idela b) e o fator de compressibilidade
Dez quilogramas de ar ocupa 1 m3 de espaço a -40°C. Calcule e
28)
compare a pressão utilizando:
a)Lei do Gas ideal
b) Equação de Van der Waals
c) Equação de Beattie-Bridgeman
d)Fator de compressibilidade
Estime a pressão do nitrogênio a -60°C e v=0,036 m3/kg utilizando:
29)
a)Lei do Gas ideal
b) Equação de Van der Waals
Determine a pressão do gás nitrogênio a T=175K e v= 0,000375 m3/kg
30)
com base:
a)Lei do Gas ideal
b) Equação de Van der Waals
c) Equação de Beattie-Bridgeman
4/4