Problemas sobre o doseamento da actividade de enzimas
Perg. 1: Uma enzima E catalisa a
transformação A→P. Num tubo de
ensaio colocou-se A, tampão e ao
minuto zero adicionou-se uma
determinada quantidade de enzima
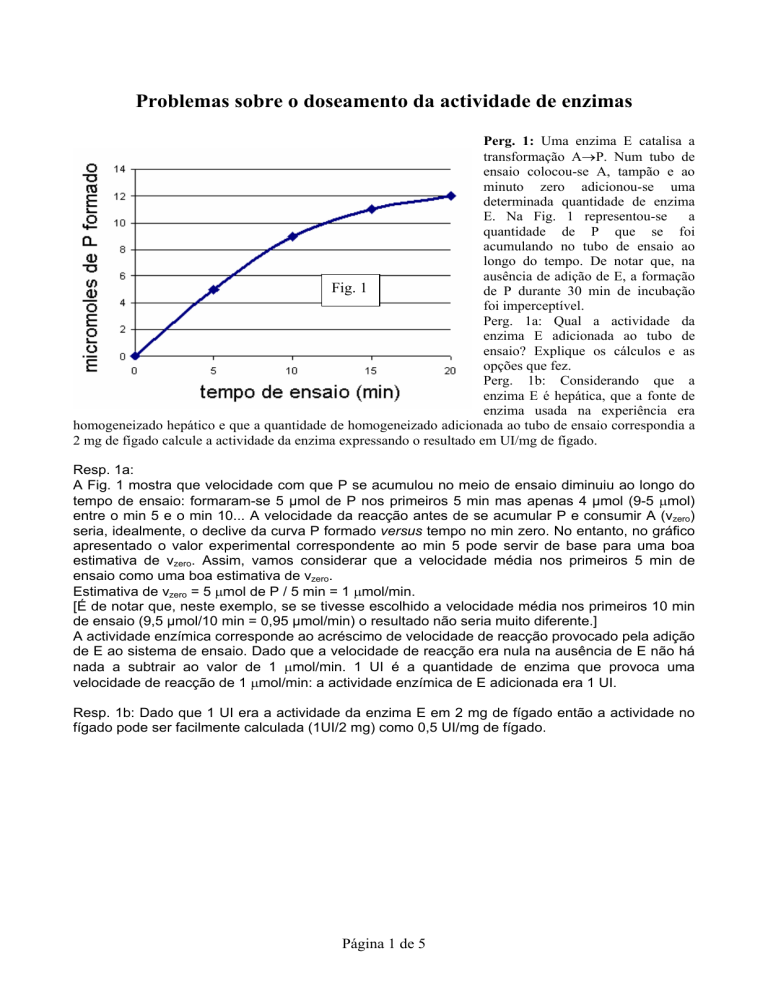
E. Na Fig. 1 representou-se
a
quantidade de P que se foi
acumulando no tubo de ensaio ao
longo do tempo. De notar que, na
ausência de adição de E, a formação
Fig. 1
de P durante 30 min de incubação
foi imperceptível.
Perg. 1a: Qual a actividade da
enzima E adicionada ao tubo de
ensaio? Explique os cálculos e as
opções que fez.
Perg. 1b: Considerando que a
enzima E é hepática, que a fonte de
enzima usada na experiência era
homogeneizado hepático e que a quantidade de homogeneizado adicionada ao tubo de ensaio correspondia a
2 mg de fígado calcule a actividade da enzima expressando o resultado em UI/mg de fígado.
Resp. 1a:
A Fig. 1 mostra que velocidade com que P se acumulou no meio de ensaio diminuiu ao longo do
tempo de ensaio: formaram-se 5 µmol de P nos primeiros 5 min mas apenas 4 µmol (9-5 µmol)
entre o min 5 e o min 10... A velocidade da reacção antes de se acumular P e consumir A (vzero)
seria, idealmente, o declive da curva P formado versus tempo no min zero. No entanto, no gráfico
apresentado o valor experimental correspondente ao min 5 pode servir de base para uma boa
estimativa de vzero. Assim, vamos considerar que a velocidade média nos primeiros 5 min de
ensaio como uma boa estimativa de vzero.
Estimativa de vzero = 5 µmol de P / 5 min = 1 µmol/min.
[É de notar que, neste exemplo, se se tivesse escolhido a velocidade média nos primeiros 10 min
de ensaio (9,5 µmol/10 min = 0,95 µmol/min) o resultado não seria muito diferente.]
A actividade enzímica corresponde ao acréscimo de velocidade de reacção provocado pela adição
de E ao sistema de ensaio. Dado que a velocidade de reacção era nula na ausência de E não há
nada a subtrair ao valor de 1 µmol/min. 1 UI é a quantidade de enzima que provoca uma
velocidade de reacção de 1 µmol/min: a actividade enzímica de E adicionada era 1 UI.
Resp. 1b: Dado que 1 UI era a actividade da enzima E em 2 mg de fígado então a actividade no
fígado pode ser facilmente calculada (1UI/2 mg) como 0,5 UI/mg de fígado.
Página 1 de 5
Fig. 2
Perg. 2: A enzima E está presente no soro sanguíneo
e catalisa a reacção X→Y. Um tubo de ensaio A
continha 1 ml de solução (contendo X, tampão a pH
adequado e cofactores essenciais para a actividade da
enzima E) e, no tempo zero, adicionou-se 1 µl de
soro sanguíneo. Ao longo do tempo de ensaio foi-se
medindo a concentração de X no meio de ensaio (ver
Fig. 2). No caso do ensaio B as condições foram as
mesmas excepto no que se refere ao volume de soro
sanguíneo adicionado.
Perg. 2a: Qual a actividade da enzima E no soro em
análise?
Perg. 2b: No ensaio B qual o volume do mesmo soro
adicionado ao tubo de ensaio?
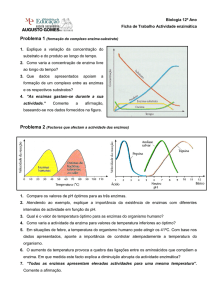
Resp. 2a: Consideremos o ensaio A. O primeiro
ponto experimental obtido no min 10 poderá
servir de base para a estimativa de vzero. O
ponto correspondente ao min 20 na linha A
corresponde já a alguma lentificação da
reacção pelo que só admitindo um erro na
estimativa o poderíamos considerar. Nos
primeiros 10 min de ensaio, a concentração de X passou de 100 para 90 mM, ou seja, a
concentração de X diminuiu 10 mM (=0,01 M). Dado que o volume de ensaio era de 1 mL, a
quantidade de X que foi convertida em Y pode ser calculada como sendo (0,01 M * 0,001 L)
0,00001 mol (=10 µmol). A velocidade de reacção nos primeiros 10 min de ensaio foi assim de 1
µmol/min (=10 µmol de X/10 min) o que corresponde a 1UI. Se o volume de soro adicionado ao
ensaio era 1 µL então a actividade da enzima E no soro era de 1 UI/µl soro.
Resp. 2b: A actividade no tubo B pode ser facilmente calculada usando o mesmo raciocínio da
Resp. 2a. Na realidade, é intuitivo observar que no caso B o valor da velocidade da reacção é
metade do caso A (0,5 µmol/min = 0,5 UI): se, no tubo B nos mesmos 5 min iniciais a quantidade
de substrato consumido foi metade de que se consumiu no tubo A é porque, em B, a actividade
enzímica era metade da que se observou em A. No tubo B adicionou-se um volume diferente do
mesmo soro e a actividade enzímica é directamente proporcional à quantidade de enzima. A
velocidade de reacção observada em B era metade da observada em A porque em B havia
metade do número de moléculas da enzima E. Ou seja, em B o volume de soro era, não 1 µL,
mas 0,5 µL.
Página 2 de 5
Absorbância
Perg. 3: A substância P é o produto
de uma reacção enzímica catalisada
0.8
pela enzima E presente no fígado
0.7
(S→P). A substância P absorve luz
do comprimento de onda que foi
0.6
usado para fazer a curva de
0.5
calibração que a Fig. 3 representa.
Esta curva de calibração foi realizada
0.4
com o objectivo de dosear a enzima
0.3
E e, por isso, as condições usadas
Fig. 3
(nomeadamente o pH do meio) eram
0.2
semelhantes às que se usaram
0.1
quando
se
fez
a
leitura
espectrofotomética
dos
ensaios
0
enzímicos. No estudo enzímico
0
1
2
3
4
5
usaram-se 2 cuvetes (A e B). Na
[P] (mM)
cuvete A, a mistura reactiva (1 mL)
continha S, tampão e homogeneizado
hepático (correspondente a 2,5 mg de
fígado) medindo-se a Absorbância ao longo do tempo. De notar que, na cuvete A, o tempo zero correspondia
à adição do homogeneizado hepático ao restantes componentes da mistura. Na cuvete B o ensaio decorreu na
ausência de homogeneizado hepático e, no minuto 10, adicionou-se homogeneizado hepático correspondente
a 2,5 mg de fígado fazendo logo de seguida a leitura correspondente. A tabela I representam-se as leituras de
Absorbância em diferentes tempos de ensaio nas cuvetes A e B.
Perg. 3a: Qual a velocidade da reacção na ausência de homogeneizado hepático?
Perg. 3b: Qual a actividade da enzima E?
Tabela I Absorvância
min
A
0
0,1
2
0,2
4
0,3
6
0,38
8
0,45
10
0,52
12
0,58
14
0,64
B
0,05
0,05
0,05
0,05
0,05
0,10
0,20
0,30
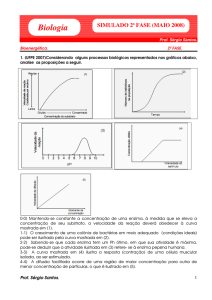
Resp. 3a: De acordo com a tabela I, na ausência de
homogeneizado (cuvete B antes do minuto 10) a variação de
absorbância foi nula donde devemos deduzir que a velocidade de
formação de P também o foi.
Resp3b: Nos primeiros minutos de ensaio (entre o minuto 0 e o
minuto 4) a velocidade de variação de Absorbância na cuvete A
era de 0,05/min. Este resultado pode ser obtido usando, por
exemplo, o valor tabelado correspondente ao min 2 (Abs_min_2 –
Abs_min_zero)/2 min = 0,05 min-1. (Tendo em conta que o gráfico
Absorbância versus tempo é uma recta até ao min 4, também se
poderia usar o min 4 em vez do min 2 que o resultado seria exactamente o mesmo). Usando a
curva de calibração da Fig. 3 pode calcular-se que a 0,05 de Absorbância corresponde uma
concentração de 0,25 mM de P. O volume de ensaio era de 1 mL; logo o número de µmoles de P
formados por minuto na presença de enzima era de 0,25 (0,001 L x 0,00025 M = 0,00000025
mol). O homogeneizado adicionado ao ensaio correspondia a 2,5 mg de fígado; assim a
actividade da enzima era 0,25 µmol min-1 / 2,5 mg = 0,1 UI/mg de fígado.
Este texto foi preparado por Rui Fontes que agradece todas as críticas que entendam fazer. Na versão
anterior havia um erro na tabela I que foi detectado e já está corrigido (obrigado à Joana Meireles Pinto).
Página 3 de 5
ADENDA:
Dúvidas pertinentes colocadas por uma aluna (Joana Meireles Pinto) no ano de 2008:
1-As grandezas usadas para exprimir a actividade enzímica são sempre “quantidade de substância
formada ou consumida”/unidade de tempo? Não se poderia exprimir em “variação de concentração do
reagente ou produto”/unidade de tempo? E no caso da actividade específica; a única unidade para
expressar a actividade específica de uma enzima é UI/(mg de fígado, mg de proteína ou ml de soro) ou
existem outras unidades?
2-Não se poderiam ter seguido estratégias diferentes das usadas nos exemplos acima, obtendo o mesmo
resultado?
3- Não se poderia exprimir a actividade enzímica de outra maneira? Que significa kcat na equação
vinicial =
k cat [S ]
[Etotal ] .
Km + [S ]
1-A forma mais comum de definir a actividade enzímica inclui o pressuposto de que é uma grandeza
extensiva. Quando se diz que num frasco existe 1 UI (medida de actividade enzímica) da enzima E (que
catalisa a conversão S→P) quer-se dizer que se verter todo o conteúdo desse frasco para um meio de ensaio
adequado1 a velocidade de reacção será 1 UI (1 µmol de P formado ou 1 µmol de S consumido/min).
Obviamente que se tiver dois frascos iguais, terei no conjunto dos dois frascos, 2 UI de enzima e se verter o
conteúdo dos dois fracos para um outro meio de ensaio semelhante ao primeiro a velocidade de reacção será
de 2 µmol min-1.
No entanto, às vezes exprime-se a velocidade de uma reacção enzímica, não como uma grandeza extensiva,
mas sim como uma grandeza intensiva: como a variação da concentração do produto (ou do substrato) /
unidade de tempo. Neste caso, as unidades da velocidade de reacção não poderiam ser µmol min-1 mas,
eventualmente, mM min-1, por exemplo. É obvio que é fácil converter grandezas intensivas em extensivas:
basta multiplicar pelo volume do meio de ensaio.
As enzimas têm origem em amostras de material biológico (fígado, músculo, soro ou plasma sanguíneo, etc)
e quando se fala de actividade específica estamos a referir-nos à “concentração” de enzima nesse material
biológico. Ou seja, a actividade específica, é uma grandeza intensiva em que o numerador é uma medida da
actividade enzímica e o denominador uma quantidade que, de alguma forma, expressa a quantidade de
preparação enzímica adicionada ao meio de ensaio. No caso do soro e plasma sanguíneos o mais frequente é
exprimir o resultado em “velocidade de reacção como uma grandeza extensiva” / volume de soro o que se
aproxima bastante de uma unidade de concentração no sentido mais vulgar do termo. Se, em vez de soro,
usarmos como fonte de enzima fígado (ou homogeneizado hepático) e dissermos que a actividade específica
de E é de 1UI/mg de fígado, estamos a falar da concentração da enzima E no fígado; neste caso usando como
base para o cálculo, não o volume, mas a massa de fígado. Pode ficar um pouco confuso quando usamos
como base a massa de proteínas. Se dissermos que a actividade no fígado é de 1UI/mg de proteína o que
estamos a dizer é que a adição ao meio de ensaio de uma quantidade de homogeneizado hepático que contém
1 mg de proteína provocará uma velocidade de reacção que é 1 µmol min-1 (UI), ou seja, que 1 mg de
proteína hepática contém 1UI de enzima E.
2- Nos exemplos dos problemas apresentados segui sempre a mesma estratégia. Depois de calcular a
velocidade no tubo de ensaio, não em termos de variação de concentração, mas sim em termos de quantidade
(grandeza extensiva) de produto formado (ou substrato consumido) dividi o valor obtido por uma grandeza
1
Há vários meios e várias condições diferentes para ensaiar uma enzima e todas se podem, eventualmente, revelar
adequadas para medir a actividade de uma enzima. No entanto nem todas vão dar a mesma velocidade de reacção. Por
isso quando se escreve o rótulo do frasco que contém a enzima e se diz que há X UI de enzima E nesse frasco, há que
especificar as condições (substrato utilizado, sua concentração, tampão, sua concentração, pH, temperatura, etc) em que
o ensaio foi realizado.
Página 4 de 5
também extensiva (volume de soro, mg de tecido, mg de proteínas) que de alguma forma expressa a
quantidade de preparação enzímica adicionada ao meio de ensaio. Como a velocidade (grandeza extensiva;
moles/min por exemplo) é uma medida da quantidade de enzima adicionada (também grandeza extensiva) ao
dividir a velocidade por uma medida que expressa a quantidade (também grandeza extensiva) de amostra que
se adicionou ao ensaio obtém-se algo que poderá ser entendido como uma medida da "concentração" de
enzima na amostra biológica adicionada.
No entanto poder-se-iam usar outras estratégias para chegar ao mesmo resultado. Usando o exemplo do
problema 2a. Se se disser que a velocidade de reacção era 1 mM/min ou seja 1 mmol L-1 min-1 (grandeza
intensiva) e que a concentração de soro no meio de ensaio era 1 µL/mL (1 mL L-1; também uma grandeza
intensiva) e se calcular 1 mmol L-1 min-1/1 mL L-1 obtém 1 mmol min-1 /mL de soro que é igual a 1 µmol
min-1 /µL de soro ou 1UI/µL de soro.
3- Existem, de facto, outras formas de expressar a actividade enzímica que, embora aparentemente mais
simples, raramente são possíveis. Imagine que se sabe a concentração de enzima no meio de ensaio e
que esta se pode exprimir em termos de molaridade (M; mol/L; grandeza intensiva; por exemplo 1 nM =
0,000000001 M). Isto só muito raramente é possível mas admitamos que sim. Agora admitamos que se
calcula a actividade enzímica no meio de ensaio como a variação de concentração de produto (grandeza
intensiva) por unidade de tempo; usando o problema 2a daria 1 mM/min = 0,001 M min-1. Se dividir a
velocidade de reacção pela concentração de enzima, obteria a actividade enzímica expressa em min-1. No
nosso exemplo ao dividir 0,001 M min-1 (medida da velocidade como uma grandeza intensiva) por
0,000000001 M (medida da concentração de enzima; também grandeza intensiva) o resultado seria 1000000
min-1. Este valor tem um nome chama-se turnover number ou kcat e significa o número de moléculas de
produto produzidas (ou de moléculas de substrato consumidas) por uma molécula de enzima num min.
(Também pode dividir 1000000 min-1 por 60 e o resultado virá em segundo-1). Como já referido, o termo
actividade específica é usado para nos referirmos à concentração de uma enzima (expressa em actividade)
numa preparação biológica. Neste caso, se eu souber o valor do kcat da enzima E (por exemplo 106 min-1) e
souber também que o soro tem 1 pmol (10-12 mole = 10-6 µmol) de enzima E por µL, a actividade específica
de E será de 1 UI/µL de soro (106 min-1 X 10-6 µmol / 1 µL = 1 µmol/min /µL).
Os cálculos acima foram feitos usando a fórmula vinicial =
k cat [S ]
[Etotal ] expressando, quer vinicial quer a
Km + [S ]
concentração de enzima no meio de ensaio ( [Etotal ] ), como grandezas intensivas e admitindo concentração
saturante de substrato (valor de concentração em que [S]>>Km e em que [S]/(Km + [S]) ≈ 1). Podíamos
chegar ao mesmo resultado usando a fórmula vinicial =
kcat [S ]
Etotal ; se soubéssemos o volume do meio de
Km + [S ]
ensaio podíamos exprimir vinicial e Etotal como grandezas extensivas.
Página 5 de 5