Universidade Federal de Ouro Preto
Instituto de Ciências Exatas e Biológicas
Lista de Exercícios avaliativos QUI 156
Professor: Marcelo Gomes Speziali
Data:
Nome:________________________; Turma:___________; Matrícula: _____________
Nome:________________________; Turma:___________; Matrícula: _____________
Nome:________________________; Turma:___________; Matrícula: _____________
Nome:________________________; Turma:___________; Matrícula: _____________
1) Para uma solução de uma substância orgânica de concentração 2,5 g cm-3 de um
composto em m polarímetro de 20 cm de comprimento a rotação observada é de
5,5º. Qual a rotação específica dessa substância?
2) Represente as projeções de Fischer para os seguintes compostos cujas fórmulas
tridimensionais são apresentadas; indique o tipo de isomeria de cada uma desses
compostos (R ou S):
Cl
H3C
OH
D
CH3
OH
H
Cl
3) Explique o significado de cada um dos seguintes termos e apresente um exemplo
de cada caso:
a) enantiômero;
b) diastereoisômero;
c) racemato (mistura racêmica);
d) isômero meso.
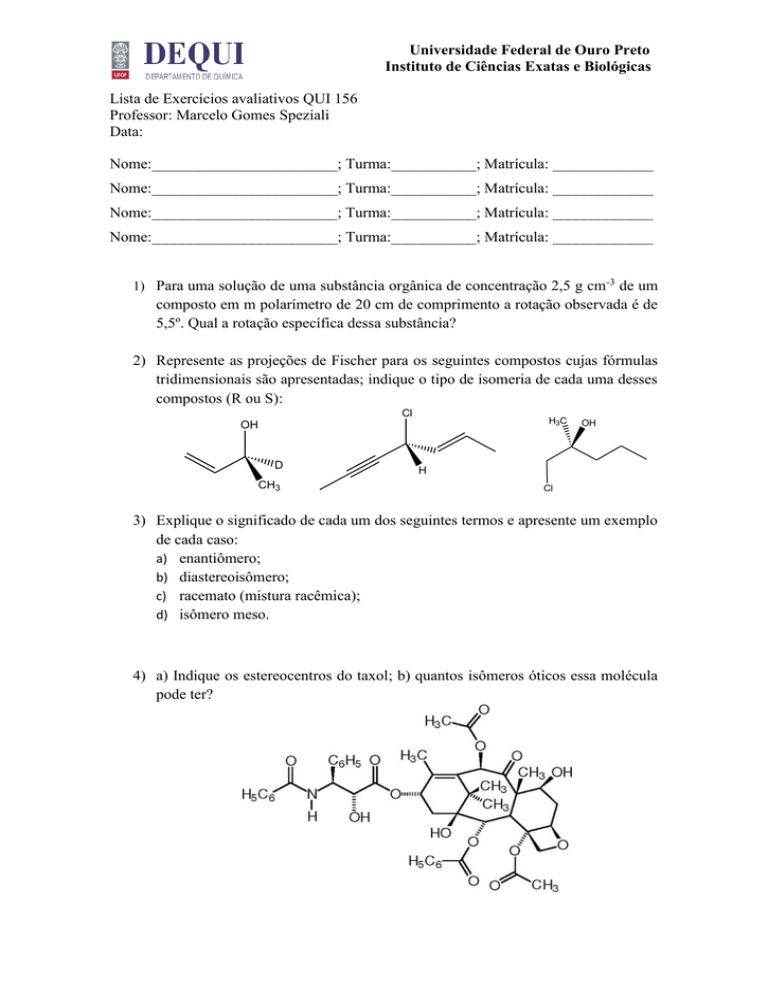
4) a) Indique os estereocentros do taxol; b) quantos isômeros óticos essa molécula
pode ter?
5) O sorbitol é o produto de redução da glicose. Dê a configuração D ou L para a
glicose representada. Atribua configurações R ou S aos carbonos marcados da
glicose. Quais são as relações entre o sorbitol e os compostos L, M e N. Atribua
o D para L, M e N usando esses três valores: +5˚, +13˚, 0˚. Justifique a sua
resposta.
O
H
CH2OH
CH2OH
HO
*
H
H
OH
HO
redução
H
H
HO
H
H
OH
HO
H
HO
H
OH
HO
*
H
HO
H
HO
HO
*
H
HO
H
H
CH2OH
CH2OH
Glicose
Sorbitol
CH2OH
CH2OH
OH
H
OH
H
HO
H
H
OH
HO
H
H
OH
H
OH
CH2OH
CH2OH
CH2OH
L
M
N
D = -13°
6) A energia em calorias por mol de ligações químicas entre alguns elementos pode
ser visualizada na tabela abaixo.
Ligações
simples
ΔH°*
Ligações
simples
B–F
B–O
C–N
N–CO
C–O
ΔH°*
150
125
73
86
85.5
Ligações
múltiplas
C=C
N=N
O=O
C=N
C=O (CO2)
H–H
C–C
N–N
O–O
104.2
83
38.4
35
F–F
P–P
S–S
Cl–Cl
Br–Br
I–I
36.6
50
54
58
46
36.
H–C
H–N
99
93
H–O
ΔH°*
O–CO
C–S
C–Cl
C–Br
C–I
C–B
110
65
81
68
51
90
C=O (aldeído)
C=O (cetona)
C=O (éster)
C=O (amida)
C=O (haleto)
C=S (CS2)
111
C–Si
C–P
76
70
N=O (HONO)
P=O (POCl3)
H–F
135
N–O
55
P=S (PSCl3)
70
H–Cl
H–Br
H–I
H–B
H–S
H–P
103
87.5
71
90
81
77
S–O
87
S=O (SO2)
Si–F
Si–Cl
Si–O
P–Cl
P–O
135
90
110
79
90
S=O (DMSO)
C≡O
C≡C
N≡N
C≡N
128
93
258
200
226
213
146
109
119
147
192
177
178
179
179
177
138
143
110
a) Calcule a energia resultante da queima total da sacarose gerando água e gás
carbônico:
OH
HO
O H
H
O
H
HO
H
OH
H
O
HO
H
OH
OH
H
OH
Estrutura da sacarose
b) Calcule a energia resultante da queima total de um triglicerídeo formado por um
ácido oleico e dois ácidos linolênicos. Compare o valor obtido com o da queima
da sacarose.
7) Represente a estrutura da Frutose segundo a projeção de Fischer e a de Hartworth.
8) a) Escreva as fórmulas estruturais do alqueno que deu origem ao composto
derivado da Artemisinina;
b) Faça a reação do alqueno que deu origem ao derivado da Artemisinina com
OsO4/NaHSO3;
c) Que tipo de isomeria o alqueno que deu origem ao derivado da Artemisinina
possui? Este composto desviaria a luz plano polarizada em alguma direção? Por
que?
O
O
O
O
O
9) A reação de HBr ao vinilciclopropano resulta na formação de qual composto?
Escreva as etapas no mecanismo que explique a formação deste produto.
+ HBr
10) Complete a síntese com os produtos faltantes:
OH
OH
Epoxidação
ataque intramolecular
da hidroxila ao epóxido
Produto A + Produto B
O
Produto A + Produto B =
+
Br
Br
R
NaOH
Produto C
R
R
N
Acoplamento de Sonogashira
R
R
Imidazol
N
N
Hidrogenação parcial
heterogênea
R
Produto D
N
OH
R
Produto D
1) OsO4
2) NaHSO3
1) KMnO4, OH-, Produto F
Produto E H2SO4 / H2O
2) H3O+
N
N
11) A adição de HCl ao alfa-pineno resulta na formação de cloreto de bornila. Represente
as etapas do mecanismo que explique a formação do respectivo produto. Dê a estrutura
do produto final.
+ HCl