MÉTODOS EM QUÍMICA MEDICINAL
FFI0763
[email protected]
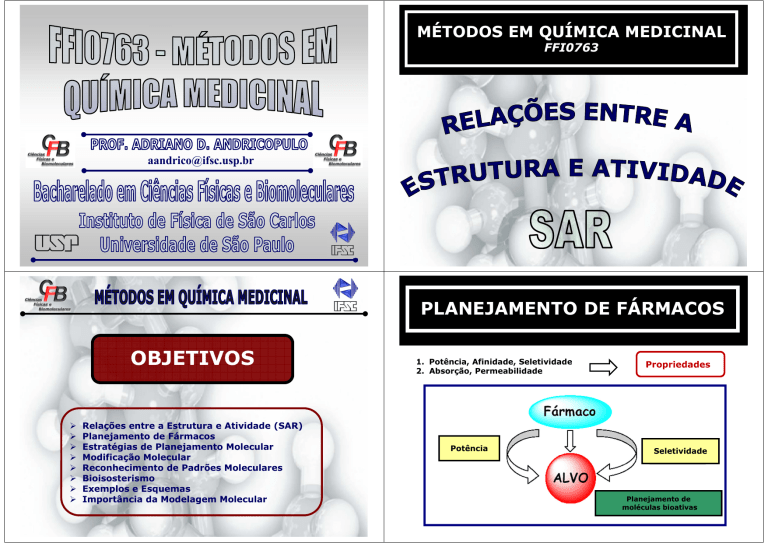
PLANEJAMENTO DE FÁRMACOS
OBJETIVOS
Relações entre a Estrutura e Atividade (SAR)
Planejamento de Fármacos
Estratégias de Planejamento Molecular
Modificação Molecular
Reconhecimento de Padrões Moleculares
Bioisosterismo
Exemplos e Esquemas
Importância da Modelagem Molecular
1. Potência, Afinidade, Seletividade
2. Absorção, Permeabilidade
Potência
Propriedades
Seletividade
Planejamento de
moléculas bioativas
Pesquisa Básica
PLANEJAMENTO DE MOLÉCULAS BIOATIVAS
Moléculas Bioativas
SAR
Compostos Líderes
ESTRUTURA
ATIVIDADE
OTIMIZAÇÃO DE
PROPRIEDADES
Propriedades
Farmacodinâmicas
Propriedades
Farmacocinéticas
Novas Entidades químicas
DEFINIÇÕES
DEFINIÇÕES
Molécula Bioativa (Hit): composto ativo identificado em uma triagem
biológica ou através de planejamento molecular
- Estrutura confirmada e pureza elevada
- Extratos de produtos naturais não são considerados hits
São espécies ativas, mas que requerem etapas adicionais de
purificação e isolamento para identificação dos hits (moléculas
bioativas)
- Desenvolvimento de curvas concentração x resposta
- Viabilidade de otimização molecular
- Estabelecimento de SAR preliminar
Composto líder (Lead Compound): desenvolvido a partir de uma série
de compostos análogos de um hit (síntese e avaliação biológica)
- Possui propriedades otimizadas: potência, afinidade e
seletividade (algumas propriedades farmacocinéticas)
- Tem perfil apropriado para a descoberta de uma NCE
com potencial de desenvolvimento clínico
DEFINIÇÕES
RELAÇÕES ENTRE A ESTRUTURA
E ATIVIDADE
As relações entre a estrutura e
atividade (SAR) descrevem o
efeito das estruturas
NCE (candidato a fármaco): desenvolvida a partir de um composto
moleculares em relação a um
líder (química medicinal e otimização múltipla)
dado parâmetro biológico,
relacionando esses efeitos a
- Possui propriedades desejáveis para um candidato a novo
fármaco: ótima farmacodinâmica e farmacocinética
- Exibe perfil apropriado para o desenvolvimento clínico
(eficácia e segurança em modelos experimentais in vivo)
variação na estrutura
(modificação estrutural)
As SARs podem ser melhor
entendidas e avaliadas em séries
de moléculas com pequenas
modificações moleculares
RELAÇÕES ENTRE A ESTRUTURA
E ATIVIDADE
O entendimento químicobiológico dá origem aos estudos
de SAR
Quando as SARs podem ser
quantificadas de forma
padronizada, essas se tornam
relações quantitativas entre a
estrutura e atividade (QSAR)
Não existe otimização molecular sem o
desenvolvimento de estudos de SAR
CRITÉRIOS DE FÁRMACO SIMILAR
PROPRIEDADES FÍSICO-QUÍMICAS
- Estabilidade
- Solubilidade
- Metabólitos
- Complexidade química
REGRAS DE LIPINSKY (Regra dos Cinco, do inglês “Rule of 5”)
- Peso molecular ≤ 500
- CLog P ≤ 5
- Número de doadores de hidrogênio ≤ 5 (NH + OH)
- Número de aceptores de hidrogênio ≤ 10 (N + O)
OUTRAS PROPRIEDADES
- Número de ligações rotacionáveis ≤ 10
- Área de superfície polar (PSA, do inglês, polar surface area) : ≤ 140 Å
- Toxicidade baixa/moderada
◊ Organização e gerenciamento de bases de dados padrões
◊ Emprego de pré-filtros: otimização das bases de dados
(e.g., seleção por tipo de átomo: C, H, N, O, S, F, Cl, Br, P)
Características
Características e Propriedades
Fármaco-similar
Propriedades
drug-like (fármaco-similar)
lead-like (protótipo-similar)
Parte do conhecimento necessário para definir o
espaço químico-biológico das novas moléculas
Protótipo-similar
Combichem-similar
Reagente-similar
► Um grande número de bases de dados contendo milhares ou
até milhões de moléculas pode ser encontrado
► Outras bases novas podem ser organizadas ou agrupadas com
base no uso de filtros de propriedades moleculares
http://blaster.docking.org/zinc/
► Aplicação de Filtros
A.
B.
C.
D.
Peso molecular
Doadores de ligação de hidrogênio
Receptores de ligação de hidrogênio
CLogP
Filtros de Lipinski
“Regra dos Cinco”
(“Rule of Five”)
Geração de Modelos Preditivos in silico nos Estágios
Iniciais do Processo de Descoberta de Fármacos
Regras de Lipinski
Geração de Modelos Preditivos in silico nos Estágios
Iniciais do Processo de Descoberta de Fármacos
Baixa absorção ou permeabilidade são prováveis
Regra dos 5
Christopher A. Lipinski, Franco Lombardo, Beryl W. Dominy,
Paul J. Feeney
Adv. Drug Deliv. Rev. 23, 3-25, 1997
O que é possível inferir a partir de bancos de dados de
fármacos?
Existem mais do que
5
Existem mais do que
10
doadores de ligação de hidrogênio
aceptores de ligação de hidrogênio
Peso molecular maior do que
Clog P maior que
5
500
“Regra dos Cinco” de Lipinski
Lipinski: limite
Massa Molar
Freqüência
Freqüência
Lipinski: limite
Leads
(W.Sneader)
Líderes
Fármacos
Drugs
(W.Sneader)
Peso Molecular
Index
Maior
Maior
World
Drug
World
Drug
Index
Clog P
Lipinski: limite
Aceptor de H
Maior
Doador de H
Maior
Freqüência
Freqüência
Lipinski: limite
0
100
200
300
400
Peso Molecular
Fármacos via oral (média): PM 340, Log P 2,5, HBD 2, HBA 4
Tendências
Tendências
Peso
Molecular
Pfizer
500
Peso
Molecular
Merck
600
700
800
Tendências
Novos Fármacos são mais Lipofílicos
Coeficiente de Partição - CLog P
Leads (W.Sneader)
Protótipos
Pfizer
Clog P
Drugs (W.Sneader)
Fármacos
World Drug
IndexIndex
World
Drug
-20
-15
-10
-5
0
5
10
15
20
25
Escala de tempo
Clog P
Tendências
Tendências
Novos fármacos possuem mais aceptores de H
Merck
Merck
Clog P
Soma: O + N
Novos Fármacos não são mais Lipofílicos
Escala de tempo
Escala de tempo
Tendências
Fármacos são em geral maiores do que seus líderes
Novos Fármacos não possuem mais aceptores de H
Pfizer
Número pequeno de fármacos a partir de líderes com PM > 400
Escala de tempo
Mudança no PM na direção
Protótipo Farmaco
Soma: O + N
Número pequeno de fármacos com PM > 500
PM do protótipo
SAR
Estratégias de Otimização Molecular
- Variação de substituintes
- Aumento da estrutura molecular
- Extensão/contração de cadeias
- Variação de anéis, padrão de substituição
- Fusão de anéis
- Isósteros e bioisósteros
- Simplificação molecular
- Rigidez e flexibilidade da molécula












