INFLUÊNCIA DE COMPOSTOS BIOATIVOS E NUTRIENTES NA PSORÍASE
1
Sara Letícia Vieira – Acadêmica do Curso de Cosmetologia e Estética da
Universidade do Vale do Itajaí – UNIVALI , Balneário Camboriú, Santa Catarina.
2
Vicenza Maria Soares Rech – Acadêmica do Curso de Cosmetologia e Estética da
Universidade do Vale do Itajaí – UNIVALI , Balneário Camboriú, Santa Catarina.
3
Karina Vasconcellos - Orientadora, Professora do Curso de Cosmetologia e
Estética da Universidade do Vale do Itajaí – UNIVALI , Balneário Camboriú, Santa
Catarina.
Contatos
1
[email protected]
2
[email protected]
3
[email protected]
RESUMO
A psoríase é uma doença de etiologia imprecisa, com evolução crônica e
caracterizada por lesões eritematoescamosas, aumento de proliferação celular e
padrões anormais de diferenciação dos queratinócitos devido ao seu processo
inflamatório. Pode ser desencadeada através de fatores externos como traumas,
agentes patógenos, deficiências nutricionais, estresse, entre outros. A revisão
bibliográfica foi realizada com artigos científicos disponíveis nas principais bases de
dados científicas e demonstrou que a ingestão de nutrientes e bioativos dos
alimentos possibilita uma ação pró ou anti-inflamatória nos indivíduos pré dispostos
e nos portadores da desordem manifestada. Glúten, ácidos graxos essenciais e
vitaminas A, D e do complexo B, se destacam entre inúmeros compostos devido as
reações ligadas a manifestação de sinais e sintomas que caracterizam a psoríase. A
intolerância ao glúten age no organismo de psoríticos aumentando o risco de
penetração de microorganismos que estimulam a inflamação. A ingestão equilibrada
de ácidos graxos pró e anti-inflamatórios e das vitaminas, podem garantir diminuição
dos efeitos colaterais e toxicológicos, atuando nos principais fatores que
caracterizam a doença como a hiperqueratinização das células epiteliais, liberação
de antígenos que causam a inflamação e alteração da resposta imune. As
alterações de consumo destes nutrientes e bioativos devem ser administrados como
um tratamento coadjuvante para as terapias convencionais como os retinóides e
fototerapia. A terapêutica da psoríase dependerá sempre da forma clínica que ela
manifesta em nível de extensão e gravidade. Apesar de inúmeros estudos serem
dedicados a possível cura da doença, um tratamento inteiramente eficaz ainda não
foi descoberto.
Palavras chaves: psoríase; processo inflamatório; resposta imune; vitaminas;
glúten; ácidos graxos.
2
INTRODUÇÃO
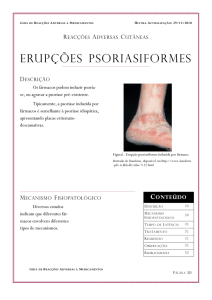
Psoríase caracteriza-se por lesões eritematoescamosas, aumento na
proliferação celular e padrões anormais de diferenciação dos queratinócitos
(ARAUJO; BURGOS; MOURA, 2009). É uma doença com evolução crônica,
acentuada com tendências recidivas (SILVA; SILVA, 2007).
Estudos epidemiológicos de todo o mundo demonstra que a psoríase é uma
doença comum que afeta de 0,6% a 4,8% da população, sendo que os negros
apresentam menos tendência a apresentá-la. Estudos da distribuição (incidência e
prevalência) da psoríase mostrou a provável importância geográfica e da etnia no
desenvolvimento da psoríase, o qual sugere que genética e fatores ambientais
influenciam no desenvolvimento da patogenicidade da doença (NEIMANN;
PORTER; GELFAND, 2006).
Além dos fatores epidemiológicos, existem outros que promovem a resposta
cutânea a um estímulo inicial, sendo o fator emocional um incito importante (SILVA;
SILVA, 2007). Depressão, ansiedade, disfunção sexual, baixa auto-estima e
pensamentos suicidas podem coexistir com a psoríase, mesmo em pacientes com
doença menos grave (LUBA; STULBERG, 2006).
Estudos abordam que infecções, drogas, trauma, etilismo, e tabagismo são
fatores agravantes e/ou desencadeantes da psoríase. De acordo com Duarte (2010),
a obesidade poderia participar no desencadeamento da desordem,
baseado no estado pró-inflamatório que evoca, ou poderia ser
conseqüência da psoríase, decorrente das desregulações
metabólicas, induzidas pelo estado pró-inflamatório, somado ao
prejuízo na qualidade de vida e hábitos alimentares do portador da
doença.
As lesões podem ser do tamanho de gotas ou de moedas, podem confluir
para formação de figuras policíclicas como também branquear no centro e
permanecer em atividade na periferia formando aros de círculo. As escamas são
superpostas como lâminas de um fragmento de mica; apresentam cor avermelhada
e podem ser destacadas com facilidade, mediante a raspagem da lesão (SILVA;
SILVA, 2007).
Segundo a literatura, existem várias manifestações da doença. A psoríase
tem elevada predileção pelo couro cabeludo e pelas superfícies de extensão de
3
joelhos e cotovelos, mas qualquer área cutânea pode ser sede de lesões.
Traumatismos de qualquer natureza que atingem a pele do paciente podem produzir
o aparecimento de novas lesões na área traumatizada (PROENÇA; MAIA, 1995
apud SILVA; SILVA, 2007). A doença possui vários fenótipos distintos: formas
vulgar, invertida, gutata, eritrodérmica e pustulosa (DUARTE, 2010). As unhas são
frequentemente envolvidas, aproximadamente 30% dos pacientes tem afetada a
matriz ungueal e/ou o leito e provoca alterações conhecidas como psoríase ungueal
(MROWIETZ; REICH, 2009).
Em cerca de 20% dos pacientes ocorre a forma chamada de artrite psoriática,
em que há a inflamação das articulações, que se apresentam inchadas e doloridas.
Essa forma geralmente surge muitos anos após a manifestação cutânea (LUBA;
STULBERG, 2006; SILVA; SILVA, 2007; MROWIETZ; REICH, 2009). Outra
manifestação da doença, a psoríase pustulosa exibe um quadro de lesões eritematoescamosas e pustulosas generalizadas, ampla exacerbação de formação de pústula
da pele, levando o indivíduo a apresentar febre. Finalmente, a psoríase
eritrodérmica, que é uma descamação universal ou muito extensa, podendo ter um
aumento até que o corpo seja envolvido. (SILVA; SILVA, 2007).
Por ser uma disfunção que afeta não só funcionamento pleno imune mas
também acarreta alterações estéticas e emocionais, é de relevância acadêmica
avaliar a administração de nutrientes e bioativos que podem contribuir para a
redução da atividade inflamatória observada na psoríase e, como moduladores de
diferentes funções imunes.
A partir de um ponto de vista profissional, esta revisão será útil para o
tecnólogo em cosmetologia e estética pois através do fornecimento de informações
sobre a doença, sua etiologia e tratamento, aumentará a segurança ao lidar com o
portador da doença sem interferir em outro possível tratamento.
A relativa escassez de pesquisas na área de alimentação e nutrição no
tratamento da psoríase contribui para a controvérsia em torno do assunto. A maioria
dos estudos humanos são epidemiológicos, tornando-se difícil atribuir a causa e o
efeito de dieta.
4
1 PSORÍASE – ETIOLOGIA
Recentes avanços genéticos e imunológicos aumentaram o entendimento da
patologia da psoríase como uma desordem crônica caracterizada pela hiperplasia
dos queratinócitos epidermais, angiogênese (crescimento de novos vasos
sanguíneos), infiltração de linfócitos-T, neutrófilos e outros tipos de leucócitos na
pele afetada (TRAUB; MARSHALL, 2007; RAYCHAUDHURY, 2010). Há ampla
evidência para sugerir que as respostas imunes anormais na pele estão envolvidas
na fisiopatologia da psoríase, resultando em um processo inflamatório sistêmico
(GHAZIZADEH; et al., 2010) e aumento da proliferação epidérmica (ILCOVITCH,
2010).
Em favor de proporcionar um melhor entendimento da disfunção imune
presente na psoríase, é de grande importância entender a resposta normal imune da
pele (TRAUB; MARSHALL, 2007). Em termos gerais, a resposta imune inata
compreende todos os mecanismos que resistem à infecção, mas não exige o
reconhecimento específico do patógeno. Dentro do sistema imune diversas
estruturas, tais como física e química (por exemplo, o estrato córneo) ou
componentes da imunidade inata do sangue (como neutrófilos, macrófagos, etc.),
têm sido identificados em nível de barreira cutânea (SCHAUBER; GALLO, 2008).
A pele é um órgão linfóide primário com um sistema eficaz de vigilância
imunológica equipado com células apresentadoras de antígenos, citocinas que são
proteínas mediadoras intercelulares que servem como chaves moduladoras do
sistema imune e do processo inflamatório (BAK; MIKKELSEN, 2010), células
epidermotrópicas T, células endoteliais, capilares dérmicos, nódulos de drenagem,
macrófagos teciduais, fibroblastos granulócitos e linfócitos T circulantes. Em
conjunto estas células se comunicam por meio da secreção de citocinas e
respondem adequadamente através da estimulação por bactérias, fatores químicos,
luz ultravioleta e outros fatores irritantes. A citocina primária lançada em resposta à
apresentação de antígenos é a fator da necrose tumoral alfa (TNF-α). Geralmente,
esse é um processo controlado, a menos que o insulto à pele seja prolongado, caso
em que a produção de citocinas leva a um desequilíbrio do estado patológico como
ocorre na psoríase (TRAUB; MARSHALL, 2007).
5
As citocinas pró-inflamatórias de maior relevância conhecidas por estimular e
potencializar a inflamação são: o fator de necrose tumoral-α (TNF-α), a interleucina1α (IL-1α), a interleucina-6 (IL-6), a interleucina-8 (IL-8), e as CD40 e CD40L. Em
contra partida a interleucina-10 (IL-10), anti-inflamatória, é conhecida por inibir o
efeito das pró-inflamatórias (VOLP; et al., 2008).
O primeiro defeito imune da psoríase aparece por um aumento nas células
sinalizadoras via citocinas (TRAUB; MARSHALL, 2007). A resposta proliferativa dos
queratinócitos começa com a ativação dos linfócitos T por antígeno desconhecido,
gene ou estímulo. Após a ativação de células T, uma cascata de citocinas,
macrófagos, interleucinas, TNF-α, entre outras, são secretadas pelas células T
ativadas que provocam um remodelamento epidermal por meio de um alterado
crescimento e diferenciação dos queratinócitos assim como angiogênese (BAK;
MIKKELSEN, 2010; RAYCHAUDHURY, 2010). Devido ao efeito dessas citocinas
ocorre também a hiperplasia dérmica e a migração de neutrófilos (DAS, 2009) que
clinicamente se mostram infiltrados em lesões de psoríase ativa (ROCHA-PEREIRA;
et al., 2004).
Como dito anteriormente, a resposta imunológica anormal é responsável pelo
dano tecidual, devido a uma disfunção dos queratinócitos. Essa disfunção é
resultante da atividade mitótica dos queratinócitos basais que é aumentada em mais
de 50 vezes na pele psorítica, reduzindo de 28 a 30 dias para 3 a 5 dias o tempo de
migração destes, da camada basal até a córnea (DUARTE; et al., 2010).
2 NUTRIENTES E BIOATIVOS
2.1 Glúten
A intolerância a ingestão de uma proteína chamada glúten, contida em
cereais como cevada, centeio, trigo, malte, em indivíduos geneticamente
predispostos, determina a doença celíaca (DC), uma disfunção crônica (HUMBERT;
et al., 2006) evolutiva que pode aparecer em qualquer momento da vida
(CALDERON; et al., 2007). É qualificada por um processo inflamatório (SILVA;
FURLANETTO, 2010) já que devido a um aumento da permeabilidade intestinal,
pode permitir a passagem de microorganismos (KAIMAL; THAPPA, 2010) afetando a
6
psoríase. Causa também, atrofia das vilosidades intestinais, má absorção de
nutrientes e uma variedade de manifestações clínicas (SILVA; FURLANETTO,
2010). Estudos epidemiológicos têm mostrado que a DC é muito comum e afeta
cerca de 1 em 250 pessoas (ABENAVOLI; et al., 2006).
Nos últimos anos muitos relatórios relacionados à DC em severas condições
tem sido publicados. Assim, intolerância ao glúten ou DC dá origem para uma
variedade de manifestações dermatológicas (HUMBERT; et al., 2006). Resultados
de pesquisas realizadas por Shurter e Marks (1971 apud HUMBERT; et al., 2005)
questionou se a intolerância ao glúten pode ser mais comum em pacientes com
psoríases do que em pacientes saudáveis e constatou que não foi possível ter uma
avaliação precisa sobre o beneficio da dieta sem glúten neste caso, contudo a
convicção dos autores foi que os pacientes tiveram uma melhora significativa no
quadro da doença. Pacientes com psoríase tem sido destacados por ter uma
incidência no aumento de anticorpos antiglandina IgG/IgA, que reagem as proteínas
do glúten, comparado com controles saudáveis (KAIMAL; THAPPA, 2010).
Abenavoli e colaboradores (2007) afirmam que os mecanismos implicados no
efeito da dieta sem glúten nas lesões psoríticas são desconhecidas. Algumas
hipóteses: 1. Permeabilidade intestinal pequena e anormal pode ser um fator
desencadeante entre a doença celíaca e a psoríase. 2. A gliadina, proteína do
glúten, induz a síntese de células T, que por sua vez desencadeiam o processo
inflamatório da psoríase 3. Lesões psoríticas em pacientes com doença celíaca
podem estar relacionadas com a deficiência de Vitamina D.
A maioria das evidências das associações entre DC e disfunções cutâneas é
baseada em relatórios de caso, tornando difícil de definir uma conclusão
(ABENAVOLI; et al., 2007).
2.2 Ácidos Graxos Essenciais
Os ácidos graxos poliinsaturados essenciais compõem uma classe de
moléculas que não podem ser geradas pelo organismo, mas são necessárias para o
seu funcionamento (ANDRADE; CARMO, 2006) e manter em condições normais as
membranas celulares, as funções cerebrais e a transmissão de impulsos nervosos.
7
Esses ácidos graxos também participam da transferência de oxigênio atmosférico
para o plasma sanguíneo, e síntese de hemoglobina e divisão celular (MARTIN, et
al. 2006). Eles são requeridos, através da metabolização por cadeias enzimáticas
para formação de eicosanóides (CALDER, 2009) os quais são reguladores
metabólicos do sistema imune (WONTERS, 2005).
Por meio da alimentação pode-se obter diretamente os ácidos graxos
produtores de eicosanóides: os ácidos graxos essenciais linoléicos da família
Omega-6 que derivam o ácido araquidônico (AA) e o dihomo-y-linoleico (DLA); e os
ácidos graxos essenciais alfa-linolênico da família Omega-3 (n-3): o acido
eicosapentaenóico (EPA) (STANKE-LABESKE, et al., 2008).
A superprodução de eicosanóides derivados de AA e a baixa produção de
EPAs têm sido implicadas em várias desordens inflamatórias e auto-imunes e
também em lesões psoríticas (LOGAN, 2005; WONTERS, 2005).
Para Traub e Marshall (2007), os ácidos graxos essenciais (AGE) influenciam
a fisiopatologia da psoríase em três formas:
em primeiro lugar, o impacto dos AGE influencia no funcionamento
na membrana fosfolipídica celular, em segundo lugar, os AGE
melhoram a função endotelial através do fluxo sangüíneo dérmico e
epidérmico, em terceiro, atuam como um agente na inflamação
através do seu impacto sobre os eicosanóides.
Os AGE criam a integridade estrutural da derme e epiderme que regula a
fluidez, o que influencia o transporte e a comunicação celular. Os AGE da família n-3
podem agir direta e indiretamente sobre a função endotelial através da redução de
citocinas pró-inflamatórias como a IL-1 e TNF-alfa. O efeito cumulativo dos
mediadores bioativos é evitar vascularização, ou crescimento de novos vasos
sangüíneos dentro da chapa psorítica e, simultaneamente, permitir a melhora da
perfusão dérmica (TRAUB; MARSHALL, 2007).
Dietas ricas em ácidos graxos ômega-3 resultam na substituição de AA (n-6)
por ácido graxo poliinsaturado n-3 na membrana fosfolipídica (KAIMAL; THAPPA,
2010). Como EPA (n-3) pode agir como um inibidor da conversão de AA em
citocinas inflamatórias por ser metabolizado pelas mesmas vias enzimáticas do AA
(ARAUJO; BURGOS; MOURA, 2009), dietas com ingestão rica em EPA exibem um
efeito antiinflamatório.
Dietas vegetarianas podem ser benéficas em todos os
8
pacientes
com
psoríase,
visto
que
há
ingestão
diminuída
de
AA
e
conseqüentemente redução de formação de eicosanóides inflamatórios (WOLTERS,
2005)
Uma dieta anti-inflamatória, citada por Traub e Marshall (2007), consiste
basicamente de uma ênfase em:
gorduras boas, ricas em ácido graxo ômega 3 e 6 (peixes de água
fria, nozes, sementes, azeite, outros óleos de alta qualidade), grãos
integrais, legumes, vegetais e frutas e evitar as gorduras “ruins’’
(saturadas gorduras animais, gorduras trans, alimentos fritos e
processados, óleos de baixa qualidade) e carboidratos refinados,
além disso, uma quantidade excessiva de ácidos graxos n-6 na dieta
pode contribuir para um tipo de resposta pró-inflamatória. As
principais fontes de óleos n-6 são os óleos vegetais como milho,
soja, cártamo, um girassol, enquanto que as principais fontes de
ácido araquidônico são carnes, ovos e laticínios.
Apesar dos resultados ainda inconsistentes, pode-se recomendar a ingestão
de peixes ricos em n-3. (WOLTERS, 2005). A ingestão diária (170g) de óleo de
peixe / EPA DHA 1,8 g / dia ou óleo de peixe (10 cápsulas três vezes ao dia) de
suplementação demonstra efeitos positivos no tratamento da desordem (KAIMAL;
THAPPA, 2010).
2.3 Vitamina D
A vitamina D na sua forma biológica (1,25 dihidroxicholecalciferol) e seus
análogos é, atualmente, um alvo de um número crescente de pesquisas,
demonstrando sua função, além do metabolismo do cálcio e da formação óssea, na
interação com o sistema imunológico, sistema cardiovascular e na prevenção do
câncer, tendo em vista a expressão do receptor de vitamina D em uma ampla
variedade de tecidos corporais como cérebro, coração, pele, intestino, mamas e
células imunológicas, além de ossos (MARQUES; et al., 2010; MILLER; GALLO,
2010).
As enzimas responsáveis pela ativação da vitamina D foram inicialmente
identificadas no fígado e rim. Na pele, a presença da vitamina é essencial para o
desenvolvimento e função dos queratinócitos. Em uma forma autócrina, a Vitamina
9
D3 regula a proliferação dos queratinócitos, a diferenciação e a formação de uma
barreira epidérmica saudável. Alterações nas concentrações dessa vitamina podem
afetar a função imunológica normal, função de barreira cutânea e inflamação
colaborando assim para os fatores que desencadeiam a psoríase (SCHAUBER;
GALLO, 2008).
Dessa forma, essa vitamina juntamente com os retinóides (derivados da
vitamina A natural e sintética) tem sido uma opção terapêutica no tratamento da
psoríase, devido as suas atividades imunorregulatórias e antiproliferativas e também,
como já referido, a diferenciação dos queratinócitos. Porém, segundo estudos, o
tratamento dos transtornos hiperproliferativos, como a psoríase, com análogos da
vitamina D pode induzir hipercalcemia pela hipervitaminose (ARAUJO, 2009; PERIC,
2009; RAYCHAUDHURI; RAYCHAUDHURI, 2009).
Após a sua ativação, a vitamina D é capaz de interagir com o sistema
imunológico através de seus receptores, que são capazes de induzir catelicidinas,
que lhes permitem exercer e efeito antimicrobiano e anti-inflamatório (MILLER;
GALLO, 2010).
Os efeitos da vitamina D no sistema imunológico são pluripotentes, dentre as
suas principais funções podemos destacar: regulação da diferenciação e ativação de
linfócitos, aumento do número e função das células T reguladoras (Treg), inibição da
diferenciação de monócitos em células dendríticas, regulação e diminuição da
produção das citocinas que incluem a supressão da ativação de células T.
Acrescentando influências da maturação, diferenciação e migração das células
apresentadoras de antígenos (REICHRATH, 2007; MARQUES, et al., 2010).
A principal fonte de vitamina D é representada pela formação endógena nos
tecidos cutâneos após a exposição à radiação UVB. Também pode ser ingerida com
menos eficácia por via oral (responsável por apenas 20% das necessidades
corporais) na dieta, na forma de suplementação ou alimentos fortificados. Assim é
sugerido que as pessoas nos países industrializados mantenham os níveis de
vitamina D3 através da ingestão de tais alimentos enriquecidos (SCHAUBER;
GALLO, 2008; PERIC, 2009; MILLER; GALLO, 2010).
As atuais recomendações para a ingestão ideal da vitamina D para o bom
funcionamento do sistema imunológico ainda não foi definida, são apenas baseados
em dados relevantes para a saúde óssea. Provavelmente, esse valor deve ser
10
diferente daquele necessário para prevenir a deficiência de vitamina D ou manter a
homeostase do cálcio (SCHAUBER; GALLO, 2008; MARQUES; et al., 2010).
2.4 Vitamina A
A vitamina A é um álcool (retinol) lipossolúvel que participa de uma série de
funções biológicas e que, por não ser sintetizada no organismo, deve ser fornecida
através da dieta. É necessária para o crescimento, estabilização das membranas,
diferenciação celular epitelial, e mantém a integridade dessas células (CHAGAS, et
al., 2003).
Assim sendo, uma ingestão nutricional adequada de Vitamina A pode diminuir
a severidade dos quadros infecciosos, enquanto a deficiência pode aumentá-la,
devido a prejuízos no sistema imunológico (GOMES; et al., 2005).
Os mecanismos da ação dessa vitamina sugerem que esse micronutriente
participa dos receptores nucleares e seus ativadores, que regulam a expressão dos
genes relacionados ao metabolismo da vitamina D e ácidos graxos, entre outras
moléculas; assim, essa vitamina possui de certa forma os mesmos mecanismos
utilizados pela vitamina D e ácidos graxos para o tratamento de certas disfunções e
também a inflamação (GOMES, et al., 2005).
As consequências da carência desta vitamina são: hiperqueratose (principal
característica da psoríase), obstrução dos folículos pilosos pela queratina, retardo no
crescimento e desenvolvimento, deficiência no sistema imune, cegueira e também
síndromes de má absorção (GOMES 2005; STRUTZEL; CABELLO; QUEIROZ,
2007).
A vitamina A é encontrado em alimentos de origem animal, como ovos, fígado
e pescado, e a pró-vitamina A também se encontra em vegetais verdes, tomates e
laranjas (STRUTZEL; CABELLO; QUEIROZ, 2007).
2.5 Ácido Fólico
O ácido fólico é a vitamina B9 do complexo B, sendo a forma sintética do
folato, utilizado na fortificação de alguns alimentos (SMITH, et al., 2008).
11
As principais fontes alimentares de ácido fólico são espinafre, feijão branco,
verduras de folhas escuras, soja e derivados, laranja, maçã, brócolis, gema de ovo,
fígado, peixe, gérmen de trigo, amendoim, porém o cozimento prolongado dos
alimentos pode destruir até 90% do seu conteúdo da vitamina (NASSER, et al.,
2005).
Diversos estudos apontam a associação entre a deficiência do ácido com
algumas enfermidades crônicas da pele entre elas a psoríase (NASSER, et al., 2005;
SMITH; et al., 2008).
Essa vitamina é ainda essencial no metabolismo da homocisteína, aminoácido
tóxico para o endotélio capilar, mantendo seus níveis normais no organismo, e
conforme os autores sua dose recomendada é de 1-5mg/dia (NASSER, 2005;
TRAUB; MARSHAL, 2007).
A hiperhomocisteinaemia (HPHC) resulta da deficiência de enzimas e/ou
vitaminas (ácido fólico, vitamina B6 e B12). Níveis elevados de homocisteína tem
sido relatados em pacientes com psoríase (ÇAKMAK, et al., 2008).
O nível de homocisteína no plasma está diretamente correlacionado com a
gravidade da psoríase. Pacientes com a doença podem ter uma tendência a
desenvolver HPHC, pode predispor a níveis plasmáticos reduzidos de folato. Assim
esses fatores são correlacionados através da interação entre a psoríase, deficiência
nutricional e doença celíaca (ÇAKMAK, et al., 2008).
O aumento da ingestão de ácido fólico leva à concentração de folato e ácido
fólico não metabolizado. Concentrações sanguíneas elevadas dessa vitamina podem
estar relacionadas com a diminuição da citotoxicidade das células Natural Killer, em
contra-partida, altos níveis de folato podem reduzir a resposta às drogas utilizadas
contra a artrite reumatóide, psoríase e câncer (ÇAKMAK; et al., 2008; LOW; et al.,
2008).
O tratamento com ácido fólico pode inibir a ativação de macrófagos. Os
resultados revelaram que a psoríase tem participação significativa dos macrófagos
ativados e também de citocinas, que possuem a função de mediar os sintomas da
maioria das doenças inflamatórias. Se a eliminação de macrófagos ativados com
terapias com folato pode suprimir os sintomas de doenças inflamatórias, mesmo
após essas associações, exige uma investigação mais aprofundada (LOW, et al.,
2008).
12
3 TRATAMENTOS CONVENCIONAIS
Diversos tipos de tratamentos estão disponíveis que podem permitir melhora
e controle , a curto e longo prazo, mas essas medidas não levam a cura completa da
psoríase (WOLTERS, 2005).
O tratamento da doença dependerá da sua forma clínica, gravidade e da
extensão das lesões psoriáticas como também da idade, gênero, situação sócioeconômica e das condições do paciente em relação à saúde geral. Tem também por
objetivo o controle clínico e a melhora da qualidade de vida do paciente (MARQUES,
2009).
Segundo Wolters (2005), os desafios que permanecem com o uso dos
biológicos para a psoríase incluem:
compreender os mecanismos predominantes na psoríase e artrite
psoriática, compreender as respostas do paciente à terapia diferente,
prevendo a resposta clínica antes ou no início da terapia, o
desenvolvimento por uso oral, e formulações tópicas e determinar se
o tratamento vem a alterar a longo prazo.
Anatomicamente, o retorno da pele ao estágio aparentemente normal após o
tratamento das lesões de psoríase pode ser devido à preservação da junção dermoepidérmica, uma estrutura fina entre a epiderme e a derme, composta de muitas
proteínas especializadas responsáveis pela manutenção da epiderme e da derme
(JOHNSON-HUANG; KRUEGER, 2009).
Para o tratamento inicial da psoríase em áreas da pele, o mais eficaz é uma
combinação de esteróides tópicos potentes e calcipotriol. Esta recomendação, no
entanto é baseada em evidências limitadas. Uma alternativa seria começar com
calcipotriol, ou apenas um retinóide tópico (LUBA; STULBERG, 2006; MARQUES,
2009).
Os quadros leves podem ser tratados apenas com medicações tópicas que
fornecem alguns benefícios, como exemplos: calcipotriene (Dovonex®: um análogo
sintético da vitamina D3), Aloe Vera, e Flavsalve®: ricos em flavonóides (TRAUB,
MARSHAL, 2007).
Lipídeos intercelulares como as ceramidas (moléculas lipídicas composto por
ácidos graxos) desempenham um papel importante na regulação da homeostase e
13
capacitação de retenção de água da pele. Foi demonstrado que essa capacidade de
retenção de água epidérmica e a quantidade de ceramidas são diminuídas na
epiderme psoriática. As ceramidas têm demonstrado benefício no tratamento da
psoríase e podem melhorar a função barreira da pele e assim consequentemente
diminuindo a perda de água (TRAUB, MARSHAL, 2007).
Estas medicações tópicas citadas anteriormente podem ser utilizadas como
adjuvantes da fototerapia, que depende da irradiação aplicada (UVB ou UVA),
utilizadas isoladamente ou associadas à medicação sistêmica que geralmente
envolve o uso de metotrexato, acitretina, ciclosporina, agentes biológicos, entre
outros (TRAUB, MARSHAL, 2007). Há também a possibilidade de associação
desses tratamentos com a psicoterapia, no qual é uma terapia de suporte muitas
vezes recomendada aos doentes. Segundo os autores citados, na psoríase
moderada a grave, a fototerapia deve ser a primeira opção terapêutica (DUARTE,
2010; MARQUES, 2009).
A
rotação de combinações terapêuticas aumenta a eficácia e diminui a
toxicidade do tratamento. Técnicas de biologia molecular estão permitindo a busca
de gens de suceptibilidade da psoríase e provavelmente os pacientes, num futuro
próximo, poderão beneficiar-se de terapias gênicas, que diretamente, inibem os
genes específicos da psoríase e também a terapia com células-tronco. No entanto,
os efeitos adversos e toxicidade dos tratamentos convencionais na psoríase
apresentam-se mais seguros e eficientes assim como também os tratamentos
naturais que podem ser utilizados como alternativas ou de uma forma integrativa
(MARTINS; ARRUDA, 2004; TRAUB; MARSHAL, 2007).
As recomendações para mudanças na dieta e estilo de vida não substituem a
terapia convencional, mas se integrar a ela e, assim, melhorar a resposta ao
tratamento, permitindo aos pacientes depender menos das soluções farmacêuticas.
Ao mesmo tempo, a associação da manipulação de medicamentos e a regularização
da dieta, o aumento na qualidade de vida podem realmente diminuir o efeito de
fatores etiológicos subjacentes que predispõem a doença (TRELOAR, 2010).
A prevalência e a gravidade da psoríase têm se mostrado diminuídas durante
os períodos de jejum. Dietas hipocalóricas levam à melhora dos sintomas e podem
ser importantes fatores adjuvantes na prevenção e no tratamento da mesma
(ARAUJO; BURGOS; MOURA, 2009).
14
A prática de exercícios físicos auxilia no tratamento da psoríase, porém
quando praticados de forma extenuante, provocam estresse oxidativo e dano celular.
Se praticados com moderação aumentam a expressão de enzimas antioxidantes e,
portanto, evitam o estresse oxidativo que pode desencadear ou agravar o quadro da
doença (WOLTERS, 2005; TRELOAR, 2010).
METODOLOGIA
A revisão bibliográfica utilizou artigos científicos disponíveis nas bases de
dados científicas National Library of Medicine (MEDLINE-PUBMED), Literatura
Latinoamericana y Del Caribe em Ciencias de La Salud (LILACS-BIREME), Scientific
Eletronic Library Online (SciELO) e CAPES em meio eletrônico, os quais foram
pesquisados a partir das seguintes palavras-chave (descritores na área da saúde):
psoríase/psoriasis/psoriasis; ácidos graxos essenciais/essential fatty acids/ácidos
graxos
essenciales;
sistema
imune/immune
system/sistema
immune;
eicosanóides/eicosanoids/eicosanóides; vitamina D/vitamin D/vitamina D/ ; vitamina
A/vitamin A/vitamina A; ácido fólico/folic acid/ácido fólico; doença celíaca/celiac
disease/ enfermedad celíaca.
A pesquisa bibliográfica incluiu artigos originais, artigos de revisão, editoriais e
legislação específica escritos nas línguas portuguesa, inglesa, e espanhola. Os
levantamentos dos estudos referentes ao tema escolhido incluíram o período de
2003 a 2010.
CONSIDERAÇÕES FINAIS
A ingestão de determinados compostos bioativos e nutrientes de alimentos
funcionais atuam no tratamento da psoríase por interferir no sistema imune, condutor
do processo inflamatório.
Os ácidos graxos ômega 3 agem de maneira anti-inflamatória na redução da
produção de ácidos graxos ômega 6 que derivam o ácido araquidônico, potente
elemento pró-inflamatório. A vitamina D e seus análogos controlam as atividades
15
imunorregulatórias e antiproliferativas da epiderme. No entanto, o seu consumo
ainda não foi abordado de forma terapêutica às alterações imunes, podendo induzir
a hipercalcemia pela hipervitaminose.
A vitamina A mantém a integridade das células epiteliais e sua carência gera
a principal queixa da psoríase, a hiperqueratose e deficiência no sistema imune. O
glúten aumenta a permeação intestinal, permitindo a passagem de microorganismos
que induzem uma inflamação. Este processo inflamatório funciona como estímulo a
manifestação da psoríase.
A ingestão de ácido fólico pode estar relacionada com a inibição da ativação
de macrófagos relacionados ao processo inflamatório, em contrapartida, pode
reduzir o efeito de drogas terapêuticas da psoríase.
Já o glúten, deve ser mantido fora das dietas de psoríticos com doença
celíaca. Uma vez que os portadores desta doença têm maior capacidade de
permeação intestinal, permite a passagem de microorganismos que induzem uma
inflamação. Este processo inflamatório funciona como estímulo a manifestação da
psoríase.
A alteração da dieta dos portadores da desordem deve servir como uma
terapêutica complementar aos tratamentos convencionais. Medicamentos tópicos e
fototerapia são os recursos mais utilizados. Estes são receitados de acordo com a
forma clínica, gravidade e extensão da doença.
A partir da análise realizada, sugerimos a continuidade de estudos científicos
mais aprofundados, principalmente relacionados ao consumo adequado destes
nutrientes e compostos bioativos no controle da psoríase. Estes devem ser ingeridos
de maneira a evitar efeitos colaterais e intervenções aos tratamentos convencionais.
REFERÊNCIAS
ABENAVOLI, L.; et al. Celiac disease and skin: Psoriasis association. World J
Gastroenterol, [S.l.], v. 13, n. 14, p. 2138-2139, Apr. 2007.
ABENAVOLI, L. et al. Cutaneous manifestations in celiac disease. World J
Gastroenterol, [S.l.], v. 12, n. 6, p. 843-852, Feb. 2006.
16
ANDRADE, P. M. M.; CARMO,M. G. T. Ácidos graxos n-3: um link entre
eicosanóides, inflamação e imunidade. Rev MN Metabólica, [S.l.], v. 8, n. 3, jul/set.
2006.
ARAUJO, M., L., D.; BURGOS, M., G., P., A.; MOURA, I., S., C. Influências
nutricionais na psoríase. An Bras Dermatol. Recife-PE, v.84, n.1, p. 90-91, 2009;
BAK, R. O.; MIKKELSEN, J. G. Regulation of small cytokines by RNAs during skin
inflammation. J Biomed Sci, [S.l.], v.17, n.1, p.53-72, 2010.
ÇAKMAK, SK.; et al. Homocisteine, Vitamin B12, and acid folic levels in psoriasis
patients. Jorn Eur Acad Derm and Venereolougy, Turkey, v. 23, p. 300-303, Jul.
2008.
CALDER, P. C, Polyusaturated fatty acids and inflammatory processes: new twists in
an old tale. Biochimie, [S.l.], v. 91, n. 6, p. 791-795, 2009.
CALDERÓN, P., et al. Estudio de enfermedad celíaca em pacientes com psoriasis.
Rev Méd Chile, [S.l.], v. 135, p. 1296-1303, 2007.
CHAGAS, C., M., H.; et al. Teratogenia da Vitamina A. Rev. Bras. Saúde Matern.
Infant., Recife, v. 3, n. 3, p. 247-252, Set. 2003.
DAS, R. P.; JAIN, A. K.; RAMESH, V.: Current concepts in the pathogenesis of
psoriasis. Indian J Dermatol., [S.l.], v.54, n.1, p. 7-12, 2009;
DUARTE, V., Gleison; et al. Psoríase e obesidade: revisões de literatura e
recomendações no manejo. An Bras Dermatol, [S.l.], v. 85(3), p. 355-360, 2010.
GHAZIZADEH, R.; et al. Pathogenic mechanisms shared between psoriasis and
Cardiovascular diseases. Int J Med Scis, [S.l.], v. 7, n.5, p. 284-289, 2010.
GOMES, M. M.; et al. Papel da Vitamina A na prevenção do estresse oxidativo em
recém nascidos. Rev. Bras. Saúde Matern. Infant., Recife, v.5, n.3, p. 275-282, Set.
2005.
HUMBERT, P., et al. Gluten intolerance and skin diseases. Eur J Dermatol, [S.l], v.
16, n. 1, p. 4-11, 2006.
ILKOVITCH, D., Role of immune-regulatory cells in skin pathology. J Leukocyte
Biol, [S.l], v.89, p. 1-9, Jun. 2010.
JOHNSON-HUANG, M. L.; KRUEGER, G. J. Cytokine-producing dendritic cells in the
pathogenesis of inflammatory skin diseases. J Clin Immunol., New York, v.29, n.3,
p. 247-256, May, 2009.
KAIMAL, S.; THAPPA, D. M. Diet in dermatology: Revisited. Indial J Dermatol,
Venereol Leprol, [S.l], v. 76, p. 103-115, 2010.
LOGAN, A. C. Further support for the protective effect of linoleic acid against
psoriasis. Int J Dermatol, [S.l], v.44, n.6, p.528-529, 2005.
LOW, P. S.; et al. Discovery and development of folic-acid-based receptor targeting
for imaging and therapy of cancer and inflammatory diseases. Accounts Chem
Res, Indiana, v. 41, n.1, p.120-129, Jan. 2008.
17
LUBA, K. M.; STULBERG, L., Daniel. Chronic Plaque Psoriasis. Am Acad Fam
Physic, [S.l], v. 73, n. 4, feb. 2006.
MARQUES, L.D. C. et. Al. A importância dos níveis de Vitamina D nas doenças
autoimunes. Rev. Bras. Reumatol, [S.l], v. 50, n.1, Fev. 2010.
MARQUES, S. A. Conceito, Epidemiologia, Genética, Imunopatogênese. Cons Bras
Psoríase, Rio de Janeiro, p.6, 2009.
MARTIN, C. A. ; et al. Ácidos graxos poliinsaturados Omega-3 e Omega-6:
importância e ocorrência em alimentos. Rev. Nutr., Campinas, v. 19, n. 6, p. 761770, Nov/dez. 2006.
MARTINS, G. A.; ARRUDA, L. Tratamento sistêmico da psoríase Parte I:
metotrexato e acitretina. An. Bras. Dermatol., Rio de Janeiro, p. 263-278, Jun.
2004.
MILLER, J.; GALLO D. R. Vitamin D and innate immunity. Dermatol Therapy,
California, v.23, n.11, p. 13-22, 2010.
MROWIETZ, U.; REICH K. Psoriasis: new insights into pathogenesis and treatment.
Dtsch Arztebl Int., [S.l], v.106, n.1-2, p. 11-19, 2009.
NASSER C., et al. Semana da conscientização sobre a importância do ácido Fólico.
J Epilepsy Clin Neurophiosiol, [S.l], v.11, n.4, p. 199-203, Out. 2005.
NEIMANN, A. L.; PORTER, S. B.; GELFAND, J. M. The epidemiology of psoriasis.
Expert Ver. Dermatol, [S.l], v.11, n.4, p. 63-75, 2006;
PERIC, M. et. al. Vitamin D Analog Differentially Control Antimicrobial
Peptide/’’Alarmin’’ Expression in Psoriasis. J Pone, [S.l], v.4, n. 7, p.1-10, 2009.
RAYCHAUDHURI, P. Siba; RAYCHAUDHURI, K. Smriti. Biologics: Target-specific
treatment of systemic and cutaneouus autoimmune diseases. Indian J Dermatol,
[S.l], v.54, n.2, p.100-109, 2010;
RAYCHAUDHURY, S. P. Recent advances in psoriasis: bench to bedside. Indian J
Dermatol, [S.l], v. 55, n.2, p. 150, 2010.
REICHRATH, J. Vitamin D and skin: an ancient friend. Exp Dermatol, [S.l], v. 16,
n.7, p. 618-625, 2007.
ROCHA-PEREIRA, et al. The inflammatory response in mild and in severe psoriasis.
Br J Dermatol, [S.l], v. 150, n.5, p. 917-928, 2004;
SCHAUBER J.; GALLO,L. R. The vitamin D pathway: a new target for control of the
skin’s immune response?. Exp Dermatol, [S.l], v. 17, n.8, p. 633–639, Aug. 2008.
SILVA, K. S.; SILVA, E. A. T. Psoríase e sua relação com aspectos psicológicos,
stress e eventos da vida. Estudos de Psicologia, Campinas, v. 24, n.2, p. 257-266,
abr/jun. 2007.
SILVA, T. S. G.; FURNALLETO,T. W. Diagnósticos de doença celíaca em adultos.
Rev. Assoc. Med. Bras., São Paulo, v. 56, n. 1, 2010.
18
SMITH, D.; et al. Is folic acid good for everyone? Am J Clin Nutr, v. 87, n.3, p. 517533, 2008.
STANKE-LABESKE, F; et al. Effect of dietary supplementation with increasing doses
of docosahexaenoic acid on neutrophil lipid composition and leukotriene production
in human healthy volunteers. Br. J. Nutr., [S.l], v. 100, n. 4, p. 829-833, 2008.
STRUTZEL, E; CABELLO, H; QUEIROZ, L, M.C. Análise dos fatores de risco para o
envelhecimento da pele: aspectos gerais e nutricionais. Rev Bras Nutr Clin, [S.l],
v.22, n.2, p.139-145, 2007.
TRAUB, M.; MARSHALL, K. Psoriasis – Pathophysiology, Convetional and
Alternatives Approuches to treatment. Altern Med Rev, [S.l], v. 12, n.4, 2007.
TRELOAR, V. Integrative Dermatology for psoriasis: facts and controversies. Clin
dermatol, Newton, v. 28, n. 1, p. 93-99, 2010.
VOLP, A. C. P.; et al., Capacidade dos biomarcadores inflamatórios em predizer a
síndrome metabólica. Arq Bras Endocrinol Metabol, São Paulo, v.52, n.3, Abr.
2008.
WOLTERS, M. Diet and psoriasis: experimental data and clinical evidence. Br J
Dermatol, Germany, v.153, p. 706-714, 2005.