LEE - Termodinâmica e Estrutura da Matéria
1º Teste
Duração: 1h15m
2015/2016 – 2º Semestre – 15-04-2016 – 18h00m
Nota: justifique todas as respostas.
Problema 1
(1,5 val; 2,5 val; 2,0 val, 1.0 val)
Uma mol de 1 gás ideal monoatómico encontra-se à pressão de 6 x 105 Pa e ocupa um volume de
10 litros (estado A). De seguida, o sistema sofre as seguintes transformações reversíveis:
i)
AB : Transformação isotérmica e a pressão diminui para metade (PB = PA / 2);
ii)
BC : Transformação isobárica, até o volume igualar o seu valor inicial;
iii) CA : Transformação isocórica, levando o gás às condições iniciais.
1.a) Desenho o ciclo ABCA num diagrama P-V e calcule os valores da pressão, volume e
temperatura, P, V e T, nos três estados A, B e C.
1.b) Calcule a variação de energia interna U do gás, e o trabalho W e calor Q trocados com o
sistema envolvente em cada uma das três transformações. Calcule ainda os valores totais de
U, Q e W gerados ao fim de cada ciclo termodinâmico.
1.c) Identifique onde ocorrem as trocas de calor com a fonte quente (ou fontes quentes) e a fonte
fria (ou fontes frias) e calcule a eficiência de um motor que adopte este ciclo. Compare-a com
a de um motor ideal que funcione entre as duas temperaturas extremas do ciclo.
1.d) Seria possível anular a troca de calor durante a transformação BC? Porquê?
Dado:
Problema 2
R = 8.31 J/(mol K)
(1,5 val; 2,0 val; 0,5 val, 1,0 val)
2.a) Determine a quantidade de calor necessária para converter total e irreversivelmente 10g de
água que se encontram a 90ºC em vapor de água a 100ºC.
2.b) Calcule a variação de entropia do sistema.
2.c) Qual será a variação de entropia do universo causada por esta transformação? Porquê?
2.d) Considere a transformação irreversível inversa: 10g de vapor de água a 100ºC convertidos
em água a 90ºC. Neste caso, o que pode afirmar sobre a variação da entropia do universo?
Dados:
cgelo = 2220 J/(kg ºC)
cágua = 4186 J/(kg ºC)
Lfusão = 33,5.104 J/kg
Lvaporização = 22,6.105 J/kg
1
cvapor = 2020 J/(kg ºC)
Problema 3
(0,25 val; 1,25 val ; 1,25 val; 1,25 val)
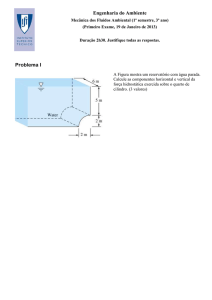
Duas placas permanecem a temperaturas diferentes, sendo a temperatura T4 superior à
temperatura T1, e estão ligados termicamente através de cubos metálicos, de acordo com o
esquema da figura. Todos os cubos têm a mesma aresta L. Obtenha expressões para:
3.a) a resistência térmica dos cubos de Al e de Cu;
3.b) a resistência térmica e a corrente térmica em cada ramo do circuito;
3.c) a resistência térmica total e a corrente térmica total do circuito.
3.d) Na interface entre os cubos, qual das duas temperaturas T2 ou T3 será a mais elevada?
Dados:
Problema 4
KAl = 237 W/(m.K)
KCu = 401 W/(m.K)
(1,0 val; 1,0 val; 2,0 val)
Considere 1 mol de um certo gás e a energia livre de Helmholtz deste sistema gasoso, F.
4.a) A partir da equação diferencial da energia livre do sistema, U, ou do primeiro princípio da
Termodinâmica, obtenha a equação diferencial para F.
4.b) A partir do diferencial de F obtenha relações entre este potencial termodinâmico e as
variáveis naturais P, T, V e S.
4.c) A evolução da energia livre de Helmholtz neste sistema é descrita pela função
F = – a/v – RT ln (v-b) + J(T)
sendo a e b duas constantes e J uma função que depende unicamente de T. Determine a
equação de estado do gás.
2